Nikotinamidadenindinukleotid
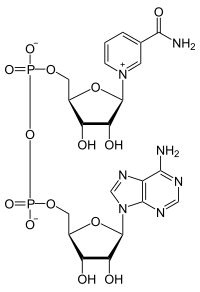
NAD+, nikotinamidadenindinukleotid, är ett koenzym som deltar i flertalet organismers ämnesomsättning. NAD+ och dess fosforylerade och reducerade former NADP+, NADH och NADPH har centrala roller inom cellernas metabolism och energiproduktion. De förmedlar överföring av två väteatomer mellan molekyler vid oxidations- och reduktionsprocesser i bland annat citronsyracykeln och glykolysen.[1] Koenzymet är en dinukleotid då det består av två nukleotider som förenats genom deras respektive fosfatgrupper.
I de flesta organismer kan NAD+ tillverkas av enkla byggstenar (de novo) från aminosyrorna tryptofan och asparaginsyra. Ett annat sätt är att mer komplexa komponenter till koenzymet tas upp från födan i form av vitaminet niacin. Dessa komponenter genomgår sedan en räddningsaktion där de återvinns till sin aktiva form.
Fysiska och kemiska egenskaper
Nikotinamidadenindinukleotid, NAD+ består, i likhet med alla andra dinukleotider, av två nukleosider sammanbundna av två fosfatgrupper. Dessa nukleosider innehåller en ribosring vardera, den ena med kvävebasen adenin bunden till den första kolatomen och den andra med nikotinamid på samma position. Nikotinamidenheten kan bindas till denna anomeriska kolatom på två sätt. Detta ger upphov till två skilda strukturformer och NAD+ finns därmed som två diastereomerer. I levande organismer förekommer dock endast ß-nikotinamidformen av NAD+. Denna nukleotid sammanlänkas genom två fosfatgrupper som binder till den femte kolatomen.[2]

Inom metabolismen accepterar eller donerar koenzymet elektroner i en redoxreaktion.[3] Dessa reaktioner (sammanfattade i reaktionsformeln nedan) innefattar ett avgivande av två väteatomer från reaktanten (R) i form av en hydridjon (H-) samt en proton (H+). Protonen släpps ut i en lösning medan reduktionsmedlet RH2 oxideras och NAD+ reduceras till NADH via överföring av hydriden till nikotinamidringen.
RH2 + NAD+ → NADH + H+ + R
Den ena elektronen i hydridelektronparet överförs till det positivt laddade kvävet i nikotinamidringen i NAD+ och väteatomen som blir över överförs till kolatomen på motsatt sida av kvävet (C4). Elektrodpotentialen i NAD+/NADH redoxparet är -0,32 volt. Detta gör NADH till ett starkt reduktionsmedel.[4] Reaktionen kan också lätt gå i båda riktningar eftersom NADH oxideras tillbaka till NAD+ när det reducerar en annan molekyl. Detta betyder att koenzymet ständigt kan byta identitet mellan NAD+ och NADH utan att själv konsumeras.[5]
Koncentration och tillstånd i celler
I en råttlever är den totala mängden NAD+ och NADH ungefär 1 µmol per gram våt vikt. Detta är ungefär 10 gånger så höga värden som koncentrationen av NADP+ och NADPH i samma celler.[6] Den faktiska koncentrationen av NAD+ i cellernas cytosol är svårare att mäta men uppskattningar visar på ett värde kring 0,3 mM. Jäst innehåller betydligt högre halter av NAD+, uppskattningsvis så mycket som 1,0-2,0 mM.[7]
Förhållandet mellan den oxiderade och den reducerade formen av NAD+ kallas NAD+/NADH-kvoten. Denna kvot spelar en viktig roll i den så kallade redoxstatusen i en cell. Redoxstatusen hos en cell indikerar både metabolisk aktivitet och hälsan hos cellerna.[8] Effekterna av redoxstatusen är komplexa. Den kontrollerar till exempel aktiviteten av ett antal viktiga enzymer, så som glyceraldehyd-3-fosfatdehydrogenas och pyruvatdehydrogenas. I friska däggdjursvävnader ligger uppskattningar av kvoten mellan fritt NAD+ och NADH i cytoplasman oftast kring 700 vilket innebär att det finns 700 gånger så mycket fritt NAD+ som fritt NADH.[9] Den totala kvoten mellan NAD+ och NADH är dock mycket lägre. Här ligger uppskattningarna oftast kring 3-10 i däggdjur.[10]
Funktioner
NAD+ har flera viktiga roller i metabolismen. Det agerar som ett koenzym i redoxreaktioner, som donator av ADP-ribos i ADP-ribosylationreaktioner, ingår i second messenger-molekylen cyclic ADP-ribose och agerar som ett substrat bakteriellt DNA-ligas och enzymgruppen sirtuiner som använder NAD+ för att avlägsna acetylgrupper från proteiner. Utöver dessa metalliska funktioner uppstår NAD+ som en adeninnukleotid som kan släppas ut från celler både spontant och av reglerade mekanismer.[11] NAD+ kan därmed också ha viktiga extracellulära användningsområden.
Oxidoreduktas bindning av NAD+
Den största rollen hos NAD+ inom metabolismen är att överföra elektroner från en molekyl till en annan. Reaktioner av denna typ blir katalyserade av en stor grupp enzymer, så kallade oxidoreduktaser. Det korrekta namnet på dessa enzymer innehåller namnet på båda deras substrater. Till exempel katalyserar NADH-ubiquinonoxidoreduktas oxidationen av NADH med koenzym Q.[12] Hur som helst blir enzymerna även refererade till som dehydrogenaser eller reduktaser. NADH-ubiquinonoxidoreduktas blir oftast refererad till som NADH dehydrogenas eller ibland koenzym Q-reduktas.[13]
När NAD+ respektive NADH är bundet till ett protein hålls de vanligtvis inom ett strukturmotiv känt som (på engelska) ”the Rossmann fold".[14] Motivet är uppkallat efter Michael Rossmann som var den första forskaren att upptäcka hur vanlig denna struktur är inom nukleotidbindande proteiner.[15] Strukturen innehåller tre eller fler parallella betaflak sammanlänkade med två alfahelixar i ordningen beta-alfa-beta-alfa-beta. Detta bildar ett betaflak omgett av ett lager alfahelixar på varje sida. Eftersom varje motiv binder till en nukleotid består varje bindande domän av NAD+ av två ihopparade motiv som båda binder till en av de två nukleotiderna av kofaktorn.[15] Dock är detta strukturmotiv inte universellt bland enzymer som är beroende av NAD+ då en grupp bakteriella enzymer, involverade i aminosyrornas metabolism, som på senare tid upptäckts binder till koenzymet men saknar motivet.[16]
Roll inom redoxmetabolism
Redoxreaktionerna som katalyseras av oxidoreduktaserna är mycket viktiga inom alla delar av metabolismen men ett speciellt viktigt område där sådana reaktioner sker är i frisläppandet av energi från näringsämnen. Här oxideras reducerade föreningar så som glukos och fettsyror och energi frigörs. Energin överförs sedan till NAD+ genom reduktion till NADH som en del av fettsyracykeln, glykolysen och citronsyracykeln. I eukaryoter överförs elektronerna som bärs av NADH till mitokondriernas inre matrix genom mitokondriens skyttlar så som till exempel malat-aspartatskytteln.[17] Dessa skyttelsystem har samma transportfunktion även hos kloroplaster.[18]
Eftersom både den oxiderade och den reducerade formen av nikotinamidadenindinukleotid används i dessa sammanlänkade reaktioner behåller cellen signifikanta koncentrationer av både NAD+ och NADH. Den höga NAD+/NADH-kvoten tillåter koenzymet att agera både som oxidations- och reduktionsmedel.[19] I kontrast till detta är den huvudsakliga funktionen hos NADPH att fungera som reduktionsmedel inom anabolismen. Detta koenzym är involverat i bland annat fettsyrasyntesen och fotosyntesen. Eftersom NADPH behövs för att driva redoxreaktioner som ett starkt reduktionsmedel hålls NADP+/NADPH-kvoten väldigt låg.[19]
Se även
Källor
- ^ ”Nationalencyklopedin - NAD”. http://www.ne.se/uppslagsverk/encyklopedi/l%C3%A5ng/nad. Läst 5 juni 2024.
- ^ ”NAD+ metabolism in health and disease”. https://dx.doi.org/10.1016%2Fj.tibs.2006.11.006. Läst 5 juni 2024.
- ^ ”NAD+ metabolism in health and disease”. Arkiverad från originalet den 4 juli 2009. https://web.archive.org/web/20090704054108/http://biochem.uiowa.edu/brenner/documents/belenky07a.pdf. Läst 5 juni 2024.
- ^ Unden, G; Bongaerts, J. ”Alternative respiratory pathways of Escherichia coli: energetics and transcriptional regulation in response to electron acceptors”. Biochimica et Biophysica Acta (BBA) - Bioenergetics 1320 (3): sid. 217–234. doi:. http://www.sciencedirect.com/science/article/pii/S0005272897000340. Läst 6 juni 2016.
- ^ Pollak, Nadine; Dölle, Christian; Ziegler, Mathias. ”The power to reduce: pyridine nucleotides – small molecules with a multitude of functions” (på engelska). Biochemical Journal 402 (2): sid. 205–218. doi:. ISSN 0264-6021. http://www.biochemj.org/content/402/2/205. Läst 6 juni 2016.
- ^ ”Measurement of tissue purine, pyrimidine, and other nucleotides by radial compression high-performance liquid chromatography”. http://www.sciencedirect.com/science/article/pii/0003269784901489. Läst 5 juni 2024.
- ^ ”Nicotinamide Riboside Promotes Sir2 Silencing and Extends Lifespan via Nrk and Urh1/Pnp1/Meu1 Pathways to NAD+”. http://www.cell.com/cell/abstract/S0092-8674(07)00390-X?_returnURL=http%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS009286740700390X%3Fshowall%3Dtrue. Läst 6 juni 2024.
- ^ ”Redox environment of the cell as viewed through the redox state of the glutathione disulfide/glutathione couple”. https://dx.doi.org/10.1016%2FS0891-5849%2801%2900480-4. Läst 6 juni 2024.
- ^ Williamson, D. H.; Lund, Patricia; Krebs, H. A.. ”The redox state of free nicotinamide-adenine dinucleotide in the cytoplasm and mitochondria of rat liver”. Biochemical Journal 103 (2): sid. 514–527. ISSN 0264-6021. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1270436/. Läst 6 juni 2016.
- ^ ”Nicotinamide adenine dinucleotide, a metabolic regulator of transcription, longevity and disease”. https://dx.doi.org/10.1016%2FS0955-0674%2803%2900006-1. Läst 6 juni 2024.
- ^ ”Release of β-Nicotinamide Adenine Dinucleotide upon Stimulation of Postganglionic Nerve Terminals in Blood Vessels and Urinary Bladder”. https://dx.doi.org/10.1074%2Fjbc.M407266200. Läst 6 juni 2024.
- ^ ”Enzyme Nomenclature”. www.chem.qmul.ac.uk. Arkiverad från originalet den 5 december 2007. https://web.archive.org/web/20071205181246/http://www.chem.qmul.ac.uk/iubmb/enzyme/. Läst 6 juni 2016.
- ^ ”ENZYME entry 1.6.5.3”. www.expasy.org. Arkiverad från originalet den 19 december 2007. https://web.archive.org/web/20071219032216/http://www.expasy.org/enzyme/1.6.5.3. Läst 6 juni 2016.
- ^ ”NAD-binding domains of dehydrogenases”. https://dx.doi.org/10.1016%2F0959-440X%2895%2980010-7. Läst 6 juni 2024.
- ^ [a b] S.T. Rao, Michael G. Rossmann. Comparison of super-secondary structures in proteins.
- ^ Goto, Masaru; Muramatsu, Hisashi; Mihara, Hisaaki. ”Crystal Structures of Δ1-Piperideine-2-carboxylate/Δ1-Pyrroline-2-carboxylate Reductase Belonging to a New Family of NAD(P)H-dependent Oxidoreductases CONFORMATIONAL CHANGE, SUBSTRATE RECOGNITION, AND STEREOCHEMISTRY OF THE REACTION” (på engelska). Journal of Biological Chemistry 280 (49): sid. 40875–40884. doi:. ISSN 0021-9258. http://www.jbc.org/content/280/49/40875. Läst 6 juni 2016.
- ^ Barbara M. Bakker, Karin M. Overkamp, Antonius J.A. van Maris, Peter Kötter, Marijke A.H. Luttik, Johannes P. van Dijken, Jack T. Pronk. Stoichiometry and compartmentation of NADH metabolism in Saccharomyces cerevisiae.
- ^ Heineke, Dieter; Riens, Burgi; Grosse, Heike. ”Redox Transfer across the Inner Chloroplast Envelope Membrane 1”. Plant Physiology 95 (4): sid. 1131–1137. ISSN 0032-0889. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1077662/. Läst 6 juni 2016.
- ^ [a b] Ferguson, Nicholls (2002). Bioenergetics 3. Läst 6 juni 2024
