Klorambucil
| Klorambucil | |
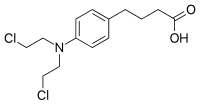  | |
| Systematiskt namn | 4-[4-[bis(2-kloretyl)amino]fenyl]butansyra |
|---|---|
| Övriga namn | Leukeran |
| Kemisk formel | C₁₄H₁₉Cl₂NO₂ |
| Molmassa | 304,211 g/mol |
| Utseende | blekt beige grynigt pulver |
| CAS-nummer | 305-03-3 |
| SMILES | c1cc(ccc1CCCC(=O)O)N(CCCl)CCCl |
| Egenskaper | |
| Smältpunkt | 65 °C |
| Faror | |
| Huvudfara | Sönderfaller till giftiga gaser (HCl och kväveoxider) vid upphettning |
| NFPA 704 | |
| LD50 | 76 mg/kg [råtta] 80 mg/kg [mus] |
| SI-enheter & STP används om ej annat angivits | |
Klorambucil (marknadsfört som Leukeran av Glaxo Smith Kline) är ett läkemedel för kemoterapi. Det är en kvävesenapsförening som är ett alkyleringsmedel[1] och kan ges oralt.
Klorambucil finns med på Världshälsoorganisationens lista över essentiella läkemedel.[2]
Historia
Kvävesenapsföreningar uppstod genom derivatisering av svavelbaserad senapsgas, efter det att militär personal som exponerats för senapsgas under första världskriget visade sig ha minskat antal blodkroppar.[3] Eftersom svavelbaserad senapsgas var för giftig för att användas på människa, antog Gilman et al. att man genom att minska elektrofiliciteten hos medlet kunde få fram mindre giftiga läkemedel. För att åstadkomma detta tillverkade de senapsgasanaloger som var mindre elektrofila genom att byta ut svavel mot kväve, vilket ledde till kvävesenapsföreningarna.[4]
Med ett godtagbart terapeutiskt index hos människor introducerades kvävesenapsföreningar på klinik 1946.[5] Alifatiska kvävesenapsföreningar utvecklades först, såsom mekloretaminhydroklorid som fortfarande används idag.
På 1950-talet började aromatiska kvävesenapsföreningar, som klorambucil, användas som mindre giftiga alkyleringsmedel än sina alifatiska motsvarigheter. De visade sig vara mindre elektrofila och reagerar långsammare med DNA. Dessutom kan de ges oralt, vilket är en viktig fördel.
Klorambucil syntetiserades första gången av Everett och kollegor 1953.[6]
Medicinsk användning
Klorambucil används för närvarande huvudsakligen vid kronisk lymfatisk leukemi, då den tolereras väl av flertalet patienter. Klorambucil har under senare tid bytts ut mot fludarabin som förstahandsval vid behandling av yngre patienter.[7] Klorambucil kan användas för behandling av några olika typer av non-Hodgkins lymfom, macroglobulinemi, polycythemia vera, trofoblastisk neoplasma och äggstockscancer. Den har även använts som ett immunosuppressivt läkemedel för olika autoimmuna och inflammatoriska tillstånd, såsom nefrotiskt syndrom.
Biverkningar
Benmärgssuppression (anemi, neutropeni, trombocytopeni) är den vanligaste biverkningen vid användning av klorambucil. Biverkningen går normalt tillbaka då man slutar med läkemedlet. Liksom många andra alkyleringsmedel, har klorambucil kopplats till utvecklingen av andra cancerformer.
Mindre vanliga biverkningar omfattar:
- Gastrointestinal distress (illamående, kräkning, diarré och sår i munhåla och svalg).
- Centrala nervsystemet: kramper, tremor, muskelryckningar, förvirring, agitation, ataxi och hallucinationer.
- Hudreaktioner
- Hepatotoxicitet
- Infertilitet
- Håravfall
Farmakologi
Verkningsmekanism
Anticancereffekten hos klorambucil beror på att DNA-replikationen störs och DNA i cellen blir förstört. Klorambucil alkylerar och tvärbinder DNA under alla faser av cellcykeln. Det finns tre mekanismer för hur DNA förstörs:[8][9]
- Alkylgrupper fäster vid DNA-baser, vilket resulterar i att DNA fragmenteras av reparationsenzymer när dessa försöker ersätta de alkylerade baserna. Detta hindrar DNA-syntes och RNA-transkription från det påverkade DNA:t.
- DNA förstörs genom tvärbindningar mellan de två strängarna i DNA så att de inte kan separeras och transkriberas.
- Felparning av nukleotiderna framkallas av klorambucil, vilket leder till mutationer.
De exakta mekanismerna för hur klorambucil dödar tumörceller är ännu inte fullständigt klarlagda.
Begränsningar i biotillgänglighet
En nyligen genomförd studie visar att klorambucil reagerar med mänskligt glutation-transferas, ett enzym som ofta återfinns i onaturligt stora mängder i cancervävnad.[10]
Klorambucil, som agerar elektrofil, görs mindre reaktiv genom att binda till glutation och därmed blir läkemedlet mindre giftigt för cellen.
Syntes
Klorambucil framställs ur acetanilid (bild 1) och bärnstenssyraanhydrid (bild 2).
I det första steget sker en Friedel-Crafts acylering katalyserad av AlCl3 och produkten är den acylerade acetamiden (bild 3). Ketogruppen (bild 3) reduceras bort med vätgas och en palladiumkatalysator (Pd-C).
Reaktionen görs i metanol och man får då metylestern (bild 4). Estern behandlas med bas för att hydrolysera både amid- och esterfunktionaliteterna i molekylen, och produkten blir 4-(4-aminofenyl)butansyra (bild 5). Reaktion med två molekvivalenter etenoxid ger produkten (bild 6), som behandlas med fosforylklorid varpå alla hydroxylgrupper byts ut mot klorid. Slutligen tillsätts vatten för att hydrolysera den intermediära syrakloriden och slutprodukten är klorambucil.[11]
Referenser
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia.
- ^ Takimoto CH, Calvo E. "Principles of Oncologic Pharmacotherapy" Arkiverad 15 maj 2009 hämtat från the Wayback Machine. in Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (Eds) Cancer Management: A Multidisciplinary Approach Arkiverad 4 oktober 2013 hämtat från the Wayback Machine.. 11 ed. 2008.
- ^ ”WHO Model List of Essential Medicines”. http://www.who.int/medicines/publications/essentialmedicines/EML_2015_FINAL_amended_NOV2015.pdf?ua=1. Läst 23 november 2016.
- ^ ”Medscape Log In”. www.medscape.com. http://www.medscape.com/viewarticle/502816_2. Läst 24 november 2016.
- ^ Gilman, A.G.; Rall, T.W.; Nies, A.S.; Taylor, P. (1990). Goodman and Gilman's The Pharmacological Basis of Therapeutics. New York: Pergamon
- ^ Anslow, W. P. (1948). ”The intravenous, subcutaneous and cutaneous toxicity of bis(-chloroethyl) sulfide (mustard gas) and of various derivatives.”. J. Pharmacol. Exp. Ther..
- ^ Everett, J.J., Roberts, J.J., Ross, W.C.J (1953). J. Chem. Soc.: sid. 2386.
- ^ ”Fludarabine compared with chlorambucil as primary therapy for chronic lymphocytic leukemia.”. N Engl J Med 343 (24): sid. 1750–7. 2000. doi:. PMID 11114313.
- ^ ”Chlorambucil”. DrugBank. http://www.drugbank.ca/drugs/DB00291. Läst 22 november 2016.
- ^ Di Antonio, Marco; McLuckie, Keith I. E.; Balasubramanian, Shankar. ”Reprogramming the Mechanism of Action of Chlorambucil by Coupling to a G-Quadruplex Ligand”. Journal of the American Chemical Society 136 (16): sid. 5860–5863. doi:. ISSN 0002-7863. http://dx.doi.org/10.1021/ja5014344. Läst 22 november 2016.
- ^ Parker, Lorien J.; Ciccone, Sarah; Italiano, Louis C.; Primavera, Alessandra; Oakley, Aaron J.; Morton, Craig J.; Hancock, Nancy C.; Bello, Mario Lo; et al. (2008-06-27). ”The anti-cancer drug chlorambucil as a substrate for the human polymorphic enzyme glutathione transferase P1-1: kinetic properties and crystallographic characterisation of allelic variants”. Journal of Molecular Biology 380 (1): sid. 131–144. doi:. ISSN 1089-8638. PMID 18511072.
- ^ Vardanyan, Ruben (2006-03-10) (på engelska). Synthesis of Essential Drugs. Elsevier. ISBN 9780080462127. https://books.google.se/books?id=Jjc7KYWZdOYC&pg=PA396&lpg=PA396&dq=synthesis+of+chlorambucil&source=bl&ots=qR7lPR4Idy&sig=b6JkU0m4ehXm83Tv3KJfVpze7q0&hl=sv&sa=X&ved=0ahUKEwj0h6HC8r7QAhXJBiwKHbGbBP44ChDoAQg5MAQ#v=onepage&q=synthesis%20of%20chlorambucil&f=false. Läst 23 november 2016




