Glykolys
| Ämnesomsättningen | |
| Denna artikel är en del i serien Ämnesomsättningen med följande delar:
| |
| Metabolism · Katabolism · Anabolism | |
| Katabolism | |
|---|---|
| Matspjälkning · Glykolys · Beta-oxidation · Trans-/Deaminering · Citronsyracykeln · Elektrontransportkedjan · Oxidativ fosforylering · Ureacykeln | |
| Anabolism | |
| Glukoneogenes · Proteinsyntes · Fettsyrasyntes | |
| Se även | |
| Fotosyntes · Cellandning · Malat-aspartatskytteln |
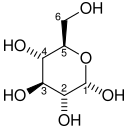
Glykolys (från glykos, äldre term för glukos, och -lysis, nedbrytning) är en metabol process där en glukosmolekyl bryts ned till två stycken pyruvatmolekyler. Den fria energin som utvinns ur reaktionerna används för att bilda högenergiföreningar i form av ATP-molekyler och NADH. De bildade ATP-molekylerna är färdiga att användas för energi, medan NADH först måste passera elektrontransportkedjan som i sin tur ger upphov till ATP.
Glykolysen består av tio väl definierade reaktioner med nio stycken intermediärer, som är väldigt lika i praktiskt taget alla celler, både prokaryota och eukaryota. Flera andra metaboliter såsom fruktos, galaktos och aminosyror[1] bildar vid nedbrytning glukos eller glykolys-intermediärer och kan på så vis gå in i glykolysen. Fruktos kan bland annat i fettvävnad ombildas till intermediären fruktos-6-fosfat och i levern till dihydroxiacetonfosfat och glyceraldehyd-3-fosfat. Till skillnad från galaktos som omvandlas till intermediären glukos-6-fosfat.
Intermediären dihydroxiacetonfosfat kan även användas för att skapa glycerol, som behövs för att skapa triacylglycerol. På samma vis kan också det omvända ske, att glycerol ombildas till dihydroxiacetonfosfat för att kunna gå vidare i glykolysen.
De två bildade pyruvatmolekylerna kan efter glykolysen reagera vidare på främst tre sätt.
Hos aeroba organismer med tillgång till syre kan pyruvat omvandlas till acetyl-koenzym-A (acetyl-CoA), som i sin tur vidareprocessas i mitokondrien för att bilda ytterligare högenergimetaboliter i citronsyracykeln och elektrontransportkedjan, eller vid överskott på energi lagras genom fettsyrasyntes.
I frånvaro av syre (anaerobt) kommer det bildade pyruvatet att reagera med NADH och istället bilda laktat i en process kallad fermentation. Hos bakterier (exempelvis hos Escherichia coli; E.coli) kommer det istället bildas etanol och koldioxid. Detta sker för att glykolysen kräver tillgång till NAD+, NADH som bildats i glykolysen kan då tillbakabilda NAD+ genom dessa reaktioner.
Glykolysen återfinns hos nästan alla organismer med vissa variationer och kan köras både aerobt och anaerobt, med sitt evolutionära ursprung före ackulumationen av substantiella mängder syre i atmosfären. Processen är mycket viktig för organismens överlevnad då dess process bildar den väldigt viktiga fosfatgruppen ATP, som används som dessa organismers "energikälla" och drivkraft för många reaktioner av vikt. Hos de röda blodkropparna är glykolysen det enda sättet att bilda energi, då de saknar mitokondrier och därigenom inte har tillgång till vare sig citronsyracykel eller elektrontransportkedja.
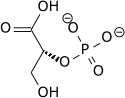
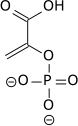
Nettoreaktionen för själva glykolysen är:
| D-Glukos | Pyruvat | ||||
|
+ 2 [NAD]+ + 2 [ADP] + 2 [P]i | 
|
2 | 
|
+ 2 [NADH] + 2 H+ + 2 [ATP] |
Reglering
Glykolysen regleras genom att aktiviteten i tre av dess ingående enzymer moduleras. De tre enzymer som regleras i glykolysen är:
- Hexokinas, som utför första irreversibla reaktionssteget.
- Hämmas av sin produkt, glukos-6-fosfat, vars koncentration byggs upp om senare steg i glykolysen avstannar.
- Fosfofruktokinas-1, som utför ett irreversibelt reaktionssteg.
- Hämmas allosteriskt av förhöjda nivåer av ATP, vilket medför att det inte är aktivt när energinivån i cellen är adekvat.
- Aktiveras av AMP, som bildas när energiförbrukningen är hög, kommer dock att ha en kraftigare aktiverande effekt än den dämpande effekt som ATP har.
- Aktiveras av fruktos-2,6-bisfosfat, som är den mest kraftfulla aktivatorn av fosfofruktokinas 1.
- Pyruvatkinas, det tredje irreversibla steget i glykolysen. Pyruvatkinas katalyserar överföringen av en fosfatgrupp från fosfoenolpyruvat till ADP, vilket ger pyruvat och ATP.
- Aktiveras av fruktos-1,6-bisfosfat, vilket är ett sällsynt exempel på så kallad "feed forward"-reglering där en produkt tidigare i reaktionsvägen aktiverar ett senare enzym (i motsats till feedback).
- I lever inaktiveras pyruvatkinas i en cAMP-beroende fosforyleringsreaktion. När detta sker kan inte fosfoenolpyruvatet omvandlas till pyruvat utan ingår istället i glukoneogenesen. Detta regleras av glukagon, som aktiverar en G-protein receptor vilket ger de förhöjda cAMP-nivåerna, som aktiverar PKA som i sin tur fosforylerar pyruvatkinaset. Detta är viktigt för att reglera processerna så att glykolys och glykoneogenes inte sker samtidigt, då dessa processer enbart hade motarbetat varandra.
Långsiktig reglering
Högt intag av kolhydrater kommer att öka gentranskriptionen och produktionen av de regulativa enzymerna som är beskrivna ovan. Detta för att kunna möta det ökade behovet av glukosmetabolism. Det motsatta ses vid långvarigt låga nivåer av insulin och höga nivåer av glukagon, som ses bland annat vid diabetes och fasta.
Detaljerade steg

De första stegen i glykolysen går ut på att tillföra energi i form av ATP till glukosmolekylen, detta kallas ofta för investeringsfasen. Under den senare delen kan energi istället utvinnas i form av ATP och NADH. När ATP skapas på detta vis kallas det för fosforylering på substratnivå, eftersom fosfatgrupper byter plats från olika molekyler.
Energiinvesteringsfas
|
Glukos → glukos-6-fosfat
|
| ||||||||||
|
Glukos-6-fosfat → fruktos-6-fosfat
|
| ||||||||||
|
Fruktos-6-fosfat → fruktos-1,6-bifosfat
|
| ||||||||||
|
Fruktos-1,6-bifosfat → dihydroxiacetonfosfat (DHAP) + glyceraldehyd-3-fosfat
|
| ||||||||||||||||
|
DHAP glyceraldehyd-3-fosfat
|
| ||||||||||
Energigenerationsfas
|
Glyceraldehyd-3-fosfat → 1,3-bisfosfoglycerat
|
| ||||||||||
|
1,3-bisfosfoglycerat → 3-fosfoglycerat
|
| ||||||||||
|
3-fosfoglycerat → 2-fosfoglycerat Förflyttning av fosfatgruppen från kolposition 3 till 2. Kofaktor: Mg+ |
| ||||||||||
|
2-fosfoglycerat → fosfoenolpyruvat (PEP) + H2O |
| ||||||||||
|
PEP → pyruvat
|
| ||||||||||
Referenser
- ^ Berg, Jeremy M. et al. (2006). ”23 - Protein Turnover and Amino Acid Catabolism”. Biochemistry (6:e upplagan). New York: W.H. Freeman and Company. sid. 656. ISBN 9780716767664. ”However, any [aminoacids] not needed as building blocks are degraded to compounds able to enter the metabolic mainstream. The amino group is first removed, and then the remaining carbon skeleton is metabolized to glucose [...].”