Fosfatidyletanolamin
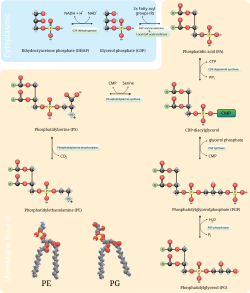
Fosfatidyletanolamin är en grupp fosfolipider, som förekommer i biologiska membran.[1] De tillverkas av cellerna genom addition av Cytidindifosfat-etanolamin och diglycerider under frigörande av cytidinmonofosfat. S-Adenosylmetionin kan metylera aminet i fosfatidyletanolaminer till fosfatidylkoliner. Fosfatidyletanolamin finns företrädesvis i det inre lagret av lipidbilagret i cellmembran.[2]
Funktion

I celler
Fosfatidyletanolaminer finns i alla levande celler och utgör 25 procent av alla fosfolipider. I mänsklig fysiologi finns de särskilt i nervvävnad som den vita substansen i hjärnan, nerverna, nervvävnaden och i ryggmärgen, där de utgör 45 procent av alla fosfolipider.[3]
Fosfatidyletanolaminer spelar en roll vid membranfusion och vid demontering av kontraktilringen under cytokines vid celldelning.[4] Dessutom är det tänkt att fosfatidyletanolamin reglerar membrankrökning. Fosfatidyletanolamin är en viktig grund, substrat eller givare i flera biologiska vägar.[3]
Som polär huvudgrupp skapar fosfatidyletanolamin ett mer visköst lipidmembran jämfört med fosfatidylkolin. Till exempel är smälttemperaturen för di-oleoylfosfatidyletanolamin -16 °C medan smälttemperaturen för di-oleoylfosfatidylkolin är -20 °C. Om lipiderna hade två palmitoylkedjor skulle fosfatidyletanolamin smälta vid 63 °C medan fosfatidylkolin skulle smälta redan vid 41 °C.[5] Lägre smälttemperaturer motsvarar, i en förenklad syn, mer flytande membran.
Hos människor
Hos människor tros metabolism av fosfatidyletanolamin vara viktigt i hjärtat. När blodflödet till hjärtat är begränsat störs den asymmetriska fördelningen av fosfatidyletanolamin mellan membranskikt, och som ett resultat störs membranet. Dessutom spelar fosfatidyletanolamin en roll i utsöndringen av lipoproteiner i levern. Detta beror på att vesiklar för utsöndring av lipoproteiner med mycket låg densitet som kommer från Golgiapparaten har en signifikant högre koncentration av fosfatidyletanolamin jämfört med andra vesiklar som innehåller lipoproteiner med mycket låg densitet.[6]Fosfatidyletanolamin har också visat sig kunna sprida infektiösaprionerutan hjälp av proteiner eller nukleinsyror, vilket är en unik egenskap hos den.[7] Fosfatidyletanolamin är också tänkt att spela en roll i blodets koagulering, eftersom det fungerar med fosfatidylserin för att öka hastigheten av trombinbildning genom att främja bindning till faktor V och faktor X, två proteiner som katalyserar bildandet av trombin från protrombin.[8] Syntesen av endocannabinoid anandamid utförs från fosfatidyletanolamin genom successiv verkan av 2 enzymer, N-acetyltransferas och fosfolipas-D.[9]
I bakterier
Där fosfatidylkolin är den huvudsakliga fosfolipiden hos djur, fosfatidyletanolamin är den viktigaste i bakterier. En av de primära rollerna för fosfatidyletanolamin i bakteriemembran är att sprida ut den negativa laddningen orsakad av anjonmembranfosfolipider. I bakterien E. coli spelar fosfatidyletanolamin en roll för att stödja laktospermeaser aktiv transport av laktos in i cellen och kan spela en roll även i andra transportsystem. Fosfatidyletanolamin spelar en roll vid montering av laktospermease och andra membranproteiner. Det fungerar som en "chaperone" för att hjälpa membranproteinerna att korrekt vika sina tertiära strukturer så att de kan fungera korrekt. När fosfatidyletanolamin inte är närvarande har transportproteinerna felaktiga tertiära strukturer och fungerar inte korrekt.[10]
Fosfatidyletanolamin gör det också möjligt för bakteriella multidrogtransportörer att fungera korrekt och möjliggör bildandet av mellanprodukter som behövs för att transportörerna ska kunna öppna och stänga ordentligt.[11]
Struktur

Som lecitin består fosfatidyletanolamin av en kombination av glycerol förestrad med två fettsyror och fosforsyra. Medan fosfatgruppen kombineras med kolin i fosfatidylkolin, kombineras den med etanolamin i fosfatidyletanolamin. De två fettsyrorna kan vara desamma eller olika och är vanligtvis i 1,2-positionerna (även om de kan vara i 1,3-positionerna).
Syntes
Fosfatidylserindekarboxyleringsvägen och cytidindifosfat-etanolaminvägarna används för att syntetisera fosfatidyletanolamin. Fosfatidylserindekarboxylas är det enzym som används för att dekarboxylera fosfatidylserin i den första vägen. Fosfatidylserindekarboxyleringsvägen är den huvudsakliga synteskällan för fosfatidyletanolamin i mitokondriernas membran. Fosfatidyletanolamin som produceras i mitokondriellt membran transporteras också genom hela cellen till andra membran för användning. I en process som speglar fosfatidylkolinsyntesen tillverkas fosfatidyletanolamin också via cytidindifosfat-etanolaminvägen, med användning av etanolamin som substrat. Genom flera steg som äger rum i både cytosol och endoplasmatisk reticulum ger syntesvägen slutprodukten av fosfatidyletanolamin.[12] Fosfatidyletanolamin finns också rikligt i soja eller ägglecitin och produceras kommersiellt med hjälp av kromatografisk separation.
Reglering
Syntes av fosfatidyletanolamin genom fosfatidylserindekarboxyleringsvägen sker snabbt i det inre mitokondriella membranet. Fosfatidylserin tillverkas emellertid i endoplasmatisk retikulum. På grund av detta begränsar transporten av fosfatidylserin från endoplasmatisk retikulum till mitokondriellt membran och sedan till det inre mitokondriella membranet synteshastigheten via denna väg. Mekanismen för denna transport är för närvarande (2022) okänd men kan spela en roll i regleringen av synteshastigheten i denna väg.[13]
Förekomst i mat, hälsoproblem
Fosfatidyletanolaminer i livsmedel bryts ner för att bilda fosfatidyletanolaminbundna Amadori-produkter som en del av Maillardreaktionen.[14] Dessa produkter påskyndar membranlipidperoxidation, vilket orsakar oxidativ stress för celler som kommer i kontakt med dem.[15] Oxidativ stress är känd för att orsaka matförsämring och flera sjukdomar. Betydande nivåer av Amadori-fosfatidyletanolaminprodukter har hittats i en mängd olika livsmedel såsom choklad, sojamjölk, modersmjölk, och andra bearbetade livsmedel. Nivåerna av Amadorifosfatidyletanolaminprodukter är högre i livsmedel med höga lipid- och sockerkoncentrationer som har höga temperaturer vid bearbetning.[14] Ytterligare studier har visat att Amadori-fosfatidyletanolamin kan spela en roll i kärlsjukdomar,[16] fungera som den mekanism genom vilken diabetes kan öka förekomsten av cancer,[17] och potentiellt spela en roll i andra sjukdomar också. Amadori-fosfatidyletanolamin har en högre plasmakoncentration hos diabetespatienter än friska människor, vilket tyder på att det kan spela en roll i utvecklingen av sjukdomen eller vara en produkt av sjukdomen. [18]
Referenser
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Phosphatidylethanolamine, 14 juli 2022.
Noter
- ^ Wellner, Niels; Diep, Thi Ai; Janfelt, Christian; Hansen, Harald Severin (2012). ”N-acylation of phosphatidylethanolamine and its biological functions in mammals”. Biochimica et Biophysica Acta. doi:. PMID 23000428. Engelska
- ^ Mishkind, Michael (2000). ”Phosphatidylethanolamine – in a pinch”. Trends in Cell Biology 10 (9): sid. 368. doi:. Engelska
- ^ [a b] Vance, Jean E.; Tasseva, Guergana (2012). ”Formation and function of phosphatidylserine and phosphatidylethanolamine in mammalian cells”. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids 1831 (3): sid. 543–54. doi:. PMID 22960354.
- ^ Emoto, K.; Kobayashi, T; Yamaji, A; Aizawa, H; Yahara, I; Inoue, K; Umeda, M (1996). ”Redistribution of phosphatidylethanolamine at the cleavage furrow of dividing cells during cytokinesis”. Proceedings of the National Academy of Sciences 93 (23): sid. 12867–72. doi:. PMID 8917511. Bibcode: 1996PNAS...9312867E.
- ^ See references in Wan et al. Biochemistry 47 2008Mall:Vs
- ^ Vance, J. E. (2008). ”Thematic Review Series: Glycerolipids. Phosphatidylserine and phosphatidylethanolamine in mammalian cells: Two metabolically related aminophospholipids”. The Journal of Lipid Research 49 (7): sid. 1377–87. doi:. PMID 18204094.
- ^ Deleault, N. R.; Piro, J. R.; Walsh, D. J.; Wang, F.; Ma, J.; Geoghegan, J. C.; Supattapone, S. (2012). ”Isolation of phosphatidylethanolamine as a solitary cofactor for prion formation in the absence of nucleic acids”. Proceedings of the National Academy of Sciences 109 (22): sid. 8546–51. doi:. PMID 22586108. Bibcode: 2012PNAS..109.8546D.
- ^ Majumder, R.; Liang, X.; Quinn-Allen, M. A.; Kane, W. H.; Lentz, B. R. (2011). ”Modulation of Prothrombinase Assembly and Activity by Phosphatidylethanolamine”. Journal of Biological Chemistry 286 (41): sid. 35535–42. doi:. PMID 21859710.
- ^ Isidro, F. (2014). ”Cannabinoids for treatment of Alzheimer's disease: moving toward the clinic”. Frontiers in Pharmacology 5: sid. 37. doi:. PMID 24634659.
- ^ Christie, W.W. (April 16, 2012). ”Phosphatidylethanolamine and Related Lipids”. Phosphatidylethanolamine and Related Lipids. The AOCS Lipid Library. http://lipidlibrary.aocs.org/lipids/pe/index.htm. Arkiverad 21 augusti 2012 hämtat från the Wayback Machine. ”Arkiverade kopian”. Arkiverad från originalet den 21 augusti 2012. https://web.archive.org/web/20120821202641/http://lipidlibrary.aocs.org/lipids/pe/index.htm. Läst 24 november 2022.
- ^ Gbaguidi, B.; Hakizimana, P.; Vandenbussche, G.; Ruysschaert, J.-M. (2007). ”Conformational changes in a bacterial multidrug transporter are phosphatidylethanolamine-dependent”. Cellular and Molecular Life Sciences 64 (12): sid. 1571–82. doi:. PMID 17530171.
- ^ Kelly, Karen (July 28, 2011). ”Phospholipid Biosynthesis”. Phospholipid Biosynthesis. The AOCS Lipid Library. http://lipidlibrary.aocs.org/animbio/phospholipids/index.htm#pe. Arkiverad 6 juli 2015 hämtat från the Wayback Machine.
- ^ Kuge, Osamu; Nishijima, Masahiro (1 April 2003). ”Biosynthetic Regulation and Intracellular Transport of phosphatidylserine in Mammalian Cells”. The Journal of Biochemistry 133 (4): sid. 397–403. doi:. PMID 12761285. https://www.jstage.jst.go.jp/article/biochemistry1922/133/4/133_4_397/_article/-char/en. Läst 30 januari 2021.
- ^ [a b] Oak, Jeong-Ho; Nakagawa, Kiyotaka; Miyazawa, Teruo (2002). ”UV analysis of Amadori-glycated phosphatidylethanolamine in foods and biological samples”. The Journal of Lipid Research 43 (3): sid. 523–9. doi:. PMID 11893788. https://www.jlr.org/action/showPdf?pii=S0022-2275%2820%2930158-9.
- ^ Oak, Jeong-Ho; Nakagawa, Kiyotaka; Miyazawa, Teruo (2000). ”Synthetically prepared Amadori-glycated phosphatidylethanolamine can trigger lipid peroxidation via free radical reactions”. FEBS Letters 481 (1): sid. 26–30. doi:. PMID 10984609.
- ^ Oak, Jeong-Ho; Nakagawa, Kiyotaka; Oikawa, Shinichi; Miyazawa, Teruo (2003). ”Amadori-glycated phosphatidylethanolamine induces angiogenic differentiations in cultured human umbilical vein endothelial cells”. FEBS Letters 555 (2): sid. 419–23. doi:. PMID 14644453.
- ^ Eitsuka, Takahiro; Nakagawa, Kiyotaka; Ono, Yuichi; Tatewaki, Naoto; Nishida, Hiroshi; Kurata, Tadao; Shoji, Naoki; Miyazawa, Teruo (2012). ”Amadori-glycated phosphatidylethanolamine up-regulates telomerase activity in PANC-1 human pancreatic carcinoma cells”. FEBS Letters 586 (16): sid. 2542–7. doi:. PMID 22750441.
- ^ Ariizumi, Ken; Koike, T; Ohara, S; Inomata, Y; Abe, Y; Iijima, K; Imatani, A; Oka, T; et al. (2008). ”Incidence of reflux esophagitis and H pylori infection in diabetic patients”. World Journal of Gastroenterology 14 (20): sid. 3212–7. doi:. PMID 18506928.
Externa länkar
 Wikimedia Commons har media som rör Fosfatidyletanolamin.
Wikimedia Commons har media som rör Fosfatidyletanolamin.- Phosphatidylethanolamine at the AOCS Lipid Library.
