Flyktighet

Inom kemin är flyktigheten materialkvalitet som beskriver hur lätt ett ämne förångas. Vid en given temperatur och ett givet tryck är det mer sannolikt att ett ämne med hög flyktighet existerar som en ånga, medan ett ämne med låg flyktighet är mer sannolikt att vara en vätska eller ett fast ämne. Flyktigheten kan också beskriva tendensen hos en ånga att kondensera till en vätska eller fast substans.[1]
Ett mycket flyktigt ämne som tvättsprit (isopropylalkohol) kommer snabbt att avdunsta, medan ett ämne med låg flyktighet som vegetabilisk olja kommer att förbli kondenserad.[2] I allmänhet är fasta ämnen mycket mindre flyktiga än vätskor, men det finns några undantag. Fasta ämnen som sublimerar (ändras direkt från fast till ånga) såsom torris (fast koldioxid) eller jod kan förångas i samma takt som vissa vätskor under standardförhållanden.[3]
Beskrivning
Flyktigheten i sig har inget definierat numeriskt värde, men den beskrivs ofta med ångtryck eller kokpunkt (för vätskor). Högt ångtryck anger en hög flyktighet, medan hög kokpunkt anger låg flyktighet. Ångtryck och kokpunkter presenteras ofta i tabeller och diagram som kan användas för att jämföra kemikalier av intresse. Flyktighetsdata bestäms vanligtvis genom experiment över ett intervall av temperaturer och tryck.
Ångtryck
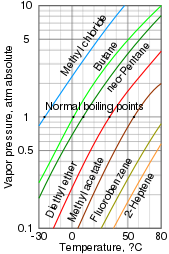
Ångtryck är ett mått på hur lätt en kondenserad fas bildar en ånga vid en given temperatur. Ett ämne som innesluts i ett slutet kärl initialt vid vakuum (ingen luft inuti) kommer snabbt att fylla alla tomma utrymmen med ånga. Efter att systemet når jämvikt och ingen mer ånga bildas kan detta ångtryck mätas. Att öka temperaturen ökar mängden ånga som bildas och därmed ångtrycket. I en blandning bidrar varje ämne till blandningens totala ångtryck, med större bidrag från mer flyktiga föreningar.
Kokpunkt
Kokpunkt är den temperatur vid vilken ångtrycket hos en vätska är lika med det omgivande trycket, vilket gör att vätskan snabbt avdunstar eller kokar. Det är nära besläktat med ångtryck, men är beroende av tryck. Den normala kokpunkten är kokpunkten vid atmosfärstryck, men den kan också rapporteras avseende högre och lägre tryck.[3]
Bidragande faktorer
Intermolekylära krafter

En viktig faktor som påverkar ett ämnes flyktighet är styrkan i interaktionerna mellan dess molekyler. Attraherande krafter mellan molekyler är det som håller ihop material, och material med starkare intermolekylära krafter, såsom de flesta fasta ämnen, är vanligtvis inte särskilt flyktiga. Etanol och dimetyleter, två kemikalier med samma formel (C2H6O), har olika flyktigheter på grund av de olika interaktioner som uppstår mellan deras molekyler i vätskefasen. Etanolmolekyler kan vätebinda medan dimetyletermolekyler inte kan det.[4] Resultatet av en övergripande starkare attraktiv kraft mellan etanolmolekylerna gör föreningen till den mindre flyktiga substansen av de två.
Molekylvikt
I allmänhet tenderar flyktigheten att minska med ökande molekylmassa eftersom större molekyler kan delta i mer intermolekylär bindning,[5] även om andra faktorer som struktur och polaritet spelar en viktig roll. Effekten av molekylmassa kan delvis isoleras genom att jämföra kemikalier med liknande struktur (dvs. estrar, alkaner etc.). Till exempel uppvisar linjära alkaner minskande flyktighet när antalet kol i kedjan ökar.
Tillämpning
Destillation
Kunskap om flyktighet är ofta användbar vid separation av komponenter från en blandning. När en blandning av kondenserade ämnen innehåller flera ämnen med olika nivåer av flyktighet kan dess temperatur och tryck manipuleras så att de mer flyktiga komponenterna ändras till en ånga medan de mindre flyktiga ämnena förblir i vätske- eller fastfasen. Den nybildade ångan kan sedan kasseras eller kondenseras i en separat behållare. När ångorna samlas upp kallas denna process destillation.[6]
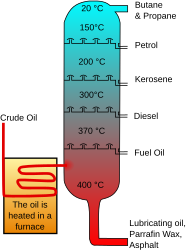
Processen för petroleumraffinering använder en teknik som kallas fraktionerad destillation, vilket gör att flera kemikalier med varierande flyktighet kan separeras i ett enda steg. Råolja som kommer in i ett raffinaderi består av många användbara kemikalier som måste separeras. Råoljan strömmar in i ett destillationstorn och värms upp, vilket gör att de mer flyktiga komponenterna som butan och fotogen kan förångas. Dessa ångor rör sig upp i tornet och kommer så småningom i kontakt med kalla ytor, vilket får dem att kondensera och samlas upp. Den mest flyktiga kemikalien kondenserar högst upp i kolonnen medan de minst flyktiga kemikalierna för att förångas kondenserar i den lägsta delen.[1] Till höger finns en bild som visar utformningen av ett destillationstorn.
Skillnaden i flyktighet mellan vatten och etanol har traditionellt använts vid destillation av alkohol. För att öka koncentrationen av etanol i produkten värmer alkoholtillverkare den ursprungliga alkoholblandningen till en temperatur där det mesta av etanolen förångas medan det mesta av vattnet förblir flytande. Etanolångan samlas sedan upp och kondenseras i en separat behållare, vilket resulterar i en mycket mer koncentrerad produkt.[7]
Parfym
Flyktighet är en viktig faktor vid tillverkning av parfymer. Människor upptäcker lukt när aromatiska ångor kommer i kontakt med receptorer i näsan. Ingredienser som förångas snabbt efter applicering kommer att producera doftande ångor under en kort tid innan oljorna avdunstar. Långsamt förångande ingredienser kan stanna kvar på huden i veckor eller till och med månader, men kanske inte producerar tillräckligt med ångor för att producera en stark arom. För att motverka dessa förhållanden överväger parfymdesigners noggrant flyktigheten hos eteriska oljor och andra ingredienser i sina parfymer. Lämpliga avdunstningshastigheter uppnås genom att balansera mängden mycket flyktiga och icke-flyktiga ingredienser som används.[8]
Se även
- Ångtryck
- Clausius–Clapeyron-ekvationen
- Destillation
- Fraktionerad destillation
- Partialtryck
- Raoults lag
- Lättflyktiga organiska föreningar
Referenser
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Volatility (chemistry), 22 mars 2022.
Noter
- ^ [a b] Felder, Richard (2015). Elementary Principles of Chemical Processes. John Wiley & Sons. Sid. 279–281. ISBN 978-1-119-17764-7.
- ^ Koretsky, Milo D. (2013). Engineering and Chemical Thermodynamics. John Wiley & Sons. Sid. 639–641.
- ^ [a b] Zumdahl, Steven S. (2007). Chemistry. Houghton Mifflin. Sid. 460-466. ISBN 978-0-618-52844-8. https://archive.org/details/chemistryseventh00zumd.
- ^ Atkins, Peter (2013). Chemical Principles. New York: W.H. Freeman and Company. Sid. 368–369. ISBN 978-1-319-07903-1.
- ^ ”Hydrocarbon boiling points”. Hydrocarbon boiling points. http://chemistry.elmhurst.edu/vchembook/501hcboilingpts.html. Arkiverad 7 februari 2023 hämtat från the Wayback Machine.
- ^ Armarego, Wilfred L. F. (2009). Purification of Laboratory Chemicals. Elsevier. Sid. 9-12. ISBN 978-1-85617-567-8. https://archive.org/details/purificationlabo00arma.
- ^ Kvaalen, Eric. ”Alcohol Distillation: Basic Principles, Equipment, Performance Relationships, and Safety”. Purdue. https://www.extension.purdue.edu/extmedia/AE/AE-117.html.
- ^ Sell, Charles (2006). The Chemistry of Fragrances. UK: The Royal Society of Chemistry. Sid. 200-202. ISBN 978-0-85404-824-3. https://archive.org/details/chemistryfragran00sell.
