Telomer (genetyka)
Telomer – fragment chromosomu, zlokalizowany na jego końcu, który zabezpiecza go przed uszkodzeniem podczas kopiowania. Telomer skraca się podczas każdego podziału komórki. Proces ten, będący „licznikiem podziałów”, równocześnie z każdym skróceniem zwiększa ryzyko nowotworzenia oraz przekłada się na proces starzenia się.
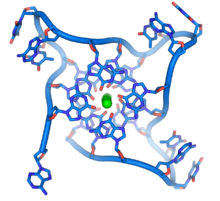
Telomer to element strukturalny chromosomu zapewniający mu stabilność. Każdy chromosom ma dwa telomery umiejscowione na jego końcach. W każdej komórce somatycznej człowieka występują więc w sumie 92 telomery. Telomer zbudowany jest z kilku tysięcy zasad nukleinowych i związanych z nimi białek. Sekwencja składająca się na telomer człowieka jest niezmienna, powtarzalna i zbudowana jest z nukleotydów: TTAGGG. Telomer nie zawiera żadnych genów i w konsekwencji nie koduje żadnych białek. U ludzi i innych kręgowców sekwencja ta jest taka sama. W miarę posuwania się w stronę geometrycznego środka chromosomu sekwencja zaczyna ulegać subtelnym zmianom – jest to tak zwany obszar subtelomerowy. Jest to obszar zawierający zarówno sekwencje niekodujące, jak i kodujące. Przykładem sekwencji kodującej jest sekwencja Y'(Y' element) u Saccharomyces cerevisiae, która koduje helikazę RNA. Sekwencje występujące w obszarze subtelomerowym mogą stopniowo coraz mniej przypominać podstawową. Zamiast powtórzeń TTAGGG mogą pojawiać się podjednostki takie jak TAGGG, TTTGGG, TTAAGG itp. Telomer i obszar subtelomerowy tworzą wspólnie tzw. końcowy fragment restrykcyjny (ang. TRF – terminal restriction fragment). W miarę posuwania w stronę środka chromosomu sekwencje stają się coraz bardziej różnorodne, aż stają się unikatowe i bardzo złożone i zaczynają kodować białka. Są to pierwsze geny, tzw. geny okołotelomerowe. Zasady nukleinowe na końcu telomeru ułożone są na kształt „koniczyny”, zawierającej dużą ilość guaniny.
Długość telomerów w komórkach zwykle skraca się z wiekiem.
Historia odkrycia telomerów
Początek
Terminu tego pierwszy, w 1939 roku, raz użył Hans Muller, na piętnaście lat przed opublikowaniem odkryć Jamesa Watsona i Francisa Cricka. Nazwa, którą nadał swemu odkryciu (stgr. τέλος telos „koniec” + μέρος meros „część”) sugeruje, że wiedział, jaką pełnią funkcję w chromosomie. Co więcej, dowiódł, że telomer zabezpiecza końce chromosomu przed niszczeniem.
Wczesne badania
W latach 40. XX wieku Barbara McClintock dowiodła, że chromosomy pozbawione telomerów zlepiają się i łączą w nieprawidłowy sposób z innymi chromosomami, co więcej nieprawidłowo rozdzielają w czasie podziału komórki.
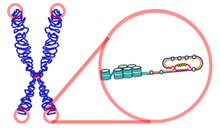
Problem replikacji końca
W 1972 James Watson wykazał, że normalny chromosom podczas duplikacji powinien ulegać skróceniu. Nazwał to problemem replikacji końca. Aby zrozumieć, dlaczego tak się dzieje, należy uświadomić sobie, że nić DNA jest kopiowana (replikacja DNA) tylko w jednym kierunku. Proces ten rozpoczyna komplet starterów, które przyczepiają się do pojedynczej nici w kilku miejscach naraz i rozpoczynają kopiowanie. Sam starter niczego nie kopiuje, ale uruchamia proces replikacji poprzez uaktywnienie polimerazy DNA. Polimeraza kopiuje nić, przesuwając się wzdłuż niej, podczas gdy startery oddzielają zreplikowane fragmenty. Przy każdej replikacji miejsce przyczepu startera najbliższego telomerowi nie może zostać skopiowane, ponieważ polimeraza nie może się cofać. W efekcie replikacji towarzyszyć powinno skracanie chromosomu, w wyniku skracania nici potomnych.
Przykład
Wyobraźmy sobie dwie jednokierunkowe nitki szosy (nici DNA), biegnące w przeciwnych kierunkach między miastem A (3') i B (5'). Maszyny asfaltujące (polimeraza) mogą pracować tylko w jednym kierunku (od miasta A do miasta B – od końca 3' do 5') i żeby rozpoczęły muszą stać na już wykonanym fragmencie asfaltu. Ponieważ maszyny mogą pracować tylko w jednym kierunku, nie mogą cofnąć się, żeby zaasfaltować fragment, na którym stała maszyna rozpoczynając pracę. W związku z tym droga, w wyniku jej asfaltowania, skraca się o mały fragment, znajdujący się na jednym z końców.
Dalsze badania
Na podstawie badań Watsona radziecki uczony Aleksiej Ołownikow wysnuł hipotezę, że długość chromosomu może się wiązać z procesem starzenia komórkowego. Jego wywód został przełożony z rosyjskiego na angielski po dwóch latach i dopiero wówczas zainteresował się tym zagadnieniem Cal Harley. Mniej więcej w tym samym czasie Elizabeth Blackburn zsekwencjonowała telomery kilku gatunków zwierząt. W 1986 Howard Cooke odkrył, że telomery komórek somatycznych są znacznie krótsze niż telomery komórek linii płciowej. W 1988 Robin Allshire ustaliła sekwencję telomeru człowieka, a Carol Greider ustaliła wiek różnych telomerów. Okazało się, że młodsze są dłuższe.
Telomery w zdrowych komórkach
Tempo skracania telomeru
W chwili zapłodnienia, telomer ma długość około 10 kpz. Do chwili narodzin skraca się do 5 kpz (osiemset powtórzeń sekwencji TTAGGG). Obszar subtelomerowy i telomerowy mają łącznie w chwili zapłodnienia 15 kpz, a w chwili narodzin dziecka 10 kpz.
Średniej wielkości chromosom zawiera 130 milionów par zasad (130 Mpz), a gen zawiera około 120 tysięcy par zasad (120 kpz). Porównanie to pokazuje, jak niewielki fragment chromosomu stanowi telomer.
Funkcje telomeru
Telomer ma cztery zasadnicze funkcje:
- ochronę końca chromosomu przed uszkodzeniem lub nieprawidłową rekombinacją
- umożliwienie całkowitej replikacji chromosomu
- nadzorowanie ekspresji genów
- wspomaganie organizacji chromosomów w trakcie podziałów komórki.
Dodatkowo, jak wynika z wcześniejszych rozważań, telomer spełnia rolę zegara komórkowego. Być może również ułatwia ustawianie się parami chromosomów homologicznych. Dwie pierwsze funkcje są niezbędne dla bezbłędnego dziedziczenia. Pozostałe umożliwiają kontrolowany dostęp do genów. W związku z problemem replikacji końca, kluczowe znaczenie ma funkcja druga. Bez systematycznego skracania telomerów redukcji musiałby ulegać obszar kodujący, a to prowadziłoby do zniszczenia i utraty genów. Trzecia funkcja – nadzorowanie ekspresji genów leżących w pobliżu końca chromosomu nie została jeszcze w pełni zbadana. Faktem jest, że skracanie telomeru wywołuje zmiany ekspresji genów.
Telomery a proces starzenia
Zegar telomerowy
Ponieważ wszystkie procesy zachodzące w komórce wymagają obecności białek, zmiana ekspresji genów powoduje zmiany ilości wytwarzanych białek. Komórki stare przestają się dzielić, bo zaczyna w nich brakować białek umożliwiających podziały, a komórki rakowe dzielą się, choć powinny przestać.
Chromosom może występować w dwóch zasadniczych postaciach: w postaci euchromatyny, gdy geny są łatwo dostępne, i heterochromatyny, gdy geny są ściśle upakowane i „schowane”. Wydaje się, że długi telomer sprzyja „maskowaniu” genów okołotelomerowych, a więc jego skracanie powoduje z czasem ich uaktywnienie. Ich działanie ujawnia się w starszych komórkach i może polegać np. na zmniejszeniu produkcji czynnika EF (ang. elongation factor), odpowiedzialnego za wydłużanie łańcucha białkowego. To może zmniejszać tempo procesów w organizmie. W efekcie zmniejszanie „okrywy” telomerowej może powodować zwiększanie ekspresji jednych genów i zmniejszanie ekspresji innych. Organizm funkcjonuje wolniej, tempo przemiany materii się zmniejsza, tkanki i narządy zaczynają się starzeć.
W zasadzie telomer stabilizuje chromosom tak długo, jak długo istnieje. Można jednak wyobrazić sobie sytuację, gdy telomer przestaje istnieć. Zmiany wówczas zachodzące w komórce są bardziej gwałtowne i spektakularne niż w przypadku opisanym wyżej. Chromosomy bez telomerów mogą zlepiać się z innymi chromosomami, ale także z białkami DDBP (ang. damaged DNA-binding proteins), których zadaniem jest wykrywanie uszkodzeń DNA, a co za tym idzie zapobieganie dziedziczeniu uszkodzonego materiału genetycznego. Gdy telomer znika i dochodzi do odsłonięcia ostatnich sekwencji TTAGGG, białka DDBP gromadzą się na uszkodzonym chromosomie, a tym samym stają się niedostępne dla reszty komórki. Inne białka, normalnie regulowane obecnością DDBP, zaczynają się uaktywniać. Są to białka regulatorowe, w tym p53, CDK2, cyklina E, p21. Zaczyna się lawina zdarzeń mających doprowadzić do zatrzymania cyklu komórkowego, dzięki czemu nie dochodzi do replikacji uszkodzonego DNA.
Na skutek powyższych zależności, większość komórek umiera z chwilą osiągnięcia wieku określanego tzw. limitem Hayflicka, jednak część komórek (mniej więcej jedna na 3 mln) zaczyna wytwarzać telomerazę – enzym przeznaczony do rekonstrukcji telomerów – i staje się komórką nowotworową. Wydłużony na nowo telomer przestaje przyłączać cząsteczki DDBP, a komórka zaczyna się dzielić. Zachowuje tę zdolność tak długo, jak długo ma telomery. Pojawiły się hipotezy, że w takim razie wystarczy komórki rakowe pozbawić telomerazy, by zatrzymać proces rakowacenia. Niestety, inne doniesienia mówią, że zaawansowane stadia niektórych nowotworów nie zawierają telomerazy.
W 2014 Holstege i in. zasugerowali, że komórki macierzyste pozyskane we wczesnym okresie życia mogą być wykorzystane w późnej starości do przywracania wydłużonych telomerów[1]. W innym badaniu, w grupie mężczyzn wykazano, że obniżanie się funkcji kognitywnych może być związane z długością telomerów[2]. Stwierdzono negatywny związek pomiędzy długością telomerów a ryzykiem zachorowania na chorobę wieńcową serca[3].
Przypisy
- ↑ Henne Holstege, Wayne Pfeiffer, Daoud Sie, et al. Somatic mutations found in the healthy blood compartment of a 115-yr-old woman demonstrate oligoclonal hematopoiesis. „Genome Research”, 23 kwietnia 2014 wydanie on-line. DOI: 10.1101/gr.162131.113.
- ↑ Rask L, Bendix L, Harbo M et al. Cognitive Change during the Life Course and Leukocyte Telomere Length in Late Middle-Aged Men. „Front Aging Neurosci.”, 2016 Dec 9. DOI: 10.3389/fnagi.2016.00300. PMID: 28018213.
- ↑ Philip C Haycock, Emma E Heydon, Stephen Kaptoge et al. Leucocyte telomere length and risk of cardiovascular disease: systematic review and meta-analysis. „BMJ”, 2014 Jul 8. DOI: 10.1136/bmj.g4227.
