Szlak sygnałowy
Szlak sygnałowy[a], ścieżka sygnałowa[b], kaskada sygnałowa[c], przekazywanie sygnału, transdukcja sygnału – szereg procesów biochemicznych zwanych sygnałami, pochodzących z zewnątrz komórki lub z jej wnętrza, prowadzących do zmian procesów życiowych w komórce[1][2].
W przekazie informacji pośredniczą pochodzące z zewnątrz komórki substancje biochemiczne takie jak neurotransmitery, cytokiny, hormony, które wiążą się receptorami zawartymi w błonie komórki lub w jej wnętrzu, co inicjuje szereg reakcji wewnątrz komórki i ostatecznie prowadzi do zmiany w jej fizjologicznym funkcjonowaniu[3].
Mechanizm działania

1. ligandy
2. receptor zagnieżdżony w błonie
3. wtórny przekaźnik
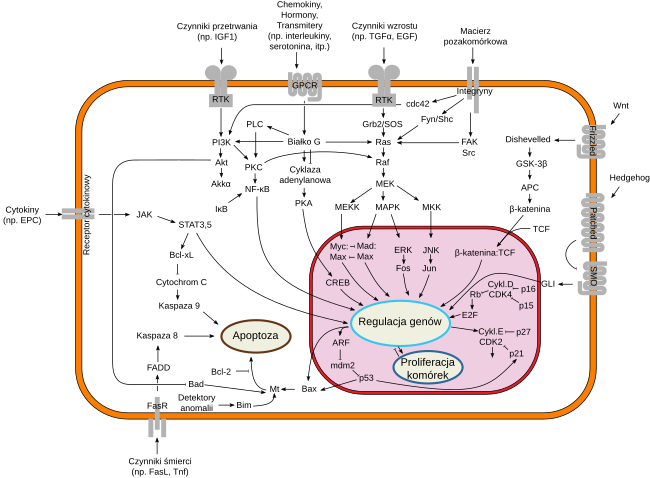
Wyzwalana kaskada sygnałowa przenosi sygnał z punktu, gdzie odebrała go komórka do mechanizmu komórkowego, który może dokonać na niego odpowiedzi. Sygnał ten przekształcany jest w formę molekularną, często ulega amplifikacji (wzmocnieniu). Może on również zostać rozprowadzony, „rozgałęziony” w taki sposób, by wpływał równolegle na kilka procesów. Każdy etap podlega modulowaniu przez warunki wewnątrz i na zewnątrz komórki[4]. Transdukcja sygnału jest ściśle regulowana i ulega wpływom różnych bodźców jednocześnie[1]. Ścieżki sygnałowe mogą na siebie wzajemnie oddziaływać i tworzyć rozległą sieć sygnalizacyjną[5]. Nieprawidłowości w pośrednictwie przekazu sygnałów mogą skutkować chorobą, dlatego działanie wielu farmaceutyków polega na przywracaniu równowagi w tych procesach[1].
Klasyczny model transdukcji sygnału polega na wysłaniu przez komórkę sygnalizującą tak zwanego ligandu, czyli przekaźnika pierwotnego (np. hormonu peptydowego, neuroprzekaźnika), który wiąże się ze specyficznym białkiem receptorowym zagnieżdżonym w błonie komórki docelowej, co wyzwala wewnątrz komórki cząsteczkę sygnałową (tzw. przekaźnik wtórny)[2]. Inicjuje to kaskadę reakcji, w której sygnał jest ostatecznie przekazywany na białko efektorowe[6]. Taki przekaz sygnału może
- modulować enzymy wewnątrzkomórkowe (kinazy, lipazy, fosfatazy)
- modulować aktywności białek G
- modulować kanały jonowe
- modulować transkrypcję genów.
Powoduje to zmiany w zachowaniu komórki[1].
Niektóre cząsteczki sygnałowe przekraczają błony komórkowe i wiążą się do wewnątrzkomórkowych receptorów w cytoplazmie lub jądrze komórkowym[7]. Wewnątrzkomórkowe receptory - to cząsteczki wiążące DNA, które mogą wzmagać lub hamować transkrypcję specyficznych genów[1].
W transdukcji sygnału mogą brać udział specjalne białka regulatorowe:
- białka adaptorowe
- białka rusztowania
- białka dokujące.
Ich zadaniem jest wiązanie i zbliżanie do siebie białek sygnałowych, dzięki czemu możliwy jest przepływ informacji. Wiąże się to z aktywacją, koordynowaniem i regulowaniem mechanizmów sygnalizacyjnych[8].
Receptory i szlaki sygnałowe
Receptory błonowe
Receptory błonowe tworzą trzy główne klasy:
- receptory jonotropowe
- receptory metabotropowe
- receptory katalityczne.
Receptory jonotropowe występują w komórkach układu nerwowego i innych komórkach pobudliwych elektrycznie (np. w komórkach mięśni).
Receptory metabotropowe i katalityczne występują niemal we wszystkich komórkach[4].
Receptory jonotropowe
Receptor jonotropowy to białkowy kanał jonowy otwierany lub zamykany za pomocą neuroprzekaźnika, gdy zwiąże się z receptorem. Do receptorów jonotropowych należą:
- nikotynowe receptory cholinergiczne (nAchR)
- receptory GABAA
- receptory dla kwasu glutaminowego (NMDA i AMPA)
- jedna z rodzin receptorów serotoninowych (5-HT3)[9]
Rolę neuroprzekaźników pełnią: acetylocholina, glicyna, glutaminian, kwas γ-aminomasłowy).
Receptory metabotropowe
Receptory metabotropowe to receptory sprzęgające się w celu przekazania sygnału z innymi cząsteczkami (tzw. wtórnymi cząsteczkami sygnałowymi). Taki przekaz sygnału jest zwykle znacznie wolniejszy i bardziej złożony niż za pośrednictwem receptorów jonotropowych i niesie dłużej utrzymujące się następstwa[10].
Najważniejszymi są receptory sprzężone z białkami G (GPCR, ang. G protein-coupled receptor); białkiem docelowym jest albo kanał jonowy albo enzym związany z błoną komórki (enzym ten pobudzony sygnałem sam wpływa na zmianę stężenia cząsteczek sygnałowych, które są wewnątrz komórki)[6].
Receptory sprzężone z białkiem G są jednołańcuchowymi białkami transbłonowymi charakteryzującymi się obecnością siedmiu hydrofobowych domen transbłonowych (stąd czasem nazywane są R7G). Receptory te stanowią największą rodzinę białek sygnałowych; są kodowane przez 3–5% genomu (u człowieka jest to ponad 800 genów)[11]. Należą do nich m.in.
Nieaktywne białko G związane jest z receptorem i występuje jako heterotrimer (cząsteczka złożona z trzech różnych białkowych podjednostek). Kiedy zewnątrzkomórkowy ligand zwiąże się z receptorem, receptor zwiąże się z białkiem G i zmusi je do odrzucenia związanego z nim GDP i zastąpienia przez GTP – w ten sposób białko G zostanie zaktywowane[4]. Powoduje to dysocjację podjednostki α od podjednostek β i γ, dzięki czemu może nastąpić ich interakcja z innymi cząsteczkami. Aktywowane podjednostki białka G odrywają się od receptora, dyfundują wzdłuż błony i przekazują sygnał za pośrednictwem takich białek efektorowych jak fosfodiesterazy, cyklazy adenylowe, fosfolipazy, kanały jonowe. Pozwala to na uwolnienie cząsteczek przekaźników wtórnych jak cykliczny AMP (cAMP), cykliczny GMP (cGMP), diacyloglicerol (DAG), kationy wapnia] (Ca2+
), trisfosforan inozytolu (IP3)[12].
Podjednostka α wykazuje jednak aktywność GTP-azy, dlatego zwykle w ciągu kilku sekund od zaktywowania białka G hydrolizuje związany z nim GTP do GDP. Wtedy podjednostka α łączy się z powrotem z kompleksem, a sygnał zostaje wyłączony[4].
Do receptorów związanych z białkiem G należą m.in.: receptory adrenergiczne, receptory dopaminowe, receptory GABAB, receptory histaminowe, receptory opioidowe, receptory muskarynowe[13].
Receptory katalityczne
Receptory katalityczne to receptory działające jak enzymy lub wiążące się z enzymami, które aktywują. Są to zwykle monotopowe białka transbłonowe (jednokrotnie perforujące błonę), które wiążą ligand po zewnętrznej stronie komórki, a centrum katalityczne lub miejsce wiązania enzymu występuje po wewnętrznej stronie. Zdecydowana większość to kinazy białkowe lub receptory łączące się z kinazami. Aktywacja ich powoduje fosforylację specyficznych białek w komórce docelowej[6].
Receptory katalityczne można podzielić na receptory o aktywności:
- kinazy serynowo-treoninowej, np. białka zaliczane do TGFβs
- kinazy tyrozynowej (ang. RTKs – Receptor Tyrosine Kinase), np. receptory czynników wzrostowych, insuliny). Wiążą się do nich białka, u których występuje domena SH2 lub SH3[14].
- fosfatazy białkowej, np. receptor antygenu CD45
- cyklazy guanylanowej, np. receptory peptydów sodopędnych, do których należy przedsionkowy peptyd natriuretyczny)[11].
Receptory wewnątrzkomórkowe
Poza receptorami błonowymi istnieją receptory wewnątrzkomórkowe. Receptory te są zlokalizowane w:
- jądrze komórkowym
- cytoplazmie.
Wśród nich wyróżnia się receptory steroidowe. Typowe ligandy dla receptorów jądrowych są hormonami lipofilowymi, np.
- pochodne witaminy A i D
- hormony steroidowe (m.in. testosteron, progesteron, kortyzol)
- hormony tarczycy.
Hormony te przenikają przez błonę komórkową, zwykle w procesie dyfuzji. Receptor jądrowy stanowi aktywator transkrypcji aktywowany odpowiednim ligandem (hormonem). Taki kompleks łączy się ze specyficzną sekwencją DNA – HRE (ang. hormone response element) w rejonie promotorowym, co umożliwia transkrypcję genów. Sygnalizacja tego typu jest znacznie powolniejsza od innych metod sygnalizacji, ale jest zwykle długotrwała[12].
Inne szlaki sygnałowe
Do innych mechanizmów odbioru sygnału należą między innymi:
kinazy janusowe
Receptory asocjujące z kinazami janusowymi, jedną z rodzin niereceptorowych kinaz tyrozynowych (w odróżnieniu od receptorów o aktywności kinazy tyrozynowej są cytoplazmatycznymi enzymami). Kinazy janusowe fosforylują białka STAT, a te mogą służyć jako czynniki transkrypcyjne[14]. Receptory asocjujące z tymi niereceptorowymi kinazami określane są zwykle jako receptory typowe dla cytokin[11].
receptory toll-podobne
Receptory toll-podobne (TLR) – aktywowane receptory toll-podobne przekazują sygnały z wykorzystaniem białek adaptorowych (MyD88, Tirap, Trif, Tram), które aktywują pewne kinazy białkowe (IRAK1, IRAK4, TBK1, IKKi) amplifikujące sygnał. Ostatecznie prowadzi to do aktywacji lub supresji genów związanych z odpowiedzią zapalną[12].
receptory integrynowe

Receptory integrynowe należące do grupy receptorów adhezyjnych (należą tu również kadheryny, selektyny) to białka transbłonowe komórek zwierzęcych, które odpowiadają przede wszystkim za adhezję do podłoża, agregację komórek i ukierunkowaną migrację (np. podczas embriogenezy, hemostazy, odpowiedzi immunologicznej) oraz interakcję komórka-komórka. Składają się z podjednostek α i β. Przekazują sygnały ze składników macierzy pozakomórkowej takich jak kolageny, fibronektyny, lamininy[11]. W przekazie sygnału do wewnątrzkomórkowych białek pośredniczy cytoplazmatyczna kinaza tyrozynowa nazywana FAK (ang. focal adhesion kinase – kinaza ogniskowo-adhezyjna) oraz kinaza Src[12]. W większości komórek integryny współdziałają z receptorami GPCR lub receptorami o aktywności kinazy tyrozynowej[11]. Integryny na powierzchni komórek krążących w krwi są w normalnych warunkach utrzymywane w formie nieaktywnej, aby zapobiec przyleganiu do komórek nabłonkowych, jednak np. integryny leukocytów pod wpływem bodźców otrzymanych z miejsca odpowiedzi zapalnej uaktywniają się[12].
receptory notch
Receptory notch biorą udział w kontroli proliferacji i różnicowania komórek, regulacji funkcji komórek krwiotwórczych[15]. Większość ich ligandów to białka przezbłonowe, dlatego aktywowane są dopiero przez kontakt z ligandem (Jagged lub Delta) na sąsiedniej komórce. Po związaniu liganda receptor ulega obróbce proteolitycznej, w wyniku której odłącza się od niego domena NICD (ang. notch intracellular domain) i wędruje do jądra komórkowego, gdzie pełni rolę czynnika transkrypcyjnego[14].
małe białka G
W niektórych szlakach sygnałowych mogą uczestniczyć tak zwane małe białka G (małe GTP-azy). Są to jednopolipeptydowe, monomeryczne białka (w odróżnieniu od trimerowych białek G) działające jako przełączniki molekularne – przełączają się one cyklicznie między aktywnym stanem konformacyjnym (gdy związane są z GTP) a nieaktywnym (gdy związane z GDP), podobnie jak w przypadku podjednostki α białka G. Przykładem małych białek G jest białko Ras. Nie jest ono bezpośrednio połączone z receptorem (receptorową kinazą tyrozynową), ale pośredniczą w tym białka adaptorowe (Shc, Grb2) oraz białko działające jako aktywator białka Ras (Sos)[3][4][14].
Aktywne białko Ras aktywuje serynowo-treoninową kinazę Raf, a ta dalej kaskadę kinaz MAP przenoszących sygnał z błony komórkowej do jądra. Nadaktywacja białka Ras związana z mutacjami pobudzającymi proliferację komórek występuje w wielu rodzajach nowotworów[4][14].
Przekaźniki wtórne
Pozakomórkowe cząsteczki sygnałowe określane są jako przekaźniki pierwotne. Wewnątrzkomórkowe, niewielkie organiczne cząsteczki lub nieorganiczne jony wyzwalane w dużych ilościach w odpowiedzi na aktywację receptora nazywane są przekaźnikami wtórnymi lub wtórnymi cząsteczkami informacyjnymi (ang. second messengers)[6]. Przekazują one sygnał do wnętrza komórki[12]. Niektóre są rozpuszczalne w wodzie (np. cAMP, Ca2+
) i rozprzestrzeniają się w cytoplazmie, inne zaś są rozpuszczalne w tłuszczach i rozprzestrzeniają się w obrębie błony komórkowej (np. diacyloglicerol)[6].
Tlenek azotu
Tlenek azotu (NO) reguluje procesy komórkowe w niemal każdej komórce organizmu wielokomórkowego. Rodnik ten potrafi przechodzić przez błony komórkowe i wpływać na pobliskie komórki. Jego główne działanie to odwracalne kowalencyjne modyfikacje białek przez mechanizm redoks oraz wyzwalanie innych wtórnych przekaźników. Jego czas półtrwania wynosi jedynie cztery minuty. Tworzony jest z argininy przy udziale syntazy tlenku azotu[12].
Najczęstszym celem NO w komórce docelowej jest cyklaza guanylanowa, którą aktywuje, przez co zwiększa poziom cGMP. Powoduje to rozkurcz komórek mięśni gładkich w ścianie naczyń krwionośnych, poszerza się światło naczyń, co ułatwia przepływ krwi. Mechanizm ten odpowiada za działanie nitrogliceryny (która w ciele przekształca się w NO), jak również w podobny sposób powstaje erekcja[4].
cAMP
Wiele hormonów wywołuje odpowiedź komórkową za pośrednictwem cAMP jako przekaźnika wtórnego (m.in. hormon antydiuretyczny, glukagon, kalcytonina), co zwiększa możliwości interakcji między szlakami sygnałowymi (tzw. cross-talk)[12].
cAMP aktywuje kinazę białkową, zwykle białkową kinazę A (PKA). Aktywacja ta umożliwia przeniesienie reszty fosforanowej z ATP w domenie katalitycznej na docelowe białko. Pod wpływem tej odwracalnej fosforylacji białko to zmienia aktywność lub funkcję[12].
cGMP
Bardzo podobną do cAMP cząsteczką sygnałową jest cGMP. Jej syntezę katalizuje cyklaza guanylowa (GC). Związana z błoną cyklaza guanylowa aktywowana jest przez hormony peptydowe, a rozpuszczalna cyklaza guanylowa jest zwykle aktywowana tlenkiem azotu. cGMP reguluje otwarcie kanałów jonowych, glikogenolizę i apoptozę; powoduje rozkurcz mięśni gładkich. Jeśli działa na mięśnie gładkie naczyń krwionośnych, powoduje zwiększony przepływ krwi[12].
cGMP funkcjonuje również jako przekaźnik wtórny w przekazie sygnału w oku. Brak światła w fotoreceptorach (czopkach i pręcikach) w oku powoduje aktywację fotodiesterazy, która katalizuje powstawanie cGMP z GMP. cGMP otwiera kanały sodowe, błona fotoreceptorów się depolaryzuje, a wtedy otwierają się kanały jonowe i uwalniane są cząsteczki neurotransmitera[12].
Trifosforan inozytolu (IP3) i diacyloglicerol (DAG)

Wiele receptorów związanych z białkiem G jest powiązanych z wewnątrzkomórkową fosfolipazą C (PLC). Katalizuje ona hydrolizę fosfatydyloinozytolo-4,5-bisfosforanu (PIP2), co skutkuje powstaniem 1,4,5-trifosforanu inozytolu (IP3) i diacyloglicerolu (DAG). Te dwa wtórne przekaźniki regulują aktywność kinazy białkowej C i wewnątrzkomórkowe stężenie Ca2+
[12].
IP3 stanowi wtórny przekaźnik dla wielu czynników wzrostu, hormonów, neurotransmitterów. Wiąże się z receptorami IP3 na siateczce śródplazmatycznej i błonie jądrowej. Powoduje to uwolnienie do cytozolu nagromadzonych jonów wapnia. Sygnał ustępuje przez defosforylację IP3 lub przekształcenie do innych pochodnych[12].
DAG znajduje się w wewnętrznej warstwie błony komórkowej i aktywuje zależną od wapnia białkową kinazę C. Ta z kolei fosforyluje wiele innych białek i doprowadza do ich aktywacji. Sygnał ustępuje przez przekształcenie DAG do kwasu arachidonowego lub glicerolu i kwasów tłuszczowych[12].
Jony wapnia
Jony wapnia są powszechnymi przekaźnikami wewnątrzkomórkowymi. Pod wpływem wielu sygnałów drastyczne zwiększenie stężenia Ca2+
w cytozolu (które normalnie jest bardzo niskie, ok. 100 nM) może doprowadzić do m.in. sekrecji, ekspresji genu, apoptozy, skurczu[12]. Największy wzrost stężenia Ca2+
następuje przy zapłodnieniu oraz przy ustaniu naturalnych procesów regulacyjnych (np. przy niedotlenieniu), co w tym przypadku powoduje jej destrukcję i śmierć. W normalnych warunkach nadmiar wapnia usuwany jest przez Ca2+
-ATPazę (pompę wapniową)[14].
Jony wapnia są zwykle gromadzone w siateczce śródplazmatycznej, gdzie są związane z kalretikuliną. W kontrolowanym uwolnieniu tych jonów do cytozolu pośredniczą dwa kanały jonowe, będące jednocześnie receptorami: receptor IP3 (aktywacja przez IP3 po stronie cytoplazmatycznej) oraz receptor rianodynowy (rozpoznaje Ca2+
po stronie cytoplazmatycznej). Białka, które podlegają regulacji przez jony Ca2+
mogą je bezpośrednio rozpoznawać lub też jony te mogą na nie wpływać za pośrednictwem kalmoduliny. Taka ścieżka sygnałowa odgrywa ważną rolę w proliferacji, mitozie i przekazie sygnałów nerwowych[12]. Szczególnie ważnymi białkami docelowymi dla uaktywnionej kalmoduliny są kinazy CaM[4].
Znaczenie w farmakoterapii
Poznanie w XX w. sieci sygnalizacji wewnątrzkomórkowej umożliwiło opracowanie nowych strategii farmakoterapii. Mechanizm działania wielu leków polega na ingerowaniu w odbiór sygnałów za pośrednictwem receptorów błonowych lub na modulowaniu aktywności enzymów, które syntetyzują biologicznie czynne cząsteczki. Leki mogą więc bezpośrednio blokować lub pobudzać receptor (np. w alergiach stosowane są leki blokujące receptor histaminowy H1, co znosi objawy wywołane histaminą) lub pośrednio modulować sygnał odbierany przez receptor (np. przedłużenie działania neurotransmiterów monoaminowych na receptory przez inhibitory wychwytu zwrotnego)[14].
Sygnalizacja u roślin
Komórki roślin i zwierząt należą do eukariotów, ale na skutek ewolucji wyodrębniły się i ewoluują oddzielnie od ponad miliarda lat. Świadczy o tym fakt, że niektóre używane w komunikacji cząsteczki (np. tlenek azotu, cGMP, Ca2+
) i mechanizmy z nimi związane są podobne u roślin i u zwierząt. Inne zaś cząsteczki używane w komunikacji u zwierząt nie występują u roślin (białko Ras, JAK, STAT, Notch).
Większość receptorów powierzchniowych komórek roślinnych to receptory katalityczne. Najczęściej występujący u zwierząt receptor katalityczny o aktywności kinazy tyrozynowej (RTK) jest jednak u roślin bardzo rzadki. Rośliny najczęściej używają receptorów o aktywności kinazy serynowo-treoninowej.
Rozwój rośliny koordynują regulatory wzrostu i rozwoju, tzw. hormony roślinne, m.in. etylen, auksyny, cytokininy, gibereliny i kwas abscysynowy. Są to związki małocząsteczkowe, mogą działać lokalnie lub przemieszczać się w roślinie i wpływać jednocześnie na wiele procesów. Ich działanie zależy od warunków środowiska, stanu odżywienia rośliny, stanu komórek docelowych i obecności innych regulatorów[16].
Zobacz też
Uwagi
Przypisy
- ↑ a b c d e Bertics P. J., Koziol-White C. J., Gavala M. L., Wiepz G. J: Signal Transduction. W: Adkinson N. F: Middleton's Allergy. Elsevier Saunders, 2014, s. 184–202. DOI: 10.1016/B978-0-323-08593-9.00012-7. ISBN 978-0-323-08593-9.
- ↑ a b Kamat A., Gregerman R. I., Katz M. S. Cellular Signal Transduction. „Encyclopedia of Gerontology”, s. 261–269, 2007. DOI: 10.1016/B0-12-370870-2/00034-2.
- ↑ a b Hofer A. M: Signal Transduction and Second Messengers. W: Sperelakis N: Cell Physiology Source Book. Elsevier Inc., 2011, s. 85–98. DOI: 10.1016/B978-0-12-387738-3.00006-8. ISBN 978-0-12-387738-3.
- ↑ a b c d e f g h Alberts B., Bray D., Johnson A., Lewis J., Raff M., Roberts K., Walter P: Podstawy Biologii Komórki. Wprowadzenie do Biologii Molekularnej. Warszawa: Wydawnictwo Naukowe PWN, 1999, s. 488–514.
- ↑ Papin J. A., Hunter T., Palsson B. O., Subramaniam S. Reconstruction of cellular signalling networks and analysis of their properties. „Nature Reviews Molecular Cell Biology”. 6 (2), s. 99–111, 2005. DOI: 10.1038/nrm1570.
- ↑ a b c d e Alberts i in. 2015 ↓, s. 814–819.
- ↑ Signaling Molecules and Their Receptors. W: Cooper G. M: The Cell: A Molecular Approach. Sunderland: Sinauer Associates, 2000. ISBN 978-0-87893-106-4.
- ↑ Buday L., Tompa P. Functional classification of scaffold proteins and related molecules. „The FEBS Journal”. 277 (21), s. 4348–4355, 2010. DOI: 10.1111/j.1742-4658.2010.07864.x.
- ↑ Oliver Stiedl i inni, The role of the serotonin receptor subtypes 5-HT1A and 5-HT7 and its interaction in emotional learning and memory, „Frontiers in Pharmacology”, 6 (162), 2015, s. 1–17, DOI: 10.3389/fphar.2015.00162.
- ↑ Alberts i in. 2015 ↓, s. 629–630.
- ↑ a b c d e Klein A: Molekularne Mechanizmy Regulacji Hormonalnej. Kraków: Wydawnictwo Uniwersytetu Jagiellońskiego, 2010, s. 42–65. ISBN 978-83-233-2959-6.
- ↑ a b c d e f g h i j k l m n o p q Dubey R. C: Advanced Biotechnology. New Delhi: S. Chand & Company Pvt. Ltd., 2014, s. 59–69. ISBN 81-219-4290-X.
- ↑ Mutschler E., Geisslinger G., Kroemer H. K., Ruth P., Schafer-Korting M: Farmakologia i toksykologia. Wrocław: MedPharm Polska, 2010, s. 71. ISBN 978-83-60466-81-0.
- ↑ a b c d e f g Barańska J., Nalepa I: Przekazywanie sygnałów w komórce. 2010. [dostęp 2017-04-28]. [zarchiwizowane z [1.Rozdzial%2006.pdf tego adresu] (2016-03-27)]. (pol.).
- ↑ Roszek K. Komoszyński M. Kontrola i kierunki różnicowania komórek macierzystych krwi pępowinowej oraz ich zastosowanie terapeutyczne. „Postępy Higieny i Medycyny Doświadczalnej”. 62, s. 660–667, 2008.
- ↑ Alberts i in. 2015 ↓, s. 880–881.
Bibliografia
- B. Alberts, A. Johnson, J. Lewis, D. Morgan, M. Raff, K. Roberts, K. Walter: Molecular Biology of the Cell. New York: Garland Science, 2015. ISBN 978-0-8153-4432-2.
