Rybosom

Rybosom – kompleks białek z kwasami nukleinowymi służący do produkcji białek w procesie translacji. Rybosomy zbudowane są z rRNA i białek. Katalityczna aktywność rybosomu związana jest właśnie z zawartym w nim rRNA, natomiast białka budują strukturę rybosomu i działają jako kofaktory zwiększające wydajność translacji[1].
Rybosomy występują u wszystkich organizmów żywych, zarówno u prokariotów (bakterie, archeony), jak i eukariotów (pierwotniaki, grzyby, rośliny, zwierzęta), a także we wnętrzu organelli – plastydów i mitochondriów[1].
Rybosomy prokariotów i organelli półautonomicznych są mniejsze i wrażliwsze na inne toksyny niż ich eukariotyczne odpowiedniki. Te różnice są wykorzystywane przez niektóre antybiotyki.
Rybosomy są bardzo małe i widoczne tylko pod mikroskopem elektronowym. Pojedynczy rybosom składa się z 2 podjednostek, dużej i małej[1].
Zespół rybosomów połączonych nicią matrycową (mRNA) stanowi polirybosom zwany inaczej polisomem[2].
Budowa rybosomów

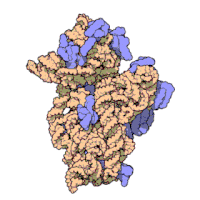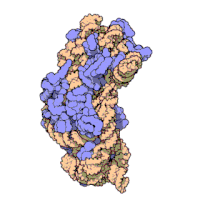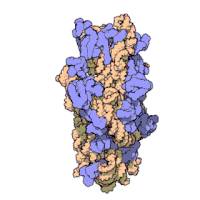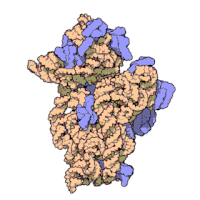
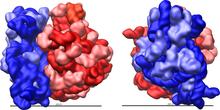
Każdy rybosom zbudowany jest z dwóch dopasowanych do siebie podjednostek: małej i dużej. Obie podjednostki są zbudowane z białek i rRNA (rybosomowy RNA). Podjednostki rybosomu są ze sobą połączone tylko podczas translacji – po zakończeniu translacji danego łańcucha białkowego podjednostki rozdzielają się, a podczas inicjalizacji translacji jakieś blisko siebie znajdujące się podjednostki (jedna duża i jedna mała) łączą się ze sobą, odtwarzając rybosom.
Podczas translacji w rybosomie możemy wyróżnić miejsce aminoacylowe (miejsce A) oraz miejsce peptydowe (miejsce P) w których cząsteczki tRNA przyłączają się do mRNA. Wyróżniane jest także miejsce wyjścia (miejsce E) którym tRNA bez aminokwasów opuszczają rybosom[2].
Prokarioty
U prokariotów występują rybosomy 70S[5]. Masa rybosomu u Escherichia coli wynosi około 2700 kDa a średnica około 20 nm. W pojedynczej komórce prokariotycznej znajduje się około 20 tys. rybosomów, które stanowią około jednej czwartej jej masy. Duża podjednostka (50S) zawiera 34 białka (oznaczanych od L1 do L34) i dwie cząsteczki rRNA (5S rRNA i 23S rRNA), a mała podjednostka (30S) zawiera 21 białek (oznaczanych od S1 do S21) i jedną cząsteczkę rRNA (16S rRNA). W podjednostce dużej występują po dwa białka L7 i L12, pozostałe występują pojedynczo. Identyczne z białkiem L26 jest białko S20[1].
Eukarionty
U eukariontów występują rybosomy 80S oraz mniejsze rybosomy mitochondrialne i chloroplastowe przypominające rybosomy bakteryjne. Rybosomy 80S są o 40% większe od rybosomów prokariotycznych zbudowane z dużej (60S) podjednostki i małej (40S) podjednostki[6]. U Tetrahymena thermophila duża podjednostka składa się z trzech łańcuchów rRNA (5S – 120 nukleotydów, 5,8S – 154 nukleotydów i 28S rRNA – 3354 nukleotydów) oraz 47 białek[7]. Mała podjednostka (40S) składa się z jednego łańcucha RNA (18S rRNA) złożonego z 1753 nukleotydów oraz 32 białek[8]. U Saccharomyces cerevisiae łańcuchy RNA dużej podjednostki mają długość 5S – 121 nukleotydów, 5,8S – 158 nukleotydów, a 25S – 3396 nukleotydów. Łańcuch małej podjednostki ma długość 18S-1800 nukleotydów[9]. Liczba białek wchodzących w skład rybosomów różni się u grup poszczególnych organizmów i łącznie może wynosić 80-90. Tylko około jednej trzeciej z nich ma swoje odpowiedniki w rybosomach bakterii i archeanów[10].
Rybosomy chloroplastowe i mitochondrialne również składają się z dużej i małej podjednostki. Przypominają rybosomy bakteryjne, co wspiera teorię endosymbiotyczną opisującą pochodzenie mitochondriów i chloroplastów. W komórkach roślin rybosomy chloroplastowe 70S składają się z podjednostki małej 30S zawierającej jeden łańcuch rRNA (16S-rRNA) oraz około 24 białek i podjednostki dużej 50S zawierającej trzy łańcuchy 4,5S-rRNA, 5S-rRNA i 23S-rRNA oraz około 35 białek. Rybosomy mitochondrialne 78S są odmienne. Podjednostka mała zawiera łańcuch 18S-rRNA oraz około 33 białek, a podjednostka duża dwa łańcuchy: 5S-rRNA i 26S-rRNA oraz około 35 białek[2]. Rybosomy mitochondriów ssaków (a więc także człowieka) są zbudowane inaczej i mają stałą sedymentacji 55S. Składają się z podjednostek 39S i 28S[11][12].

Synteza
Synteza podjednostek rybosomów zachodzi w jąderku na podstawie rRNA. W jąderku 45S pre-rRNA jest syntetyzowany i dojrzewa. Uczestniczą w tym ciałka Cajala[13].
Lokalizacja rybosomów
U eukariontów można wyróżnić dwie lokalizacje rybosomów:
- rybosomy wolne – swobodnie pływające w cytoplazmie, służą one do syntezy białek nieeksportowanych poza komórkę, takich jak enzymy wewnątrzkomórkowe, białkowe elementy błon komórkowych, białka wędrujące do jądra, białka cytoplazmy czy białka cytoszkieletu. Do tej klasy można zaliczyć także rybosomy w organellach: mitochondrium lub chloroplaście;
- rybosomy związane z błoną – lub przyczepione do retikulum endoplazmatycznego (szorstkiej siateczki śródplazmatycznej), w których następuje synteza białek eksportowanych transportowanych przez siateczkę śródplazmatyczną także poza błony komórki – hormony białkowe, kolagen, białka wydzielnicze, enzymy lizosomalne, białka wchodzące w skład błon, nici elastynowe dla tkanki łącznej).
O tym, czy rybosom będzie wolny, czy też związany z błoną, decyduje sekwencja sygnałowa w syntetyzowanym przez niego białku.
Historia badań
Rybosomy odkrył używając mikroskopu elektronowego George Emil Palade w latach 50. XX wieku[14]. Za swoje odkrycie Palade wraz z dwoma innymi badaczami struktur komórkowych otrzymał Nagrodę Nobla w dziedzinie fizjologii lub medycyny w roku 1974[15]. Sama nazwa rybosom została zaproponowana przez Richarda B. Robertsa w roku 1958 we wstępie do książki Microsomal Particles and Protein Synthesis[16]. W roku 2000 zostały opublikowane wyniki badań opisujące strukturę podjednostki dużej 50S organizmów prokariotycznych: Haloarcula marismortui należącego do archeanów[3] oraz Deinococcus radiodurans należnego do bakterii[17], a także podjednostki małej 30S Thermus thermophilus[4]. Rok później opublikowano opis struktury kompletnego rybosomu 70S Thermus thermophilus w rozdzielczości 5,5 Å[18]. Za badania nad budową i funkcją rybosomów Venkatraman Ramakrishnan, Thomas A. Steitz i Ada E. Jonath otrzymali wspólnie Nagrodę Nobla w dziedzinie chemii w roku 2009[19].
Ewolucja
Początkowo sądzono, że za syntezę białek odpowiadają białka obecne w składzie rybosomu. Odkrycie rybozymów doprowadziło do zmiany poglądów. Funkcję katalityczną pełni przede wszystkim rRNA. Białka współtworzące strukturę pełnią funkcje pomocnicze. Wskazuje to na pierwotną budowę rybosomów jako struktur złożonych jedynie z RNA potwierdzając możliwość istnienia życia bez białek, hipotezę świata RNA. Białka pojawiły się w rybosomach w kolejnych etapach ewolucji, udoskonalając już istniejące struktury[1].
Zobacz też
Przypisy
- ↑ a b c d e Jeremy Mark Berg, John L Tymoczko, Lubert Stryer, Neil D Clarke: Biochemia. Warszawa: Wydawnictwo Naukowe PWN, 2007, s. 823–839. ISBN 978-83-01-14379-4.
- ↑ a b c Heldt Hans-Walter: Plant biochemistry. Amsterdam ; Boston: Elsevier Academic Press, 2005, s. 532–539. ISBN 012088391033.
- ↑ a b N. Ban, P. Nissen, J. Hansen, P.B. Moore i inni. The complete atomic structure of the large ribosomal subunit at 2.4 A resolution. „Science”. 289 (5481), s. 905–920, Aug 2000. PMID: 10937989.
- ↑ a b B.T. Wimberly, D.E. Brodersen, W.M. Clemons, R.J. Morgan-Warren i inni. Structure of the 30S ribosomal subunit. „Nature”. 407 (6802), s. 327–339, Sep 2000. DOI: 10.1038/35030006. PMID: 11014182.
- ↑ Robert Kincaid Murray, Daryl K. Granner, Victor W. Rodwell, Biochemia Harpera ilustrowana, wyd. VI uaktualnione, Warszawa: Wydawnictwo Lekarskie PZWL, 2008, s. 455, ISBN 978-83-200-3573-5.
- ↑ A. Ben-Shem, L. Jenner, G. Yusupova, M. Yusupov. Crystal structure of the eukaryotic ribosome. „Science”. 330 (6008), s. 1203–1209, Nov 2010. DOI: 10.1126/science.1194294. PMID: 21109664.
- ↑ S. Klinge, F. Voigts-Hoffmann, M. Leibundgut, S. Arpagaus i inni. Crystal structure of the eukaryotic 60S ribosomal subunit in complex with initiation factor 6. „Science”. 334 (6058), s. 941–948, Nov 2011. DOI: 10.1126/science.1211204. PMID: 22052974.
- ↑ J. Rabl, M. Leibundgut, S.F. Ataide, A. Haag i inni. Crystal structure of the eukaryotic 40S ribosomal subunit in complex with initiation factor 1. „Science”. 331 (6018), s. 730–736, Feb 2011. DOI: 10.1126/science.1198308. PMID: 21205638.
- ↑ A. Ben-Shem, N. Garreau de Loubresse, S. Melnikov, L. Jenner i inni. The structure of the eukaryotic ribosome at 3.0 Å resolution. „Science”. 334 (6062), s. 1524–1529, Dec 2011. DOI: 10.1126/science.1212642. PMID: 22096102.
- ↑ V. Ramakrishnan. Molecular biology. The eukaryotic ribosome.. „Science”. 331 (6018), s. 681–682, Feb 2011. DOI: 10.1126/science.1202093. PMID: 21310988.
- ↑ T.W. O’Brien, The general occurrence of 55S ribosomes inmammalian liver mitochondria. J. Biol. Chem. 245, 3409 – 3417., 1971.
- ↑ Thomas W. O'Brien, Properties of Human Mitochondrial Ribosomes, „IUBMB Life”, 55 (9), 2003, s. 505–513, DOI: 10.1080/15216540310001626610, ISSN 1521-6551 [dostęp 2019-07-11] (ang.).
- ↑ Wojtaszek, Woźny i Ratajczak 2006 ↓, s. 47–48.
- ↑ G.E. Palade. A small particulate component of the cytoplasm. „J Biophys Biochem Cytol”. 1 (1), s. 59–68, Jan 1955. PMID: 14381428.
- ↑ The Nobel Prize in Physiology or Medicine 1974. [dostęp 2014-04-06].
- ↑ Microsomal Particles and Protein Synthesis. Richard B. Roberts (red.). New York: Pergamon Press, Inc, 1958, s. VII-VIII.
- ↑ F. Schluenzen, A. Tocilj, R. Zarivach, J. Harms i inni. Structure of functionally activated small ribosomal subunit at 3.3 angstroms resolution. „Cell”. 102 (5), s. 615–623, Sep 2000. PMID: 11007480.
- ↑ M.M. Yusupov, G.Z. Yusupova, A. Baucom, K. Lieberman i inni. Crystal structure of the ribosome at 5.5 A resolution. „Science”. 292 (5518), s. 883–896, May 2001. DOI: 10.1126/science.1060089. PMID: 11283358.
- ↑ The Nobel Prize in Chemistry 2009. [dostęp 2014-04-06].
Bibliografia
- Przemysław Wojtaszek, Adam Woźny, Lech Ratajczak: Biologia komórki roślinnej. Tom 1. Struktura. Warszawa: Wydawnictwo Naukowe PWN, 2006. ISBN 978-83-01-14838-6.
