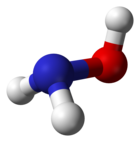
Hydroksyloamina
| |||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
H3NO | ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
NH2OH | ||||||||||||||||||||||||||||||||||||||||||||
| Masa molowa |
33,03 g/mol | ||||||||||||||||||||||||||||||||||||||||||||
| Wygląd |
białe płatki lub igły[2] | ||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||
Hydroksyloamina – nieorganiczny związek chemiczny, pochodna amoniaku, w której jeden atom wodoru został zastąpiony grupą hydroksylową. Najprostsza hydroksyamina.
Jest to bezbarwne higroskopijne, krystaliczne ciało stałe o temperaturze topnienia wynoszącej 33,1 °C. Jest silnie trująca, podczas ogrzewania rozkłada się z wydzieleniem ciepła.
Dobrze rozpuszcza się w wodzie i metanolu. Dobra substancja redukująca, czasem może jednak być utleniaczem. Słabo zasadowa, tworzy sole, z których najważniejsze to chlorowodorek hydroksyloaminy i siarczan hydroksyloaminy. Sole te są trwalsze niż wolna hydroksyloamina, ale również trujące.
Otrzymywana przez redukcję kwasu azotowego lub tlenków azotu (z wyjątkiem N
2O) w roztworze kwaśnym albo przez działanie zasadą na chlorowodorek lub siarczan hydroksyloaminy i oddestylowanie zmniejszonym ciśnieniem wydzielającej się hydroksyloaminy.
Stosowana jako środek redukujący i odczynnik w syntezie organicznej, np. do otrzymywania oksymów[6]:
- R
2C=O + NH
2OH → R
2C=NOH + H
2O
Działanie hydroksyloaminy na organizm człowieka jest bardzo negatywne. Ma właściwości mutagenne. Reaguje z cytozyną w DNA, zamieniając ją na związek zbliżony do uracylu, działa też na enzymy komórkowe. W wyniku jej działania powstają często groźne mutacje punktowe[7][niewiarygodne źródło?].
Przypisy
- ↑ a b c Neil G. Connelly i inni, Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005 (Red Book), International Union of Pure and Applied Chemistry, RSC Publishing, 2005, s. 309, ISBN 978-0-85404-438-2 (ang.).
- ↑ a b c d e f g h CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 4-65, 5-87, 9-63, ISBN 978-1-4987-5429-3 (ang.).
- ↑ a b hydroksyloamina ...%, [w:] Classification and Labelling Inventory, Europejska Agencja Chemikaliów [dostęp 2017-01-04] (ang.).
- ↑ Hydroksyloamina, roztwór (nr 467804) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2017-01-04]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Hydroksyloamina (nr 467804) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2017-01-04]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Robert T. Morrison, Robert N. Boyd: Chemia organiczna. T. 1. Warszawa: PWN, 1985, s. 732. ISBN 83-01-04166-8.
- ↑ Tablice biologiczne, Witold Mizerski (red.) i inni, Warszawa: Adamantan, 2013, s. 302, ISBN 978-83-7350-243-7, OCLC 891265110.
Bibliografia
- Hydroksylamina, międzynarodowa karta bezpieczeństwa chemicznego, Międzynarodowa Organizacja Pracy (pol. • ang.).


