Dziobak australijski
| Ornithorhynchus anatinus[1] | |||||
| (Shaw, 1799) | |||||

| |||||
| Systematyka | |||||
| Domena | |||||
|---|---|---|---|---|---|
| Królestwo | |||||
| Typ | |||||
| Podtyp | |||||
| Gromada | |||||
| Podgromada | |||||
| Rząd | |||||
| Rodzina | |||||
| Rodzaj |
Ornithorhynchus | ||||
| Gatunek |
dziobak australijski | ||||
| |||||
| Kategoria zagrożenia (CKGZ)[19] | |||||
 | |||||
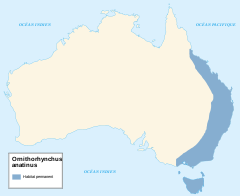
| Zasięg występowania | |||||
| |||||
Dziobak australijski[20], dziobak[21][e] (Ornithorhynchus anatinus) – prowadzący częściowo wodny tryb życia endemiczny dla wschodnich stanów Australii (w tym Tasmanii) gatunek ssaka z grupy stekowców, jedynych członków tej gromady składających jaja. Jest ostatnim istniejącym do dziś przedstawicielem swego rodzaju i rodziny, choć znaleziono skamieniałości licznych przedstawicieli tych taksonów.
Ma wiele nietypowych jak na ssaka cech: składa jaja, wydziela jad i ma dziób. Ujrzawszy go po raz pierwszy, europejscy przyrodnicy byli bardzo zdezorientowani, niektórzy sądzili nawet, że mają do czynienia z dobrze spreparowanym oszustwem. Należy do kilku jadowitych ssaków. Samiec posiada na tylnych łapach ostrogi wydzielające jad zdolny wywołać silny ból u człowieka. Ma również, podobnie jak kolczatkowate, zdolność elektrolokacji, z której korzysta szukając pożywienia. Unikatowe cechy dziobaka czynią go ważnym obiektem badań biologii ewolucyjnej i czynią zeń ikonę Australii. Wybierano go jako maskotkę imprez narodowych, przedstawia go też rewers australijskiej dwudziestocentówki. Stanowi także zwierzęcy symbol Nowej Południowej Walii[22].
Do początku XX wieku polowano na niego dla futra, obecnie podlega ochronie w całym zasięgu swego występowania. Choć programy rozmnażania w niewoli odniosły bardzo ograniczony sukces, a dziobak jest wrażliwy na zanieczyszczenie środowiska, nie jest bezpośrednio zagrożony wyginięciem.
Historia i etymologia
Europejczycy pierwszy raz napotkali dziobaka w 1798. Kapitan John Hunter, drugi gubernator Nowej Południowej Walii, obserwował, jak Aborygeni australijscy upolowali zwierzę przy pomocy włóczni. Hunter wysłał do Wielkiej Brytanii futro i własnoręczny szkic wraz z opisem, z którymi wielu zainteresowanych zapoznało się, jeszcze zanim mogli zbadać przesłane okazy[23]. Brytyjscy naukowcy początkowo nie uwierzyli w autentyczność okazu[24]. George Shaw, który sporządził pierwszy opis zwierzęcia w The Naturalist’s Miscellany: or Coloured Figures of Natural Objects Drawn and Described Immediately from Nature w 1799, określił go jako najniezwyklejszy ze ssaków[23], twierdził, że było niemożliwym nie oddać się zwątpieniu w jego prawdziwość, a Robert Knox wierzył, że może być spreparowany przez pewnego azjatyckiego taksydermistę[24]. Sądzono, że ktoś przyszył kaczy dziób do ciała zwierzęcia przypominającego bobra. Shaw wziął ze sobą nawet parę nożyczek do wysuszonej skóry, by szukać szwów[25]. W 1800 ukazała się kolejna praca, tym razem Thomasa Bewicka, w czwartym wydaniu A General History of Quadrupeds[23].
Wspomniany już Shaw publikował w 1799 w nazwę naukową zwierzęcia: Platypus anatinus[23]. Angielska nazwa „platypus” pochodzi od łacińskiej, która źródłosłów czerpie z kolei z greki – od słów πλατύς („platys” – płaski, szeroki) i πους („pous” – stopa). Tłumaczy się ją więc jako „płaskostopy”[26]. Shaw przypisał zwierzę takiemu rodzajowi po opisaniu go na podstawie futra i rysunku Huntera[23], ale szybko okazało się, że nazwa została wcześniej użyta dla chrząszcza z rodziny ryjkowcowatych (rodzaj Platypus)[27]. Zwierzę zostało niezależnie opisane jako Ornithorhynchus paradoxus przez Johanna Blumenbacha (dzięki okazowi przekazanemu mu przez sir Josepha Banksa)[28] w 1803. Nazwa ta oznaczała „paradoksalny ptasi dziób”. Nazwa rodzajowa Platypus nie mogła zostać wykorzystana do określenia dziobaka, ale zastosowany wraz z nią epitet gatunkowy był starszy od zaproponowanego przez Blumenbacha[23]. Zgodnie z regułami pierwszeństwa w nazewnictwie Ornithorhynchus anatinus stał się oficjalną naukową nazwą zwierzęcia[27], jak zauważa Hall, „hybrydowa” nazwa dla gatunku, który sam przypomina hybrydę[23]. Pochodzi ona od wyrazu ορνιθόρυνχος („ornithorhynchos”), oznaczającego dosłownie po grecku „ptasi pysk”, i od łacińskiego przymiotnika anatinus o znaczeniu "kaczy".
Polską nazwą „dziobak” („dziubak”) posłużył się Franciszek Kuberski w „Krótkim rysie historyi naturalney” w 1829 i nazwa ta przyjęła się w polskim piśmiennictwie[29].
Dziubak (Ornithorhynchus paradoxus) stąd osobliwszy, że w mieyscu warg ma dziób do kaczego podobny, znayduie się w ieziorach nowéy Hollandyi[30].
Sporadycznie w publikacjach z XIX wieku pojawiały się nazwy alternatywne (kaczonos, kret wodny, płetwokret), jednak nie weszły do powszechnego użycia[29]. W wydanej w 2015 roku przez Muzeum i Instytut Zoologii Polskiej Akademii Nauk publikacji „Polskie nazewnictwo ssaków świata” gatunkowi nadano nazwę dziobak australijski, rezerwując nazwę dziobak dla rodzaju tych stekowców[20].
Systematyka
Problemy dotyczyły również klasyfikacji dziobaka, zwierzęcia składającego jaja, a później karmiącego swe młode mlekiem. Wtedy za ssaki uznawano zwierzęta karmiące swe młode mlekiem, wydające na świat żywe młode. Ptakami określano stałocieplne zwierzęta składające jaja. Gadami były zwierzęta również składające jaja, ale zimnokrwiste. Żadna z tych grup nie mogła objąć dziobaka. Shaw uznał go jednak za ssaka. Umieścił go w Bruta (przemianowanych później na Edentata, szczerbaki – do grupy tej zaliczano leniwce i mrówkojady). Francuski anatom Étienne Geoffroy Saint-Hilaire postulował natomiast zaliczenie go do odrębnej gromady. Powszechny pogląd uznawał, że dziobak to falsyfikat. Knox radził nawet, by sklasyfikować go wraz ze wschodnimi syrenami i innymi dziełami sztuki[23].
Kolejne odkrycia nie rozwiały wątpliwości, wprost przeciwnie. W 1802 sir Everard Home, chirurg i anatom, zauważył jądra położone w jamie brzusznej, jak u gadów, a nie w mosznie, jak u ssaków, natomiast obie płcie posiadają kloakę – jest to również gadzia cecha. Umieścił on dziobaka w oddzielnym szczepie ssaków. Niedługo później ręką Meckela opisano ostrogę jadową i gruczoły mlekowe, charakterystyczne z kolei dla ssaków. Od gadów dziobaka odróżnia też obecność przepony. Wymieszanie cech gadzich i ssaczych doprowadziło uczonych do wniosku, że dziobak stanowi brakujące ogniwo pomiędzy tymi dwiema grupami zwierząt. Obecność gruczołów mlekowych przekonało część badaczy, że dziobak jest ssakiem. Jednakże uznawano wtedy, że ssaki nie składają jaj. Nawet sam Meckel nie był przekonany do uznania dziobaka za ssaka, uważał też, że to co odkrył, to nie były właściwe gruczoły mlekowe. Postulował umieszczenie dziobaka w osobnej gromadzie. Geoffroy również wydzielił osobną gromadę, którą nazwał Monotremata (stekowce)[23]. Nazwa ta wywodzi się właśnie od pojedynczego otworu kloaki[31]. Należała doń także kolczatka. Miał jednak mieszane uczucia co do pokrewieństwa tej grupy ze ssakami. Podobne stanowisko zajął Lamarck, zastosował jednak dla niej nazwę Prototheria. Francuski anatom Henri de Blainville uznał jednak za wystarczające wydzielenie oddzielnego rzędu ssaków, który nazwał Ornithodelphia. Uznawał też jego bliski związek z torbaczami[23].
Nowy etap dyskusji przyniosły odkrycia skamielin kopalnych krewnych dziobaka, między innymi Ornithorhynchus maximus czy Ornithorhynchus agilis, a także przedstawicieli rodzajów Obdurodon czy Steropodon[23].
Obecnie dziobaka klasyfikuje się wewnątrz gromady ssaków (Mammalia). W ich obrębie zalicza się go do podgromady ssaków jajorodnych (prassaków, Prototheria), wśród których wyróżnia się rząd stekowców (Monotremata). W tym rzędzie dziobaka zalicza się do rodziny dziobakowatych (Ornithorhynchidae)[23].
Budowa ciała i fizjologia
Ciało i szeroki, płaski ogon dziobaka pokrywa gęste brązowe futro stanowiące warstwę izolacyjną pomagającą utrzymać ciepło[25][27]. Futro tych zwierząt w promieniowaniu ultrafioletowym wykazuje zdolność do fluorescencji w intensywnym kolorze zielonym i niebieskim[32]. Ogon magazynuje energię w postaci tłuszczu (podobna adaptacja występuje u takich zwierząt, jak np. diabeł tasmański[33] czy jedna z ras owiec). Dziobak posiada błonę pławną na stopach i duży, gumowaty dziób. Cechy te wydają się bliższe kaczce, niż któremukolwiek ze znanych ssaków. Błona pławna jest większa na przednich łapach i tworzy kierujące się w tył fałdy, gdy zwierzę idzie po lądzie[27]. W przeciwieństwie do dziobów ptasich, w których część górna i dolna są oddzielne, a pomiędzy nimi znajduje się otwór prowadzący do jamy gębowej, pysk dziobaka stanowi organ zmysłowy, a usta leżą poniżej niego. Nozdrza sytuują się na grzbietowej powierzchni dzioba, oczy i uszy zaś w rowku z tyłu od nich, podczas pływania rowek ulega zamknięciu[27].

Masa ciała waha się od 1,0 do 2,4 kg w przypadku płci męskiej, średnio 1,7 kg, samice zaś 0,7–1,6 kg, średnio 0,9 kg. Samce osiągają 45–60 cm, średnio 50 cm, samice zaś 43 cm całkowitej długości ciała[27]. Obserwuje się trwałe regionalne różnice w średniej wielkości zwierzęcia, nie podlegają one jednak żadnej regule związanej z klimatem i mogą być powodowane innymi czynnikami środowiskowymi, jak drapieżnictwo czy obecność ludzi[34].
Temperatura ciała dziobaka wynosi około 32 °C, czym różni się on od większości łożyskowców osiągających zwykle 37 °C[35]. Badacze sugerują, że jest to stopniowa adaptacja do srogich warunków środowiskowych małej części przetrwałych do dziś stekowców, a nie ich ogólna cecha[36][37]. Zapotrzebowanie energetyczne zależy od masy ciała, temperatury wody w zbiorniku i aktywności zwierzęcia (nurkowanie), wynosząc 8,48 W/kg. Pływając zanurzony pod powierzchnią wody zużywa średnio 6,71 W/kg. Najmniej energii zużywa, pływając z prędkością 0,4 m/s. Poruszając się po lądzie z prędkością 0,2–0,3 m/s, zużywa 8,8–10,56 W/kg. Generalnie na jeden dzień przypada 684 kJ/kg. Występują znaczne różnice związane z porą roku: zimą, kiedy to dziobak spożywa o 68% więcej pokarmu, metabolizm jest znacznie większy, niż latem[38].
Szkielet i poruszanie się
Szczęka dziobaka ma odmienną, niż u większości innych ssaków, budowę, mięsień otwierający szczęki jest inny. Zarówno kość szczękowa, jak i kość przedszczękowa są wydłużone. Jak u wszystkich właściwych ssaków, kosteczki słuchowe ucha wewnętrznego uległy pełnemu włączeniu w czaszkę, nie leżą już w szczękach, jak u cynodontów i innych przedssaczych synapsydów. Ujście zewnętrzne kanału słuchowego leży u podstawy szczęki[27].
Odcinek szyjny kręgosłupa tworzy 7 kręgów szyjnych, jak u większości innych ssaków. Występują za to żebra szyjne[27].
O. anatinus posiada też dodatkowe kości w obręczy barkowej, jak międzyobojczykowa, niespotykana u innych ssaków. Występuje też kość krucza oraz procoracoid[27].
Prócz kości łonowej występuje epipubic bone, podobnie jak u torbaczy[27].
Dziobak chodzi w sposób właściwy gadom, jego nogi leżą po bokach tułowia, a nie pod nim. Wykorzystuje diagonalny wzorzec ruchu, ale jego ruchy nie są w pełni synchroniczne[27]. Idąc na lądzie, opiera się na nasadach kości palców, chroniąc błonę pławną pomiędzy nimi[39]. Gdy przemieszcza się powoli, jego tułów dotyka podłoża. Unosi go, dopiero gdy się śpieszy[27].
Kończyny przednie służą temu zwierzęciu również do pływania. Kość ramienna wykonuje wtedy znaczne ruchy rotacyjne. W odpychaniu się od wody pomaga mu błona pławna, zwijana przy palcach podczas chodu czy kopania[27].
Rotacja kończyny przedniej podczas pływania różni się od obserwowanej podczas kopania. Pridmore widzi tutaj ślad po przodku dziobaka, który kopał w ziemi[27].
Układ krwionośny i krew
Układ sercowo-naczyniowy dziobaka nie przedstawia większych różnic w porównaniu z jego odpowiednikami u innych ssaków. Wyróżnia go żyła wieńcowa i słabo rozwinięty węzeł zatokowy. Występują dwa obiegi krwi. Łuk tętnicy głównej powstaje z lewego łuku czwartego łuku skrzelowego[27].
Erytrocyty o objętości 54 ±1,5 fL, dwuwklęsłego kształtu, nie mają jąder. Hemoglobina wynosi 175 ±4,0 g/L, a hematokryt 52 ±1,0%. MCHC jest równe 353 ±6,0 g/L. Dzięki temu krew dziobaka posiada dużą zdolność transportowania tlenu, w 100 ml mieści się go 23 ml. Również trombocyty nie przedstawiają różnic w porównaniu z płytkami innych ssaków. Leukocyty wyróżniają się ciałkami Döhlego[27].
Dziobak rozwinął przystosowania do nurkowania. Wymienia się wśród nich bradykardię i efekt Bohra[27].
Układ oddechowy
Dziobak prowadzi wymianę gazową za pomocą płuc. Nie są one symetryczne: po stronie prawej narząd ten składa się z dwóch płatów, podczas gdy po lewej występuje tylko 1 płat[27].
Poniżej płuc znajduje się przepona[27].
Układ pokarmowy
Osobnik dorosły nie ma zębów[40]. Dziobak posiada za młodu jedną parę zębów przedtrzonowych i dwie pary trzonowców w szczęce oraz trzy pary trzonowców w żuchwie[27]. Zęby z pierwszej pary w szczęce i trzeciej pary w żuchwie mają po jednym głównym guzku, pozostałe zęby mają po dwa główne guzki[41]; oprócz nich na zębach występuje też po kilka mniejszych guzków[42][43]. Dziobak traci zęby przed lub niedługo po opuszczeniu nory, w której przyszedł na świat[27]. Dorosłe osobniki posiadają w ich miejsce silnie skeratynizowane opuszki. Za nimi leżą worki policzkowe, służące magazynowaniu pokarmu. W segregowaniu rozdrobnionej żywności bierze również udział ząbkowana skóra pokrywająca okolicę żuchwy[27].
Przewód pokarmowy określa się jako prosty i krótki. Samica długości 44 cm dysponuje przewodem pokarmowym długości 140 cm. Niewielki żołądek ogranicza cienka ściana, pozbawiona gruczołów. Występują natomiast gruczoły Brunnera. Pofałdowanej ściany krótkiego jelita cienkiego nie wyściełają kosmki jelitowe. Pomiędzy fałdami znajdują się ujścia gruczołów jelitowych. Jelito grube również jest krótkie, występuje niewielka kątnica. Przewód pokarmowy poszerza się z przejściem w prostnicę[27].
Trawienie odbywa się przy udziale wydzielin trzustki i gruczołów ściany przewodu pokarmowego[27].
Pożywienie dziobaka to głównie bezkręgowce bentosu[27].
Układ rozrodczy
W przeciwieństwie do innych ssaków dziobak posiada stek (kloakę), połączoną zarówno z jelitem, jak i układem rozrodczym[40]. Jest to cecha typowa dla gadów[23].
Moszna nie występuje, wobec czego jądra nie zstępują[40]. Znajdują się w brzuchu. Prócz plemników wytwarzają testosteron i dihydrotestosteron[31].
Jad

Zarówno samce, jak i samice rodzą się z ostrogami u kości piętowych, jednakże tylko u tych pierwszych produkowany jest jad[44][45][46], złożony głównie z białek przypominających defenzyny (DLP)[47]. Chodzi o 19 peptydów powstałych dzięki duplikacji genów kodujących defensynę B, peptyd natriuretyczny C i NGF[40]. Trzy z nich są unikatowe dla dziobaka[47]. Defenzyny produkuje układ immunologiczny stekowca. Wystarczająco silny dla zabicia zwierzęcia wielkości psa, jad nie jest śmiertelny dla człowieka, ale wywołuje rozdzierający ból, uniemożliwiający ugodzonemu normalne wykonywanie czynności[47][48]. Wokół rany szybko rozwija się obrzęk stopniowo rozprzestrzeniający się wzdłuż kończyny. Wedle opisów przypadków i dowodów anegdotycznych rozwija się długo trwająca hiperalgezja (przeczulica), niemijająca w ciągu dni lub nawet miesięcy[49]. Jad produkują goleniowe gruczoły samca, będące nerkokształtnymi gruczołami pęcherzykowymi połączonymi z cienkościennym kanałem prowadzącym do ostrogi kości piętowej każdej z tylnych łap. Samica, tak jak kolczatkowate, dysponuje tylko szczątkowym zalążkiem ostrogi, która nie rozwija się, zanikając przed końcem pierwszego roku życia. Brakuje jej też funkcjonujących gruczołów goleniowych[27].
Jad wydaje się odgrywać odmienną rolę, niż ten produkowany przez zwierzęta nienależące do ssaków. Nie zagraża on życiu wystawionemu na jego działanie, ale powoduje poważny uszczerbek na jego zdrowiu. Ponieważ wytwarzają go tylko samce i jego produkcja wzrasta podczas sezonu rozrodczego, wysnuto teorię, że służy on jako ofensywna broń dla zapewnienia sobie dominacji podczas tego okresu[47].
Układ nerwowy
Dziobak posiada duży ssaczy mózg. Duży obszar zajmuje w nim kora nowa, zwłaszcza w porównaniu ze starszymi częściami kory. Jego powierzchnię charakteryzuje lisencefalia. Nie ma spoidła wielkiego, za to komunikacja pomiędzy półkulami mózgowymi przebiega spoidłem przednim i hipokampalnym[27].
Elektrolokacja

Stekowce (prócz dziobaka także kolczatkowate) należą do nielicznych (do niedawna były uważane za jedyne) ssaków posługujących się elektrorecepcją: lokalizują one swą zdobycz po części przez detekcję zaburzeń pola elektrycznego generowanego przez skurcze mięśni. Zmysł ten wśród stekowców najlepiej rozwinął się właśnie u dziobaka[50].
Elektroreceptory zlokalizowane są w podłużnych rowkach skóry dzioba, mechanoreceptory natomiast są na nim rozłożone jednolicie. Obszar elektrosensoryczny kory mózgowej zawiera się w obrębie pola czuciowego somatosensorycznego. Niektóre neurony korowe otrzymują pobudzenie pochodzące zarówno z elektroreceptorów, jak i mechanoreceptorów, co wskazuje na bliskie powiązania pomiędzy tymi zmysłami. Oba rodzaje receptorów dzioba dominują w mapie somatotropowej kresomózgowia dziobaka, tak jak ręce w przypadku człowieczka czuciowego u ludzi[51][52].
Dziobak potrafi ustalić kierunek źródła fal elektrycznych prawdopodobnie przez porównywanie różnic w sile sygnału pomiędzy różnymi receptorami. Wyjaśniałoby to charakterystyczne ruchy głowy zwierzęcia – z boku na bok – podczas polowania. Konwergencja korowa impulsów z obu zmysłów sugeruje mechanizm oceny odległości potencjalnej zdobyczy; wyznacza ją różnica czasów odebrania obu sygnałów (elektrycznego i mechanicznego)[50].
Podczas żerowania ssak ten nie korzysta ze wzroku ani węchu[53], zamykając oczy, uszy i nozdrza podczas nurkowania[54]. Gdy pływa, ryjąc swym dziobem w dnie strumienia, jego elektroreceptory wykrywają niewielkie prądy elektryczne generowane przez skurcze mięśni potencjalnej ofiary. Umie zatem odróżnić obiekty ożywione od nieożywionych, cały czas pobudzających jego mechanoreceptory[50]. Eksperymenty pokazały, że drapieżnik reagował na imitację krewetki, gdy przepuszczano przez nią niewielki prąd elektryczny[55].
Wzrok
Z wyników badań opublikowanych w 2011 wynika, że oczy dziobaka mogą być bardziej podobne do tych u śluzicy brunatnej i minogów występujących na półkuli północnej, niż do oczu większości czworonogów. Ponadto zwierzęta tego gatunku posiadają podwójne czopki w siatkówce oka, których brak u większości ssaków[56]. W ogóle z wyglądu ich siatkówka przypomina spotykaną u zauropsydów[31].
Pomimo że oczy dziobaka są małe i są zamknięte pod wodą, kilka cech wskazuje, że wzrok odgrywał istotną rolę u jego przodków. Powierzchnia rogówki i przylegająca do niej powierzchnia soczewki są płaskie, natomiast tylna powierzchnia soczewki jest mocno zakrzywiona, podobnie, jak w oczach innych ssaków wodnych takich, jak wydry i lwy morskie. Skroniowa (po stronie uszu) koncentracja komórek zwojowych siatkówki, ważna dla widzenia stereoskopowego, wskazuje na rolę w drapieżnictwie, podczas gdy towarzysząca ostrość widzenia jest niewystarczająca do takiej aktywności. Ponadto, ograniczona ostrość wzroku współgra z małym powiększeniem kory wzrokowej, małym ciałem kolankowatym bocznym i dużymi wzgórkami górnymi pokrywy śródmózgowia, co sugeruje, że pokrywa śródmózgowia odgrywa ważniejszą rolę niż w korze wzrokowej, jak to jest u niektórych gryzoni. Cechy te wskazują, że dziobak zaadaptował się do wodnego i nocnego trybu życia, rozwijając swój system elektrorecepcyjny kosztem wzroku[51].
Węch
Węch dziobaka służy na pewno chemorecepcji w środowisku lądowym. Cząsteczki odorantów rozpoznają receptory węchowe (około 700 rodzajów, większość ssaków posiada ich dwukrotnie więcej) oraz receptory lemieszowo-nosowe typu 1 (V1R, około 950 rodzajów) i 2 (V2R, około 80 rodzajów). Wiele kodujących je genów cechuje się pochodzeniem monofiletycznym, powstało 166 milionów lat temu poprzez duplikację. Liczna rodzina V1R nie znajduje odpowiednika u kurczaka ani łuskonośnego anolisa zielonego. Uważa się, że może odgrywać rolę w rozpoznawaniu feromonów lub odorantów rozpuszczonych w wodzie[31].
Immunologia
Pomimo podobieństw anatomicznych analiza genomu dziobaka wykazała pewne różnice w genach odpowiedzialnych za układ immunologiczny w porównaniu z innymi ssakami. Zwraca uwagę aż 214 genów kodujących receptory komórek NK. Dla porównania u człowieka występuje ich 15, u szczura trzykrotnie więcej, a u oposa tylko 9. Z tym ostatnim łączy dziobaka ekspansja rodziny katelicydyny (chodzi o białko o działaniu przeciwdrobnoustrojowym, uczestniczące w odporności wrodzonej), u dziobaka zaobserwowano również ekspansję rodziny CD163[31].
Etologia i zachowanie

Dziobak wiedzie po części wodny tryb życia. Zamieszkuje niewielkie strumienie i rzeki. Ma szeroki zasięg występowania od zimnych wzgórz Tasmanii i Alp Australijskich do tropikalnych lasów deszczowych wybrzeży Queenslandu, sięgając na północy Półwyspu York[57]. Jego zasięg w głębi lądu nie został tak dobrze poznany. Stekowca tego nie spotyka się w Australii Południowej, nie licząc Wyspy Kangura, gdzie został introdukowany[58]. Nie zamieszkuje już głównej części Basenu Murray–Darling, prawdopodobnie z powodu obniżenia jakości wód na skutek rozległej wycinki drzew i irygacji[59]. Wzdłuż przybrzeżnych systemów rzecznych jego występowania nie można przewidzieć. Wydaje się nieobecny we względnie czystych rzekach, a utrzymuje się w innych znacznie zdegradowanych (np. dolny odcinek rzeki Maribyrnong)[60].
W niewoli ssak dożywa 17 lat. Chwytano dziko żyjące osobniki mające do 11 lat. Śmiertelność dorosłych na wolności wydaje się niska[27]. Na dziobaki polują węże, bobroszczury złotobrzuche, waranowate, jastrzębie, sowy i orły. Mniej dziobaków pada prawdopodobnie ofiarą krokodyli[61]. Introdukcja lisa jako drapieżnika polującego na króliki mogła mieć wpływ na liczbę tych stekowców na stałym lądzie[34] Siedlisko tego zwierzęcia to rzeki i strefy przybrzeżne. Te pierwsze zapewniają mu pożywienie, na brzegach natomiast kopie nory, w których wypoczywa lub zajmuje się potomstwem[62]. Temperatura w norze wynosi średnio 14,2 °C zimą (niekiedy zaś przekraczała temperaturę na zewnątrz o 18 °C), a 17,5 °C latem[38]. Jego terytorium może rozciągać się na długości od 2,9 do 7,0 km, przy czym teren zajmowany przez samca pokrywa się z obszarami bytowania 3–4 samic[63].
Zwierzę to świetnie pływa i spędza dużo czasu w wodzie, poszukując pożywienia. Podczas pływania można go odróżnić od innych australijskich ssaków po niewidocznych uszach[64]. W unikalny wśród ssaków sposób porusza się do przodu dzięki naprzemiennym ruchom dwóch przednich stóp. Choć wszystkie jego cztery łapy wyposażone są w błonę pławną, tylne trzymane są przy ciele i pomagają w parciu do przodu. Razem z ogonem odgrywają funkcję steru[65]. Gatunek jest stałocieplny, utrzymuje temperaturę swego ciała na poziomie około 32 °C ±0,4 °C (niższej, niż u większości ssaków), żerując nawet w wodzie chłodniejszej niż 5 °C. Zachowuje zdolność regulacji temperatury swego ciała w powietrzu o temperaturze pomiędzy 0 a 30 °C. Stałocieplność zawdzięcza zmianom metabolizmu oraz izolacji, w tym poprzez futro. Co prawda traci ono w wodzie 60–70% swych właściwości izolacyjnych, jednak i tak spełnia tę rolę lepiej, niż owłosienie większości ssaków. Odnajdywano osobniki pogrążone w hibernacji bądź torporze[27].
Nurkuje zwykle przez około 30 sekund (średnia 31,3 s), choć potrafi dłużej. Rzadko jednak przekracza limit oddychania bez dostaw tlenu, szacowany na 40 sekund. 15% nurkowań trwało dłużej, co oznacza, że w tym czasie dziobak uzyskiwał energię beztlenowo. 72% nurkowań należy do przedziału czasowego 18–40 s. Osiąga średnią głębokość 1,28 m, potrafi jednak zanurkować na 8,77 m. Pomiędzy nurkowaniami odpoczywa na powierzchni przez 10–20 sekund, średnio przebywając na powierzchni 10,1 s[38][66]. Będąc mięsożercą, zjada głównie pierścienice, larwy owadów, krewetki słodkowodne i rakowate. Ryje w korycie rzecznym swym pyskiem lub łapie pływające ofiary. Wykorzystuje kieszonki policzkowe, by przetransportować zdobycz na powierzchnię, gdzie ją zjada[64]. Pod wodą spędza zazwyczaj mniej niż 2 minuty[27]. Potrzebuje dziennie pokarmu o masie równej ¹∕₅ masy swego ciała. By go zdobyć, spędza w poszukiwaniu pożywienia średnio 12,4 godziny na dobę (maksymalny czas poszukiwania wedle Bethgego to 28,9 godziny)[38]. Wedle Granta połowę czasu spędza w swojej norze[27] Czas ten wykazuje zależność od pory roku i płci zwierzęcia. Dziobaki najaktywniej poszukują pożywienia od sierpnia do listopada, minimum aktywności przypada na styczeń[38]. O. anatinus prowadzi zmierzchowo-nocny tryb życia, jednak rzadko widuje się osobniki aktywne także za dnia zwłaszcza przy zachmurzonym niebie[62][67]. W ogólności dziobak spędza aktywnie średnio 13,5 h na dobę. Minimum wyniosło 3,40 h, najdłuższy zaś zaobserwowany w cytowanym badaniu okres aktywności trwał bez przerwy 30,83 h. Okresy aktywności rozpoczynają się trwającym średnio 0,83 h czasem niewielkiej aktywności zwierzęcia, po których następował znaczny jej wzrost. Ten wstępny czas mógł nie występować w ogóle, a najdłużej trwał 3,25 h. Podobny okres występuje pod koniec aktywności, przypada nań średnio 0,35 h. Zakres obejmuje 0–2,5 h[38].
Po wyjściu z wody odpoczywa w krótkiej, prostej, owalnej w przekroju norze, położonej prawie zawsze na brzegu niedaleko lustra wody, często ukrytej w plątaninie korzeni[64]. Słyszano warczenie zaniepokojonych dziobaków, u osobników trzymanych w niewoli zanotowano repertuar innych dźwięków[25].
Jednak poszczególne osobniki wykazują zróżnicowane wzorce zachowania. Zazwyczaj uważa się dziobaka za zwierzę nocne, jednak w badaniu Bethgego tylko 60% zwierząt spełniało taki wzorzec[38].
Rozmnażanie
Gdy europejscy przyrodnicy pierwszy raz natknęli się na dziobaka, podzieliła ich kwestia, czy samica składa jaja. Nie rozstrzygnięto jej aż do 1884, gdy William Hay Caldwell został przysłany do Australii, gdzie, po rozległych poszukiwaniach prowadzonych przez asystujący mu zespół 150 Aborygenów, udało mu się znaleźć kilka jaj[27][47]. Świadomy wysokich kosztów każdego słowa przesłanego telegrafem z Australii do Anglii, Caldwell wysłał do Londynu sławną, acz treściwą wiadomość „Stekowce jajorodne, jajo meroblastyczne”[68], co znaczy, że składają one jaja przypominające gadzie, których tylko fragment dzieli się i rozwija.
Gatunek wykazuje pojedynczy okres rozrodczy pomiędzy czerwcem i październikiem. Poszczególne populacje wykazują w tym względzie niewielkie różnice[61]. Historyczne obserwacje, badania metodą wielokrotnych złowień oraz wstępne badania genetyki populacji wskazują na możliwość istnienia w populacji zarówno stałych, jak i migrujących członków i sugeruje poligyniczny system reprodukcji[69]. Samice zdają się osiągać dojrzałość płciową w drugim roku życia[69], jednak rozmnażają się począwszy od trzeciego roku życia[27]. W rozrodzie uczestniczą jeszcze zwierzęta starsze, niż dziewięcioletnie[69], w przypadku samic nawet jedenastoletnie. Nie rozmnażają się jednak co roku[27].
Poza sezonem rozrodczym dziobak żyje w pojedynczej wykopanej w ziemi norze z wejściem położonym około 30 cm nad poziomem lustra wody. Po parzeniu samica buduje głębszą, lepszej jakości jamę o długości dochodzącej do 20 m, przerywaną odcinkami blokującymi dostęp do dalszej części. Mogą one chronić zwierzęta przed podniesieniem się poziomu wody czy drapieżnikami lub stanowić metodę regulacji wilgotności i temperatury[70]. Samica nie wybiera sobie partnera samodzielnie, wyboru takiego dokonuje samiec. Gryzie ogon swej wybranki i przygważdża samicę. Odbywa się zbliżenie. Zachowanie to jest głośne i energiczne. Samiec gryzie teraz szyję samicy. W końcu udaje mu się wprowadzić prącie do jej kloaki[71]. Pozostawia on tam nasienie. Znajdują się w nim nitkowate plemniki, przypominające ptasie czy gadzie, grupujące się po sto w najądrzach, co z kolei jest wśród owodniowców unikatowe. Z drugiej strony najądrze nie jest zbyt dobrze przystosowane do magazynowania plemników, brakuje typowych dla innych ssaków genów odpowiedzialnych za jego pracę. Wydziela on głównie lipokalinę jak najądrza gadzie. Występuje jednak ortolog ADAM7. Pod względem genetycznym błona plemników i receptory osłonki przejrzystej przypominają swe odpowiedniki u ssaków żyworodnych. Plemnik dziobaka nie dysponuje natomiast specyficznymi dla jądra proteazami, pomagającymi przebić się przez osłonkę przejrzystą jaja[31]. Po kopulacji nasienie zostaje zmagazynowane, służy do zapłodnienia jaj. Po stosunku spędza jeszcze około godziny w towarzystwie partnerki, pływając w jej otoczeniu, by upewnić się, że jego sperma weźmie udział w zapłodnieniu. Następnie może rozpocząć starania o rozród z inną samicą[71]. Ojciec nie bierze udziału w opiece nad potomstwem i powraca do swojej nory. Samica zaś wyścieła podłoże opadłymi pofałdowanymi mokrymi liśćmi, a gniazdo na końcu tunelu wypełnia opadłymi liśćmi i trzciną, tworząc rodzaj posłania. Znosi ten materiał do nory, trzymając go pod zwiniętym ogonem[25].
Samica dziobaka posiada parzysty jajnik[67] o średnicy 4 mm[31], ale tylko jeden narząd z dwóch funkcjonuje[67]. Komórka jajowa otoczona jest osłonką przejrzystą. Wszystkie 4 geny kodujące jej białka u człowieka występują też u dziobaka, który posiada również 2 geny ZPAX, obserwowane poza nim wyłącznie u płazów, ptaków i ryb. Ssaki żyworodne utraciły też obecny u dziobaka gen kodujący produkt o nazwie aspartyl-protease nothepsin. Prócz genu kodującego witellogeninę występuje pseudogen (u ssaków jajorodnych nie ma takiego genu wcale, u zauropsydów występują 3 geny)[31].
Dziobak stosuje strategię K[27]. Samica składa 1–3[72] bądź 2–4[71] (zwykle dwa) małe, skórzaste jaja przywodzące na myśl gadzie. Ich średnica wynosi około 11 mm. Są bardziej zaokrąglone od jaj ptasich[72]. Rozwijają się w macicy[68] przez około 21[31]–28 dni, a tylko przez 10[68]–11[31] dni na zewnątrz organizmu matki. Kontrastuje to ze sposobem rozrodu ptaków – np. u kury jajo spędza 1 dzień w drogach rodnych nioski i 21 dni w środowisku zewnętrznym[67]. Po złożeniu jaj samica owija się wokół nich. Czas inkubacji dzieli się na 3 fazy. W pierwszej embrion nie posiada jeszcze funkcjonujących narządów i korzysta z zasobów zgromadzonych w pęcherzyku żółtkowym, absorbując żółtko[68]. Podczas drugiej rozwijają się palce, a w ostatniej pojawia się ząb jajowy[73].
Świeżo wyklute młode jest podatne na urazy, ślepe i pozbawione owłosienia. Matka karmi je mlekiem[25][74], jednak laktacja u dziobaka również różni się od laktacji ssaków żyworodnych. Istnieje hipoteza, zgodnie z którą laktacja pojawiła się dużo wcześniej, nim wyewoluowały ssaki. Początkowo służyć miała nawadnianiu jaj bądź ochronie przed drobnoustrojami[31]. Samica dziobaka posiada gruczoły piersiowe[25][74] o prymitywnej budowie[23], brakuje jej sutków – mleko wydostaje się na zewnątrz przez pory w skórze. Na brzuchu karmiącej występują szczeliny, w których się ono gromadzi i z których młode mogą je chłeptać[25][74]. Tak zbudowany gruczoł może jeszcze odgrywać pewną rolę w opiece nad jajami[31]. Chociaż matka produkuje mleko dzięki prymitywnej kasecie genów kazeiny[40] z genem kodującym β-kazeinę po niedawnej duplikacji, zawiera ono białka odżywcze, jak też chroniące przed drobnoustrojami. Jest ono bogate w cukry i tłuszcze[31]. Po wykluciu potomstwo spożywa mleko przez 3–4 miesiące[75]. W tym czasie skład białkowy mleka ulega zmianie, podobnie jak u torbaczy, w przeciwieństwie do większości Eutheria[31]. Podczas inkubacji i odstawiania matka początkowo opuszcza jamę tylko na krótko, by się pożywić. Tworzy wtedy liczne przeszkody w jamie, by utrudnić drapieżnikom dotarcie do młodych. Gdy wraca, przeciskając się przez nie suszy sobie futro, tak że komora lęgowa pozostaje sucha[75]. Po około pięciu tygodniach matka zaczyna spędzać więcej czasu z dala od młodych, które opuszczają norę w wieku czterech miesięcy[74]. Rodzą się co prawda z zębami, ale te wypadają im w bardzo wczesnym wieku, w ich miejscu pozostają zrogowaciałe płytki, którymi ssak miażdży pokarm[76].
Długość życia dziobaka wynosi w niewoli do 17 lat. Osobniki młode rzadko spotykane były kilkukrotnie. Może to wskazywać na ich większą umieralność bądź zajmowanie nowych terenów[27].
Ewolucja

Stekowce przez długi czas pozostawały bardzo słabo poznaną grupą zwierząt i pokutuje jeszcze wiele dziewiętnastowiecznych mitów na ich temat. Wedle takich opinii zwierzęta te miałyby być quasi-gadami lub stworzeniami niższymi[77]. W 1947 William King Gregory wysnuł teorię, wedle której łożyskowce i torbacze mogły zróżnicować się wcześniej, a dopiero później ta druga gałąź podzieliła się na właściwe torbacze i stekowce. Późniejsze badania i odkrycia skamielin podważyły jednak tę teorię[77][78]. W rzeczywistości współczesne stekowce stanowią wczesne odgałęzienie drzewa rodowego ssaków[40]. Dokładny czas rozdzielenia się linii trudno oszacować, jednakże nie zaszło ono wcześniej niż 315 milionów lat temu, kiedy to ssaki wyodrębniły się z zauropsydów, ale też nie później niż 90 milionów lat temu, kiedy miała miejsce radiacja Eutheria[31]. Linia stekowców powstała pomiędzy 200 a 160 milionami lat. Na podstawie badań genetycznych najbardziej prawdopodobną wartość szacuje się na 166 milionów lat[31][40]. Po powstaniu gałąź podzieliła się na torbacze i łożyskowce[77][79]. Zegar molekularny i datowanie skamieniałości sugerują rozdział linii dziobaków i kolczatek na 19–48 milionów lat temu[80], średnio podaje się 21,2 miliona lat temu[31][40].
Rodzina dziobakowatych istnieje na kontynencie australijskim od przynajmniej 15 milionów lat[27]. Najstarsze odkryte skamieniałości współczesnego dziobaka datuje się na około 100 000 lat (czwartorzęd). Wymarłe stekowce Teinolophos i Steropodon były z nim blisko spokrewnione[78]. Skamieliny tego drugiego rodzaju odnaleziono w Nowej Południowej Walii. Składają się na nie opalizująca żuchwa z trzema zębami trzonowymi (podczas gdy dorosły współczeny dziobak jest bezzębny). Trzonowce uznano początkowo za trybosfeniczne, co wsparłoby wariację teorii Gregory’ego. Późniejsze badania stwierdziły jednak, że – choć kończyły się trzema guzkami – wyewoluowały niezależnie[82]. Szczątkom przypisuje się wiek 110 milionów lat, co oznacza, że przypominające dziobaki stworzenia żyły już w okresie kredowym. Są to najstarsze skamieliny ssaka znalezione w Australii. Sfosylizowane szczątki Monotrematum sudamericanum, innego krewnego dziobaka, znaleziono w Argentynie. Oznacza to, że stekowce zamieszkiwały superkontynent Gondwanę, gdy tworzyły go Ameryka Południowa i Australia połączone z Antarktydą (do 167 milionów lat temu)[82][83].
Genetyka
Wstępną wersję sekwencji genomu dziobaka jako pierwszego ze stekowców opublikowało Nature 8 maja 2008, odkrywając zarówno gadzie, jak i ssacze jego elementy, a także dwa geny znajdowane wcześniej jedynie u ptaków, płazów i ryb. Ponad 80% genomu dziobaka wykazuje zgodność ze zsekwencjonowanymi genomami innych ssaków[31]. Genom dziobaka jest niewielki. Zawiera on 2,3 miliarda par zasad[40]. Tworzą one 18527 genów kodujących białka[31], liczba ta nie odbiega od występujących u innych ssaków[40].
Dla 15 312 z wyżej wymienionych 18 527 genów znaleziono ortologi wśród innych ssaków (przebadano 5 gatunków). Te posiadające swoje odpowiedniki w stosunku 1:1 odpowiadają głównie za metabolizm, replikację DNA i slicing.
Geny bez ortologów cechują się szybką ewolucją[31]. Aż 1730 genów odpowiada za receptory węchowe. Nie występuje za to wiele genów spotykanych wśród Eutheria, kodujących choćby cytochrom P450, syntetazę glutaminową, witellogeninę II, receptor melatoniny 1C. Brakuje też genu SRY odpowiedzialnego za determinację płci. Z drugiej strony zwraca się uwagę na homologi genów gadzich czy ptasich. Charakterystyczne są liczne paralogi KIR w liczbie 214 (dla porównania u człowieka występuje ich 15)[40].
Ilość niekodujących białek RNA szacuje się na mniej niż u innych ssaków, 1220 z wyłączeniem małego jądrowego RNA. Linia dziobaka musiała oddzielić się jeszcze przed zajściem u innych ssaków rozległej retrotranspozycji. Odwrotnie sprawa wygląda w przypadku małych jądrowych RNA (snoRNA). Dziobak dysponuje 2000 kopii – jest to dziesięciokrotnie więcej, niż u innych ssaków[31].
Kwas deoksyrybonukleinowy dziobaka grupuje się w 52 chromosomy. Różnią się one wielkością, co nasuwa na myśl mikrochromosomy i makrochromosomy gadów. Tych mniejszych jest u dziobaka więcej. Jednak położone na nich geny nie pokrywają się z genami mikrochromosomów kurczaka. Element (SINE)-like występuje aż w 40 000 kopii. Podobieństwo do euteriów widać za to w przypadku piRNA, czyli RNA związanego z białkiem Piwi, z funkcją metylacji DNA i jego wyciszania. Wyróżnia się jednak większą liczbą powtórzeń i strukturami służącymi obronie przed transpozonami[31].
Z powodu wczesnego rozejścia się stekowców i ssaków żyworodnych oraz małej liczby przetrwałych do dziś gatunków tej pierwszej grupy, dziobak jest częstym obiektem badań biologii ewolucyjnej. W 2004 naukowcy z Australian National University odkryli u niego 10 chromosomów płci zamiast dwóch spotykanych u większości innych ssaków. Tak więc samiec cechuje się zestawem heterosomów nie XY, ale XYXYXYXYXY[84]. Pomimo użycia do ich opisu symboli używanych dla ssaków, chromosomy dziobaka bardziej pasują do ptasiego systemu determinacji płci z heterosomami Z i X[85]. Chromosom X dzieli homologie z ptasim chromosomem Z. Nie stwierdzono za to ortologów z ludzkim chromosomem X. Odkrycia te świadczą o tym, że ssaczy system determinacji płci, bazujący na chromosomach X i Y, jest młodszy, niż wcześniej przewidywano, i pojawił się już po podziale linii, w wyniku którego oddzieliły się stekowce[40]. Plemniki, dysponując połową materiału genetycznego diploidalnego osobnika, mogą zawierać komplet 5X bądź 5Y. Podczas podziału mejotycznego chromosomy te tworzą coś w rodzaju łańcucha[31].
Dziobaczy genom obejmuje też zarówno gadzie, jak i ssacze geny związane z zapłodnieniem jaja[31]. Od kiedy wykazano, że nie posiada genu SRY determinującego płeć męską u ssaków, mechanizm determinacji płci pozostaje u tego gatunku niewyjaśniony[86].
Drapieżnictwo i choroby
Wedle Burrela (1927) na dziobaki polują węże Morelia spilota variegata, waranowate, orły i ryba Maccullochella peelii. Później ustalono, że do tej listy należałoby dopisać lisy, gryzonia Hydromys chrysogaster, krogulca australijskiego, krokodyle i ryby węgorzokształtne[27].
Do pasożytów dziobaka zaliczają się owady Pygiopsylla hoplia i Pygiopsylla zethi, pajęczaki Amblyomna triguttatum i Ixodes ornithorhynchi, nicienie Capillaria, Maritrema ornithorhynchi, Mehlisia ornithorhynchi i Moreauia mirabilis, a prawdopodobnie też Tasmanema mundayi, pierwotniaki Theileria ornithorhynchi, Trypanosoma binneyi, Eimeria[27].
Wśród drobnoustrojów powodujących choroby dziobaków wymienia się pałeczkę okrężnicy i Aeromonas hydrophila. Odnotowano również zakażenie glonami, które doprowadziło do owrzodzeń skóry. Wykryto też przeciwciała przeciwko Leptospirosis interogans[27].
Status i ochrona
Nie licząc zniknięcia z Australii Południowej, O. anatinus zajmuje zasadniczo podobne tereny, jak przed europejskim osadnictwem w Australii. Udokumentowano tylko lokalne zmiany i fragmentację zasięgu wywołane modyfikacjami w środowisku dokonanymi przez człowieka. Jego obecna i przeszła liczebność nie są najlepiej poznane, sądzi się, że liczba osobników obniża się, ale gatunek pozostaje pospolity w większej części swego obecnego zasięgu występowania[62]. W przeszłości organizowano na niego polowania w szerokim zakresie, mające dostarczyć futra. Trwało to do początku XX wieku i objęcia zwierzęcia ochroną w całym państwie w 1905[75]. Jednak do 1950 istniało ryzyko utonięcia osobników zaplątanych w sieci rybackie[59]. Gatunek nie wydaje się podlegać bezpośredniemu ryzyku wyginięcia dzięki działaniom ochronnym, ale niekorzystny wpływ może mieć nań degradacja środowiska, w tym budowanie tam, irygacja, zanieczyszczenie, sieci, a także zastawianie pułapek[19]. IUCN klasyfikuje go jako LC (Least Concern – gatunek najmniejszej troski)[19].

Na wolności dziobak cierpi zaledwie na kilka znanych chorób. Populacje z Tasmanii potencjalnie zagrożone są rozwojem epizoocji zakażenia grzybem Mucor amphibiorum. Grzybica zwana mukormykozą atakuje tasmańskie osobniki, ale nie zaobserwowano jej dotąd na kontynencie. Infekcja objawia się zmianami skórnymi, a nawet wrzodami na różnych częściach ciała, w tym na plecach, ogonie i łapach. Mukormykoza może spowodować śmierć zakażonego zwierzęcia, która następuje zwykle na skutek infekcji wtórnych lub upośledzenia zdolności termoregulacji czy skutecznego zdobywania pokarmu. The Biodiversity Conservation Branch w Department of Primary Industries and Water współpracuje z NRM północ z Uniwersytetu Tasmańskiego, w celu ustalenia skutków choroby dla tasmańskiej populacji dziobaka, mechanizm przenoszenia jej na kolejne osobniki i rozprzestrzenienie grzybicy[87]. Do niedawna zasięg introdukowanego lisa ograniczał się do kontynentalnej Australii, ale rośnie liczba dowodów na jego obecność w niewielkiej liczbie także na Tasmanii[88].
Dziobak i idea jego ochrony została spopularyzowana w 1939, gdy National Geographic Magazine opublikował artykuł o zwierzęciu i wysiłkach ponoszonych w celu zbadania go i utrzymania w niewoli. To ostatnie zadanie sprawia wielkie trudności. W niewoli odchowano zaledwie kilka młodych. Pierwszy sukces osiągnął Rezerwat Healesville w Wiktorii. Znaczną rolę odegrał w tych pracach David Fleay, założyciel platypussary – symulacji strumienia w zbiorniku w Rezerwacie Healesville. Młode przyszły na świat w 1943[89]. W 1972 znalazł martwe młode w wieku około 50 dni, wyklute prawdopodobnie w niewoli, w jego David Fleay Wildlife Park w Burleigh Heads w pobliżu Gold Coast w stanie Queensland[90]. Healesville powtórzył swój sukces w 1998 i ponownie w 2000, w podobnym zbiorniku ze strumieniem. Taronga Zoo w Sydney dochowało się bliźniaków w 2003, a rozród udał się znowu w 2006[91].
Dziobak w rezerwatach przyrody

Dziobaka można zobaczyć w specjalnych akwariach w następujących australijskich rezerwatach przyrody i ogrodach zoologicznych:
- David Fleay Wildlife Park – Gold Coast, Queensland[92]
- Lone Pine Koala Sanctuary – Brisbane, Queensland[93]
- Walkabout Creek Wildlife Centre – Brisbane, Queensland[94]
- Taronga Zoo – Sydney, Nowa Południowa Walia[95]
- Sydney Aquarium – Sydney, Nowa Południowa Walia[96]
- Healesville Sanctuary – w pobliżu Melbourne, Wiktoria[97], gdzie dzięki staraniom przyrodnika Davida Fleaya przyszły na świat pierwsze urodzone w niewoli dziobaki w 1943[89]
- Warrawong Sanctuary – w pobliżu Adelaide, w Nowej Południowej Walii.
Od 2013 dziobaki nie są utrzymywane w niewoli poza Australią. W latach 1922, 1947 i 1958 podejmowano próby przeniesienia tych zwierząt do Bronx Zoo, jednak tylko dwa z trzech introdukowanych tam zwierząt w 1947 żyły dłużej niż osiemnaście miesięcy[98].
W kulturze
Dziobak został przedstawiony w legendach opisujących czas snu australijskich Aborygenów, którzy wierzyli, że zwierzę było hybrydą kaczki i bobroszczura złotobrzuchego[99]. Zgodnie z jedną z opowieści, główne grupy zwierząt – zwierzęta lądowe, zwierzęta wodne i ptaki – rywalizowały ze sobą, by dziobak przyłączył się do jednej z nich, ale ten ostatecznie zdecydował się nie dołączyć do żadnej z nich, czując, że nie musi być częścią żadnej grupy, aby być wyjątkowym[100].
Stekowiec kilka razy służył jako maskotka. Dziobak o imieniu „Syd” był jedną z trzech (obok kolczatki i kukabury) maskotek wybranych na Igrzyska Olimpijskie w Sydney w 2000[101]. Dziobak „Expo Oz” stanowił maskotkę World Expo ’88, zorganizowanej w Brisbane[102], a dziobak Hexley to z kolei maskotka systemu operacyjnego Darwin, Mac OS X firmy Apple Inc.[103]. Od 1959 (z przerwą) Platypus Trophy jest nagrodą przyznawaną zwycięzcy rywalizacji w futbolu akademickim między drużynami Oregon Ducks i Oregon State Beavers[104] Stekowca przedstawiano także w piosenkach, np. „Platypus (I Hate You)” zespołu Green Day i „Platypus” zespołu Mr. Bungle. Zwierzę stanowi też temat wiersza dla dzieci autorstwa Banjo Patersona[105], a także regularnie pojawia się w programach telewizyjnych dla dzieci, jak Rodzina Dziobaków w Mister Rogers’ Neighborhood, Pepe Pan Dziobak w Fineaszu i Ferbie lub Owidiusz z kreskówki Banda Owidiusza[106].
Od wprowadzenia systemu dziesiętnego w Australii w 1966 wyryty wizerunek dziobaka pojawił się na rewersie monety o nominale 20 centów[107].
Nowoczesny pociąg Alstom Pendolino potocznie jest nazywany „dziobakiem” z uwagi na kształt przedniej części[108].
Uwagi
- ↑ Młodszy homonim Platypus Herbst, 1793 (Coleoptera).
- ↑ a b Nieuzasadniona poprawka Ornithorhynchus Blumenbach, 1800.
- ↑ a b c d e Niepoprawna późniejsza pisownia Ornithorhynchus Blumenbach, 1800.
- ↑ Niepoprawna późniejsza pisownia Ornithorhynchus paradoxus Blumenbach, 1800.
- ↑ Nazwa zwyczajowa dziobak używana jest również w odniesieniu do rodzaju.
Przypisy
- ↑ Ornithorhynchus anatinus, [w:] Integrated Taxonomic Information System (ang.).
- ↑ a b J.F. Blumenbach. Über das Schnabelthier (Ornithorhynchus paradoxus) ein neuentdecktes Geschlecht von Säugthieren des fünften Welttheils. „Magazin für das Neueste aus der Physik und Naturgeschichte”. 2, s. 205, 1800. (ang.).
- ↑ a b G. Shaw: The naturalist’s miscellany, or Coloured figures of natural objects. Cz. 10. London: Nodder & Co., 1799, s. tekst pod ryc. 385 i 386. (ang.).
- ↑ Ch.R.W. Wiedemann. Nachricht von einem äusserst fonderbaren, neu entdeckten säugethiere: Platypus anatinus. „Archiv für Zoologie und Zootomie”. 1, s. 180, 1800. (niem.).
- ↑ F. Artaud de Soulange: Manuel d’histoire naturelle, traduit de l’allemand, de J. Fr. Blumenbach, professeur à l’université de Gottingue. T. 1. Collignon; Levrault, Henriches, Lenormant: Metz; Paris, 1803, s. 162. (fr.).
- ↑ A.M.C. Duméril: Zoologie analytique, ou, Méthode naturelle de classification des animaux: rendue plus facile a l'aide de tableaux synoptiques. Paris: Allais, libraire, 1806, s. 20. (fr.).
- ↑ a b c F.A. Péron & C.A. Lesueur: Voyage de découvertes aux terres australes: exécuté par ordre de Sa Majesté l’empereur et roi, sur les corvettes le Géographe, le Naturaliste, et la goëlette le Casuarina, pendent les années 1800, 1801, 1802, 1803 et 1804. Cz. 1: Atlas. Paryż: De l'Imprimerie impériale, 1816, s. ryc. xxxiv. (fr.).
- ↑ F. Tiedemann: Zoologie: zu seinen Vorlesungen entworfen. Allgemeine Zoologie, Mensch und Säugthiere. Landshut: In der Weberichen Buchhandlung, 1804, s. 585. (niem.).
- ↑ G. Perry: Arcana, or, The museum of natural history: containing the most recent discovered objects: embellished with coloured plates, and corresponding descriptions: with extracts relating to animals, and remarks of celebrated travellers; combining a general survey of nature. London: Printed by George Smeeton for James Stratford, 1811, s. sygn. F5. (ang.).
- ↑ a b J.F. Meckel: Ornithorhynchi paradoxi descriptio anatomica. Lipsiae: Gerhardum Fleischerum, 1826, s. 1. (łac.).
- ↑ Macgillivray 1827 ↓, s. 127.
- ↑ B.G. de Lacépède: Nouvelle table méthodique de la classe des mammifères. W: Séances des Écoles Normales, recueillies par des sténographes, et revues par les professeurs. Wyd. Nouv. édn. T. 8. Paris: A l’Imprimerie du Cercle-Social, 1800, s. 78. (fr.).
- ↑ Macgillivray 1827 ↓, s. 128.
- ↑ Macgillivray 1827 ↓, s. 132.
- ↑ W. ogilby. On two new species of Mammalia from New Holland. „Proceedings of the Committee of Science and Correspondence of the Zoological Society of London”. 1, s. 150, 1832. (ang.).
- ↑ Ch.W. De Vis. „The Daily Observer”. 549 (2), s. 2, kol. 6, 1885. (ang.).
- ↑ Thomas 1923 ↓, s. 176.
- ↑ Thomas 1923 ↓, s. 178.
- ↑ a b c J. Woinarski, A.A. Burbidge, Ornithorhynchus anatinus, [w:] The IUCN Red List of Threatened Species 2015, wersja 2015.1 [dostęp 2015-06-20] (ang.).
- ↑ a b Włodzimierz Cichocki, Agnieszka Ważna, Jan Cichocki, Ewa Rajska, Artur Jasiński, Wiesław Bogdanowicz: Polskie nazewnictwo ssaków świata. Warszawa: Muzeum i Instytut Zoologii Polskiej Akademii Nauk, 2015, s. 297. ISBN 978-83-88147-15-9.
- ↑ K. Kowalski (redaktor naukowy), A. Krzanowski, H. Kubiak, G. Rzebik-Kowalska, L. Sych: Ssaki. Wyd. IV. Warszawa: Wiedza Powszechna, 1991, s. 58, seria: Mały słownik zoologiczny. ISBN 83-214-0637-8.
- ↑ Government of New South Wales: NSW State Flag & Emblems. 2014. [dostęp 2014-07-09]. (ang.).
- ↑ a b c d e f g h i j k l m n Brian K. Hall. The Paradoxical Platypus. „BioScience”. 49 (3), s. 211–218, 1999-03. American Institute of Biological Sciences. DOI: 10.2307/1313511. (ang.).
- ↑ a b Duck-billed Platypus. Museum of hoaxes. [dostęp 2014-01-19]. (ang.).
- ↑ a b c d e f g Platypus facts file. Australian Platypus Conservancy. [dostęp 2006-09-13].
- ↑ Greek-English Lexicon, Abridged Edition. Oxford University Press, Oxford, UK, 1980. ISBN 0-19-910207-4.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an 16: Ornithorhynchidae, [w:] T.R. Grant, Fauna of Australia, t. 1B Mammalia, Australian Biological Resources Study (ABRS) [dostęp 2014-01-19] [zarchiwizowane z adresu 2013-12-03] (ang.).
- ↑ Platypus Paradoxes. National Library of Australia, 2001-08. [dostęp 2006-09-14].
- ↑ a b Erazm Majewski: Słownik nazwisk zoologicznych i botanicznych polskich. T. II. Warszawa: Nakładem autora, 1894, s. 545.
- ↑ Franciszek Kuberski: Krótki rys historyi naturalney. Lublin: Stanisław Streibl, 1831-06-03, s. 15.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x Wesley C. Warren, LaDeana W. Hillier, Jennifer A.M. Graves, Ewan Birney, Chris P. Ponting, Frank Grützner, Katherine Belov, Webb Miller, Laura Clarke,. Genome analysis of the platypus reveals unique signatures of evolution. „Nature”. 453 (7192), s. 175–183, 2008-05-08. DOI: 10.1038/nature06936. PMID: 18464734.
- ↑ Christie Wilcox: A blue-green glow adds to platypuses’ long list of bizarre features. sciencenews.org, 2020. [dostęp 2020-11-08].
- ↑ Tasmanian Devil. W: The Australian Museum Complete Book of Australian Mammals. Angus & Robertson, 1983, s. 27–28. ISBN 0-207-14454-0.
- ↑ a b Sarah Munks, Stewart Nicol: Current research on the platypus, Ornithorhynchus anatinus in Tasmania: Abstracts from the 1999 ‘Tasmanian Platypus WORKSHOP’. University of Tasmania, 1999-05. [dostęp 2006-10-23]. [zarchiwizowane z tego adresu (2006-08-30)]. (ang.).
- ↑ Thermal Biology of the Platypus. Davidson College, 1999. [dostęp 2006-09-14]. [zarchiwizowane z tego adresu (2001-09-17)].
- ↑ J.M. Watson, J.A.M. Graves. Monotreme Cell-Cycles and the Evolution of Homeothermy. „Australian Journal of Zoology”. 36 (5), s. 573–584, 1988. CSIRO. DOI: 10.1071/ZO9880573.
- ↑ T.J. Dawson, T.R. Grant, D. Fanning. Standard Metabolism of Monotremes and the Evolution of Homeothermy. „Australian Journal of Zoology”. 27 (4), s. 511–515, 1979. CSIRO. DOI: 10.1071/ZO9790511.
- ↑ a b c d e f g Philip Bethge: Energetics and foraging behaviour of the platypus. University of Tasmania, 2002-04. [dostęp 2009-06-218]. (ang.).
- ↑ Fish FE, Frappell PB, Baudinette RV, MacFarlane PM. Energetics of terrestrial locomotion of the platypus Ornithorhynchus anatinus. „The Journal of Experimental Biology”. 204 (4), s. 797–803, 2001. [dostęp 2014-01-19]. (ang.).
- ↑ a b c d e f g h i j k l Stephen J. O’Brien. The Platypus Genome Unraveled. „Cell”. 133 (6). s. 953–955. DOI: 10.1016/j.cell.2008.05.038. (ang.).
- ↑ Monotremata and Marsupialia. W: Peter S. Ungar: Mammal Teeth: Origin, Evolution, and Diversity. The Johns Hopkins University Press, 2010, s. 130. ISBN 0-80-189668-1.
- ↑ George Gaylord Simpson. The dentition of Ornithorhynchus as evidence of its affinities. „American Museum Novitates”. 390, s. 1–15, 1929. (ang.).
- ↑ H.L.H.H. Green. The Development and Morphology of the Teeth of Ornithorhynchus. „Philosophical Transactions of the Royal Society B: Biological Sciences”. 228 (555), s. 367–420, 1937. DOI: 10.1098/rstb.1937.0015. (ang.).
- ↑ Platypus (Ornithorhynchus anatinus). Australian Fauna. [dostęp 2014-01-19]. [zarchiwizowane z tego adresu (2005-07-24)]. (ang.).
- ↑ Platypus venom linked to pain relief. sydney.edu.au, 2008-05-08. [dostęp 2010-05-14]. (ang.).
- ↑ Platypus poison. Rainforest Australia. [dostęp 2014-01-19]. [zarchiwizowane z tego adresu (2017-02-15)]. (ang.).
- ↑ a b c d e Vivienne Baillie Gerritsen. Platypus poison. „Protein Spotlight”, 2002-12. [dostęp 2006-09-14]. (ang.).
- ↑ Anya Weimann: Evolution of platypus venom revealed. Cosmos Magazine, 2007-07-04. [dostęp 2014-01-19]. [zarchiwizowane z tego adresu (2014-07-14)]. (ang.).
- ↑ G.M. de Plater, P.J. Milburn, R.L. Martin. Venom From the Platypus, Ornithorhynchus anatinus, Induces a Calcium-Dependent Current in Cultured Dorsal Root Ganglion Cells. „Journal of Neurophysiology”. 85 (3), s. 1340–1345, 2001-03-01. American Physiological Society. PMID: 11248005. [zarchiwizowane z adresu 2016-08-13]. (ang.).
- ↑ a b c John D. Pettigrew. Electroreception in Monotremes. „The Journal of Experimental Biology”, s. 1447–1454, 1999. [dostęp 2014-01-19]. (ang.).
- ↑ a b John D. Pettigrew, P.R. Manger, S.L.B. Fine. The sensory world of the platypus. „Philosophical Transactions of the Royal Society of London”. 353 (353), s. 1199–1210, 1998. DOI: 10.1098/rstb.1998.0276. PMID: 9720115. [dostęp 2014-01-19]. (ang.).
- ↑ The Duckbill’s Tale. W: Richard Dawkins: The Ancestor’s Tale, A Pilgrimage to the Dawn of Life. Boston: Houghton Mifflin Company, 2004. ISBN 0-618-00583-8. (ang.).
- ↑ Nature Podcast – transcript of the 8th May edition of the weekly Nature Podcast. Nature, 2008-05-08. [dostęp 2009-05-31].
- ↑ J.E. Gregory, A. Iggo, A.K. McIntyre, U. Proske. Receptors in the Bill of the Platypus. „The Journal of Physiology”. 400, s. 349–366, 1988-06. [dostęp 2014-01-19]. (ang.).
- ↑ Manning, A, Dawkins, M.S.: An Introduction to Animal Behaviour Fifth Edition. Cambridge University Press, 1998. (ang.).
- ↑ C. Zeiss, I.R. Schwab, C.J. Murphy, R.W. Dubielzig. Comparative retinal morphology of the platypus. „Journal of Morphology”. 272 (8), s. 949–957, sierpień 2011. DOI: 10.1002/jmor.10959. PMID: 21567446.
- ↑ Platypus in Tasmania. Department of Primary Industries and Water, Tasmania, 2006-08-31. [dostęp 2006-10-12]. [zarchiwizowane z tego adresu (2017-02-08)].
- ↑ Research on Kangaroo Island. University of Adelaide, 2006-07-04. [dostęp 2006-10-23]. (ang.).
- ↑ a b Anthony Scott, Tom Grant: Impacts of water management in the Murray-Darling Basin on the platypus (Ornithorhynchus anatinus) and the water rat (Hydromus chrysogaster). CSIRO Australia, 1997-11. [dostęp 2006-10-23]. [zarchiwizowane z tego adresu (2016-03-15)]. (ang.).
- ↑ Platypus in Country Areas. Australian Platypus Conservancy. [dostęp 2006-10-23]. [zarchiwizowane z tego adresu (2016-09-17)].
- ↑ a b Platypus. Environmental Protection Agency/Queensland Parks and Wildlife Service, 2006. [dostęp 2009-07-24]. (ang.).
- ↑ a b c T.G. Grant, P.D. Temple-Smith. Field Biology of the Platypus (Ornithorhynchus Anatinus): Historical and Current Perspectives. „Philosophical Transactions: Biological Sciences”. 353 (1372), s. 1081–1091, 1998-07-29. The Royal Society. DOI: 10.1098/rstb.1998.0267. PMID: 9720106. [dostęp 2014-01-19]. (ang.).
- ↑ J.L. Gardner, M. Serena. Spatial-Organization and Movement Patterns of Adult Male Platypus, Ornithorhynchus-Anatinus (Monotremata, Ornithorhynchidae). „Australian Journal of Zoology”. 43 (1), s. 91–103, 1995. CSIRO. DOI: 10.1071/ZO9950091.
- ↑ a b c Platypus Ornithorhynchus anatinus. Parks and Wildlife Service Tasmania, 2008-02. [dostęp 2009-06-18]. [zarchiwizowane z tego adresu]. (ang.).
- ↑ F.E. Fish, R.V. Baudinette, P.B. Frappell, M.P. Sarre. Energetics of Swimming by the Platypus Ornithorhynchus Anatinus: Metabolic Effort Associated with Rowing. „The Journal of Experimental Biology”. 200 (20), s. 2647–2652, 1997-07-28. The Company of Biologists Limited. [dostęp 2014-01-19]. (ang.).
- ↑ H. Kruuk. The Diving Behaviour of the Platypus (Ornithorhynchus anatinus) in Waters with Different Trophic Status. „The Journal of Applied Ecology”. 30 (4), s. 592–598, 1993. DOI: 10.2307/2404239. (ang.).
- ↑ a b c d Erica Cromer: Monotreme Reproductive Biology and Behavior. Iowa State University, 2004-04-14. [dostęp 2009-06-18]. [zarchiwizowane z tego adresu (2015-05-02)]. (ang.).
- ↑ a b c d Ockhams Razor. [w:] The Puzzling Platypus [on-line]. [dostęp 2014-01-19]. (ang.).
- ↑ a b c T.R. Grant, M. Griffiths, R.M.C. Leckie. Aspects of Lactation in the Platypus, Ornithorhynchus anatinus (Monotremata), in Waters of Eastern New South Wales. „Australian Journal of Zoology”. 31 (6), s. 881–889, 1983. 1983. DOI: 10.1071/ZO9830881. (ang.).
- ↑ Anna Bess Sorin, Phil Myers: Family Ornithorhynchidae (platypus). University of Michigan Museum of Zoology, 2001. [dostęp 2006-10-24]. (ang.).
- ↑ a b c Lauren Bucchino, Using geometric probability to compare the random and actual mating success of the Platypus, ''Ornithorhynchus anatinus'' [online], 2013 [dostęp 2014-07-02] [zarchiwizowane z adresu 2014-07-14] (ang.).
- ↑ a b R.L. Hughes, L.S. Hall. Early development and embryology of the platypus. „Philosophical Transactions of the Royal Society B: Biological Sciences”. 353 (1372), s. 1101–1114, 1998-07-29. The Royal Society. DOI: 10.1098/rstb.1998.0269. PMID: 9720108. (ang.).
- ↑ Paul R. Manger, Leslie S. Hall, John D. Pettigrew. The Development of the External Features of the Platypus (Ornithorhynchus Anatinus). „Philosophical Transactions: Biological Sciences”. 353 (1372), s. 1115–1125, 1998-07-29. The Royal Society. DOI: 10.1098/rstb.1998.0270. PMID: 9720109. (ang.).
- ↑ a b c d Platypus. Departament of Environment and Heritage Protection, 19 września 2011. [dostęp 2014-01-19]. (ang.).
- ↑ a b c Egg-laying mammals. Queensland Museum, 2000-11. [dostęp 2014-01-19]. (ang.).
- ↑ Ross Piper: Extraordinary Animals: An Encyclopedia of Curious and Unusual Animals. Westport, Connecticut: Greenwood Press, 2007. ISBN 0-313-33922-8. (ang.).
- ↑ a b c John A.W. Kirsch, Gregory C. Mayer. The Platypus is not a Rodent: DNA Hybridization, Amniote Phylogeny and the Palimpsest Theory. „Philosophical Transactions: Biological Sciences”. 353 (1372), s. 1221–1237, 1998-07-29. DOI: 10.1098/rstb.1998.0278. PMID: 9720117. (ang.).
- ↑ a b O.W.M. Rauhut, T. Martin, E. Ortiz-Jaureguizar, P. Puerta: The first Jurassic mammal from South America. Nature, 2001-12-11. [dostęp 2006-10-24]. [zarchiwizowane z tego adresu (2006-11-03)]. (ang.).
- ↑ M. Messer, A.S. Weiss, D.C. Shaw, M. Westerman. Evolution of the Monotremes: Phylogenetic Relationship to Marsupials and Eutherians, and Estimation of Divergence Dates Based on α-Lactalbumin Amino Acid Sequences. „Journal of Mammalian Evolution”. 5 (1), s. 95–105, 1998-03. Springer Netherlands. DOI: 10.1023/A:1020523120739. (ang.).
- ↑ Matthew J. Phillips, Thomas H. Bennett, Michael S.Y. Lee, Molecules, morphology, and ecology indicate a recent, amphibious ancestry for echidnas, „Proceedings of the National Academy of Sciences of the United States of America”, 106 (40), 2009, s. 17089–17094, DOI: 10.1073/pnas.0904649106, ISSN 0027-8424, PMID: 19805098, PMCID: PMC2761324 (ang.).
- ↑ Guillaume Lecointre, Hervé Le Guyader: The Tree of Life: A Phylogenetic Classification. Cambridge; London: The Belknap Press of Harvard University Press, 2006. ISBN 0-674-02183-5. (ang.).
- ↑ a b Rosendo Pascual, Francisco J. Goin, Lucía Balarino, Daniel E. Udrizar Sauthier. New data on the Paleocene monotreme Monotrematum sudamericanum, and the convergent evolution of triangulate molars. „Acta Palaeontologica Polonica”. 47 (3), s. 487–492, 2002. (ang.).
- ↑ Tim Folger. A platypus in Patagonia–Ancient life. „Discover Magazine”. 14(1), s. 66, 1993-01. (ang.).
- ↑ Jocelyn Selim: Sex, Ys, and Platypuses. Discover, 2005-04-25. [dostęp 2008-05-07]. (ang.).
- ↑ F. Grützner, W. Rens, E. Tsend-Ayush, N. El-Mogharbel i inni. In the platypus a meiotic chain of ten sex chromosomes shares genes with the bird Z and mammal X chromosomes.. „Nature”. 432 (7019), s. 913–7, grudzień 2004. DOI: 10.1038/nature03021. PMID: 15502814. (ang.).
- ↑ Wes Warren: Genome: Ornithorhynchus anatinus. Genome Institute of Washington University. [dostęp 2014-01-19]. [zarchiwizowane z tego adresu (2018-04-08)].
- ↑ Platypus Fungal Disease – Mucormycosis. Department of Primary Industries and Water, Tasmania, 2008-08-29. [dostęp 2008-02-29]. [zarchiwizowane z tego adresu (2017-05-01)].
- ↑ DPIW – Foxes in Tasmania. dpiw.tas.gov.au, 2010-05-03. [dostęp 2010-05-14]. [zarchiwizowane z tego adresu (2009-12-03)].
- ↑ a b Fantastic Fleay turns 20!. Zoos Victoria, 2013-10-31. [dostęp 2014-02-04]. [zarchiwizowane z tego adresu (2018-11-09)]. (ang.).
- ↑ David Fleay’s achievements. Queensland Government, 2003-11-23. [dostęp 2006-09-13]. [zarchiwizowane z tego adresu (2006-10-02)].
- ↑ Platypus. Catalyst, 2003-11-13. [dostęp 2006-09-13].
- ↑ David Fleay Wildlife Park. Department of National Parks, Recreation, Sport and Racing. [dostęp 2014-02-04]. (ang.).
- ↑ Lone Pine Koala Sanctuary. koala.net. [dostęp 2014-02-04]. (ang.).
- ↑ Walkabout Creek. Department of National Parks, Recreation, Sport and Racing. [dostęp 2014-02-04]. [zarchiwizowane z tego adresu (2015-06-28)]. (ang.).
- ↑ Platypus’ hidden world. Toronga Conservation Society Australia. [dostęp 2014-02-04]. [zarchiwizowane z tego adresu (2014-02-21)]. (ang.).
- ↑ Streams and Billabongs: Platypus. Sydney Aquarium. [dostęp 2014-02-04]. [zarchiwizowane z tego adresu (2016-04-04)]. (ang.).
- ↑ Platypus. Zoos Victoria. [dostęp 2014-02-04]. [zarchiwizowane z tego adresu (2012-10-04)]. (ang.).
- ↑ Lee S. Crandall, The Management of Wild Mammals in Captivity. University of Chicago Press, 1964.
- ↑ McKay i in. 2001 ↓, s. 57–60.
- ↑ McKay i in. 2001 ↓, s. 83–85.
- ↑ A Brief History of the Olympic and Paralympic Mascots. Bejing 2008, 2004-08-05. [dostęp 2014-02-04]. [zarchiwizowane z tego adresu (2012-07-22)].
- ↑ About World Expo ’88. Foundation Expo ’88, 1988. [dostęp 2014-02-04]. [zarchiwizowane z tego adresu (2013-11-16)].
- ↑ The Home of Hexley the Platypus. [dostęp 2014-02-04].
- ↑ Mark Baker: Trophy fits the bill. [w:] The Register-Guard [on-line]. 2007-11-28. [dostęp 2014-02-04].
- ↑ Banjo Paterson: Old Man Platypus. [w:] The Animals Noah Forgot [on-line]. Endeavour Press, 1933. [dostęp 2014-02-04].
- ↑ Ovide and the Gang. IMDb. [dostęp 2014-02-04].
- ↑ twenty cents. Royal Australian Mint. [dostęp 2014-02-05]. (ang.).
- ↑ Cezary Kowanda: Dziobaki poszły w las: Jak zapełnić Pendolino?. polityka.pl, 9.12.2014. [dostęp 2014-12-30].
Bibliografia
- W. Macgillivray. Description of a new species of Ornithorhynchus. „Memoirs of the Wernerian Natural History Society”. 6, s. 127–132, 1827. (ang.).
- O. Thomas. The Godman Exploration Fund: List of mammals from North Queensland collected by Mr. T. V. Sherrin. „The Annals and Magazine of Natural History”. Ninth series. 11 (61), s. 170–178, 1923. (ang.).
- Augee, Michael L. Platypus. World Book Encyclopedia. 2001 ed.
- Harry Burrell, The Platypus, Adelaide: Rigby, 1974, ISBN 0-85179-521-8, OCLC 1920094.
- Fleay, David H. Paradoxical Platypus: Hobnobbing with Duckbills. Jacaranda Press, 1980. ISBN 0-7016-1364-5.
- Tom Grant, The platypus: a unique mammal, Dominic Fanning, wyd. Rev. ed. 1995, Sydney: Uniwersytet Nowej Południowej Walii Press, 1995, ISBN 0-86840-143-9, OCLC 33842474.
- Griffiths, Mervyn. The Biology of the Monotremes. Academic Press, 1978.
- Hutch, Michael and McDade, Melissa C., eds. Grzimek’s Animal Life Encyclopedia; Volume 12. Detroit: Gale, 2004.
- Marshall, Ben „The Amazing Duckbilled Platypus” New York Publishers Inc. 2002 ed.
- Helen F. McKay, Pauline E. McLeod, Francis F. Jones, June E. Barber: Gadi Mirrabooka: Australian Aboriginal Tales from the Dreaming. Libraries Unlimited, 2001. ISBN 1-56308-923-8. (ang.).
- Moyal, Ann. Platypus: The Extraordinary Story of How a Curious Creature Baffled the World. Smithsonian Books, 2001. ISBN 1-56098-977-7.
- Strahan, R. The Mammals of Australia. New South Wales: Reed Books, 1995.
- Eye of the Storm. Documentary by the Australian Broadcasting Corporation.
