Bakterie
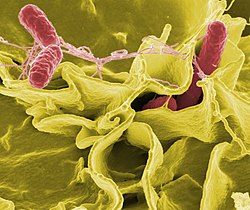
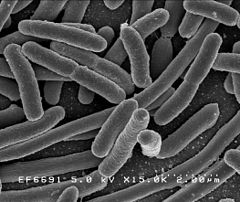 Pałeczka okrężnicy (Escherichia coli) | |||
| Systematyka | |||
| Domena |
bakterie | ||
|---|---|---|---|
| Nazwa systematyczna | |||
| Bacteria Woese, Kandler i Wheelis, 1990[1] | |||
| Synonimy | |||
|
| |||

Bakterie (łac. bacteria, od gr. βακτήριον baktērion „pałeczka, laseczka”) – grupa mikroorganizmów, stanowiących osobną domenę. Są to najczęściej jednokomórkowce (choć istnieją też prymitywne formy wielokomórkowe[5]), często tworzą kolonie i mają budowę prokariotyczną. Badaniem bakterii zajmuje się bakteriologia.
Cechą charakterystyczną budowy komórek bakteryjnych jest brak otoczonych błoną organelli, takich jak jądro komórkowe czy mitochondrium, które występują u wszystkich innych organizmów żywych – grzybów, roślin, protistów i zwierząt. Wielkość komórek bakterii mieści się w zakresie od 0,175 μm u Mycoplasma do 750 μm u Thiomargarita namibiensis[6]. Mogą mieć różne kształty, np. kulisty, pałeczkowaty lub spiralny. Niektóre bakterie potrafią łączyć się ze sobą, tworząc luźne, charakterystyczne układy przestrzenne (np. pakietowce, paciorkowce, trychomy).
Bakterie występują we wszystkich biotopach. Można je spotkać w glebie, w innych organizmach i w wodzie, na lodowcach Antarktydy i wokół oceanicznych kominów hydrotermalnych. Występują także na terenach radioaktywnych, co udowodnił eksperyment, w czasie którego bakterie poddawano działaniu promieniowania jonizującego[7]. W jednym gramie gleby można znaleźć nawet 40 milionów komórek tych organizmów, a około milion w mililitrze wody słodkiej. Na Ziemi jest w przybliżeniu pięć kwintylionów (5x1030) bakterii, które stanowią znaczną część biomasy planety[8].
Dotąd nie udało się opisać wszystkich bakterii. Przyczyną jest ogromna różnorodność tej grupy organizmów, ich małe rozmiary oraz problem z przetrzymywaniem w laboratoriach – gatunki z około połowy gromad nie mogą być hodowane[9].
Pod względem sposobu odżywiania się, można je podzielić na heterotrofy i autotrofy, a także symbionty, komensale i pasożyty. Niejednokrotnie stawały się endosymbiontami.
Bakterie odgrywają ważną rolę w obiegu biogennych pierwiastków (są destruentami). Biorą udział w podtrzymywaniu wszystkich cykli biogeochemicznych (np. obiegu azotu) oraz w procesach fermentacji i gnicia. Jako symbionty żyjące w organizmach zwierząt, w tym ludzi, odpowiadają m.in. za trawienie pokarmów, umożliwiając lub przynajmniej ułatwiając w ten sposób ich odżywianie. Są producentami różnych ważnych dla funkcjonowania ekosystemu substancji, np. niektórych witamin dla konsumentów. Niektóre bakterie mogą zakłócać funkcjonowanie organizmów, powodując u nich choroby. W przemyśle i biotechnologii bakterie są niezwykle cenione, w tym przy biologicznym oczyszczaniu ścieków (jako główny element osadu czynnego) oraz przy wytwarzaniu produktów spożywczych, np. jogurtu i sera. Stosunkowo łatwo poddają się manipulacjom genetycznym, dzięki czemu mogą być wykorzystywane w przemyśle farmaceutycznym do produkcji peptydów i białek, które trudno uzyskać z innych źródeł. Modyfikowane genetycznie bakterie są producentami, między innymi, insuliny (stosowanej jako lek w terapii cukrzycy).
Historia bakteriologii

Pierwsza obserwacja bakterii
Bakterie zostały po raz pierwszy zauważone w 1686 roku przez przyrodnika i przedsiębiorcę Antoniego van Leeuwenhoeka, który obserwował je używając własnoręcznie wykonanego jednoobiektywowego mikroskopu[10]. Nazwał je „animalcules” („żyjątka”) i opublikował w serii listów do Royal Society[11].
Nazwa „bakterie” ⟨od gr. baktērion (βακτηριον) ‘pałeczka’⟩ została wprowadzona znacznie później – w 1838 r. – przez Christiana Gottfrieda Ehrenberga[12].
Odkrycie patogenności bakterii
Louis Pasteur w 1859 wykazał, że proces fermentacji jest spowodowany przez wzrost mikroorganizmów, między innymi bakterii (oprócz nich za proces są odpowiedzialne drożdże i pleśnie, które nie są bakteriami, a grzybami). Wraz z Robertem Kochem Pasteur od samego początku był zwolennikiem teorii wywoływania chorób przez bakterie[13]. Robert Koch był pionierem w zakresie mikrobiologii medycznej. Pracował nad cholerą, gruźlicą i wąglikiem. W badaniach nad prątkami gruźlicy, Koch ostatecznie potwierdził swoją teorię dotyczącą rozwoju chorób bakteryjnych, za które przyznano mu Nagrodę Nobla w 1905[14]. Stworzył też szereg zasad zwanych postulatami Kocha, za pomocą których można stwierdzić, czy dana bakteria jest patogenem[15].
Pierwszy lek przeciwbakteryjny
Chociaż istnienie bakterii chorobotwórczych było już pewne w XIX wieku, nie było skutecznych lekarstw do walki z nimi[16]. Paul Ehrlich opracował pierwszy lek, który nadawał się do zwalczania krętków bladych (Treponema pallidum) wywołujących kiłę, wprowadzony do obrotu w roku 1910 jako salwarsan[17][18]. Ehrlich był pionierem immunologii w wykorzystywaniu barwników do walki z bakteriami. Jego prace były podstawą do rozszerzania wiedzy o bakteriach i doprowadziły do stworzenia metody barwienia Grama, zostały też nagrodzone Nagrodą Nobla w roku 1908[19].
Wyodrębnienie archeonów
W 1977 roku zostało stwierdzone przez Carla Woese na podstawie badań sekwencji 16S rRNA, że archeony stanowią odrębną linię ewolucyjną i są (filogenetycznie) podobnie bliskie bakteriom właściwym jak eukariontom, w związku z czym nadał każdej z tych trzech grup nowo utworzoną kategorię urkrólestwa, a w 1990 r. przemianował je na domeny i uznał pokrewieństwo archeonów z organizmami jądrowymi za bliższe niż z bakteriami[2][1]. Jego podział został potwierdzony przez wiele późniejszych badań[20][21], jednakże wciąż jest kwestionowany przez niektórych naukowców; można wyróżnić kilka powodów jego krytyki:
- parafiletyzm archeonów będących – według wielu badań – bezpośrednimi przodkami eukariontów, a nie ich grupą siostrzaną (parafiletyzm nie jest dopuszczany w klasyfikacjach kladystycznych)[22][23],
- wyższa (w systematyce ewolucyjnej) waga podobieństwa morfologicznego (w tym kontekście dotyczącego cech homologicznych) niż monofiletyzmu grup w klasyfikacji, w związku z którą archeony należałoby zaliczyć do parafiletycznej grupy prokariontów[24],
- parafiletyzm bakterii będących – według niektórych badań – przodkami zarówno archeonów, jak i eukariontów[25][26][27][28].
Odkrycie wielokomórkowości obligatoryjnej
Chociaż wykształcenie się wielokomórkowości jest istotnym krokiem na drodze ewolucji, proces przejścia organizmów jednokomórkowych w wielokomórkowe był przez długi czas przedmiotem badań jedynie u jądrowców; choć bakterie często tworzą kolonie, które można uznać za organizmy wielokomórkowe, wielokomórkowość obligatoryjna nie była u nich znana. Dopiero w 1990 r. zostały opublikowane badania magnetotaktycznych ściśle ze sobą połączonych i współpracujących, tworzących organizm o stałym kształcie oraz nigdy nie występujących samodzielnie[29][30]. W 2007 roku opisano gatunek Candidatus Magnetoglobus multicellularis i stwierdzono na podstawie badań filogenetycznych, że należy on do deltaproteobakterii[31].
Morfologia

Bakterie charakteryzuje duża różnorodność kształtów i wielkości. Ich długość mieści się zazwyczaj w granicach od 1 do 10 mikrometrów – ok. 10 razy mniej niż u typowej komórki eukariotycznej[32][33]. Największa znana bakteria – Thiomargarita magnifica osiąga długość około 2 cm[34], inne, m.in. Thiomargarita namibiensis i Epulopiscium fishelsoni (występujący wyłącznie w przewodzie pokarmowym ryb z gatunku Acanthurus nigrofuscus[35]) – mogą dorastać nawet do 750 µm i są widoczne gołym okiem[36]; do najmniejszych bakterii należą te z rodzaju Mycoplasma które, osiągając nie więcej niż 300 nm średnicy (zazwyczaj jest to ok. 175 nm), nie przekraczają wielkością dużych wirusów[37][38], Niektóre bakterie mogą być jeszcze mniejsze, ale ultramikrobakterie nie zostały na razie dokładnie zbadane[39].
Bakterie o kształcie kulistym – ziarenkowce (łac. coccus, z gr. kókkos, czyli ziarno, nasiono) – stanowią większość. Częsty jest też kształt pałeczki (łac. baculus, drążek). Niektóre bakterie o podłużnym kształcie są lekko wygięte w kształcie przecinka, dlatego nazywane są przecinkowcami (łac. vibrio). Inne mogą być w kształcie spirali – śrubowce (łac. spirilla) – lub ściśle zwiniętych sprężynek – krętki (łac. spirochetae). Niewiele gatunków ma inne, specyficzne kształty[40]. Różnorodność kształtów zależna jest od występowania i rodzaju ściany komórkowej bakterii oraz jej cytoszkieletu. Może ona wpłynąć na zdolność bakterii do zdobywania składników odżywczych, przemieszczania się w cieczach i ucieczki przed drapieżnikami oraz na możliwości czepne powierzchni komórki[41].
Wiele bakterii występuje jako pojedyncze komórki. Inne grupują się, tworząc skomplikowane formy. Bakterie z rodzaju Neisseria tworzą pary, Streptococcus przyjmują postać łańcuszków, a Staphylococcus grupują się w formy przypominające kiście winogron. Niektóre komórki są znacznie wydłużone i tworzą włókna, na przykład Actinobacteria. Bakterie Nocardia tworzą specyficzne układy, podobne do strzępków grzybni[42]. Również sinice przyjmują różne typy kolonii nitkowatych lub groniastych.
Możliwości rozwoju i kształty, jakie przybierają bakterie, najlepiej da się zauważyć przy ich hodowli na pożywkach. Skupiska bakterii, będących potomstwem jednej komórki macierzystej, nazywane są koloniami bakteryjnymi. Pojęcie to jednak nie jest tożsame z pojęciem kolonii używanym w innych dziedzinach biologii, gdzie zwykle oznacza ono skupisko osobników związanych ekologicznie i fizjologicznie, nierzadko o skomplikowanej strukturze powiązań i podziale funkcji. Kolonia bakteryjna jest po prostu wynikiem namnażania bakterii na dogodnym podłożu. Gdy mikroorganizmy trafią na odpowiednie warunki, mogą stworzyć kolonie o wielkości od kilku mikrometrów do pół metra wielkości. Duże kolonie składają się z różnorodnych grup bakterii, protistów i archeonów[42][43]. Typ wzrostu na pożywkach stałych i płynnych, oraz wygląd i zapach kolonii, często jest charakterystyczny dla danego gatunku. Niejednokrotnie kolonie bakteryjne wiążą się z podłożem, tworząc warstwy o grubości od kilku mikrometrów do ponad pół metra. Są one zwane matami bakteryjnymi lub biofilmami. Biofilmy mają, między innymi, istotne znaczenie w medycynie. Pojawiają się bowiem często w trakcie przewlekłych infekcji bakteryjnych albo na wszczepianych implantach medycznych. Bakterie występujące w formie biofilmu są przez niego chronione i z tego powodu znacznie trudniej je zabić[44].
Możliwe jest również tworzenie przez bakterie bardziej złożonych form morfologicznych. Na przykład myksobakterie rozwijające się w środowisku ubogim w aminokwasy, lokalizują w pobliżu inne komórki i zbliżają się do nich dzięki mechanizmowi quorum sensing. Organizują się następnie w twór o długości 5000 mikrometrów (5 milimetrów), składający się w przybliżeniu z 100 tysięcy komórek bakteryjnych[45]. Poszczególne grupy komórek wykonują w nich różne złożone czynności. Na przykład około jednej dziesiątej komórek migruje w górę tej kolonii, gdzie przechodzą w stan hibernacji, przekształcając się w formy przetrwalnikowe, bardziej odporne na działanie środowiska[45]. Choć organizacja taka przypomina organizm wielokomórkowy i często jest tak traktowana, każda składająca się na nią bakteria jest w stanie żyć w pełni samodzielnie i zazwyczaj w jej cyklu życiowym występuje faza jednokomórkowa. U niektórych deltaproteobakterii (m.in. u Candidatus Magnetoglobus multicellularis), została zaobserwowana wielokomórkowość bardziej zaawansowana – komórki przez cały swój okres istnienia tworzą jeden organizm i żadna z nich nie jest w stanie przeżyć, jeżeli zostanie od niego odłączona[5][31][46]. Podział bakterii wielokomórkowych przedstawia poniższa tabelka[5][47]:
| Klasa | Charakterystyka | Przykłady | |
|---|---|---|---|
| Kolonia niestanowiąca organizmu wielokomórkowego | Komórki trzymają się blisko siebie, układają się w różne kształty; nie występuje sygnalizacja międzykomórkowa | Neisseria, Escherichia coli, Chromobacterium violaceumis | |
| Organizm wielokomórkowy | Filamenty | Komórki są klonami, są w stanie przeżyć poza filamentem, mają zazwyczaj uwspólnioną przestrzeń peryplazmatyczną, tworzą długie łańcuchy, które mogą być rozgałęzione; występuje sygnalizacja międzykomórkowa | Cyanobacteria, Actinomycetales, Chloroflexi, Desulfobulbaceae, Beggiatoa, Thioploca |
| Agregaty | Organizm wielokomórkowy powstaje na skutek połączenia się wielu samodzielnych komórek, które następnie tworzą wokół organizmu otoczkę złożoną z polisacharydów, białek oraz kwasów nukleinowych i mogą tworzyć dosyć skomplikowane struktury; występuje sygnalizacja międzykomórkowa | Pseudomonas aeruginosa, Vibrio cholerae, Bacillus subtilis, Salmonella enterica, Streptococcus mutans | |
| Wielokomórkowe magnetotaktyczne prokarionty (MMP) | Komórki nie są w stanie przeżyć samodzielnie, występują ścisłe połączenia międzykomórkowe i koordynacja ruchów poszczególnych komórek, a reprodukcja następuje poprzez podział całej struktury; występuje sygnalizacja międzykomórkowa. | Candidatus Magnetoglobus multicellularis, Ca. Magnetananas tsingtaoensis, Ca. Magnetananas rongchensis, Ca. Magnetomorum tsingtaoroseum, Ca. Magnetomorum rongchengroseum | |
Niektóre bakterie są w stanie wytwarzać endospory, nazywane czasami przetrwalnikami, które charakteryzują się znacznym stopniem odwodnienia zawartej w nich cytoplazmy, a także grubymi i wielowarstwowymi osłonami. Endospory umożliwiają bakteriom przetrwanie w niekorzystnych warunkach, a następnie powrót do normalnych funkcji życiowych, kiedy warunki zmienią się na sprzyjające. Bakterie wytwarzające przetrwalniki należą do rodzajów Bacillus i Clostridium.
Formy morfologiczne

- ziarniaki, Micrococcus
- dwoinki, Diplococcus
- czworaczki[48], Tetracoccus
- paciorkowce, Streptococcus
- gronkowce, Staphylococcus
- pakietowce, Sarcina
- pałeczki, Bacterium
- laseczki, Bacillus
- maczugowce, Corynebacterium
- przecinkowce, Vibrio
- śrubowce, Spirillum
- krętki, Spirochaeta
- promieniowce, Actinomyces
- prątki, Mycobacterium
Budowa komórki
Wszystkie bakterie mają stosunkowo prostą budowę komórkową. Nie mają jądra komórkowego, chloroplastów, mitochondriów, aparatu Golgiego[49], które są charakterystyczne dla komórek eukariotycznych. Zamiast jądra komórkowego mają jedną dużą, kolistą i nieupakowaną cząsteczkę DNA, czyli genofor, oraz niewielkie koliste cząsteczki DNA – plazmidy.
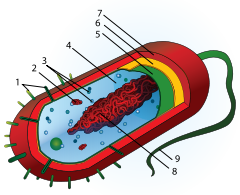
Głównymi składnikami komórek bakteryjnych są:
- cytozol – substancja koloidalna, wypełniająca wnętrze komórki,
- nukleoid – obszar cytoplazmy, w którym znajduje się nić DNA,
- otoczka – warstwa ochronna występująca u części bakterii, zwykle zbudowana ze związków cukrowych,
- ściana komórkowa, która pełni funkcję ochronną, w jej skład wchodzi mureina,
- błona komórkowa – struktura oddzielająca wnętrze komórki od świata zewnętrznego,
- rybosomy – organelle służące do produkcji białek,
- rzęski, które są wypustkami pełniącymi funkcję ruchową, nie we wszystkich typach bakterii są obecne.
Struktury śródkomórkowe
Komórki bakteryjne są otoczone przez błonę komórkową, która pełni rolę bariery, a także pozwala na utrzymywanie wewnątrz komórki różnych substancji, cytoplazmy i organelli. Dotyczy to np. białek, tłuszczów (są one materiałami zapasowymi większości bakterii) i innych składników odżywczych. Bakterie zaliczają się do prokariontów. Nie posiadają błony dzielącej poszczególne organelle (lub łączącej je) i w związku z tym wykształciły wiele dużych struktur śródkomórkowych. Przy pierwszej obserwacji mikroskopowej przypominały one „worki” wypełnione cytoplazmą. Później zauważono, że znajdują się tam pewne struktury, a sama cytoplazma stanowi hydroszkielet bakterii[50][51]. Stwierdzono także, że każde białko ma stałą lokalizację w cytoplazmie[52]. Bakterie posiadają mikrokompartmenty (mikroprzedziały), takie jak karboksysomy[53], które pełnią funkcję analogiczną do błony śródplazmatycznej u eukariontów (dzielą komórkę na kilka części). Są one otoczone polihedralną otoczką białkową[54]. To wielościenne organellum jest miejscem zachodzenia wielu reakcji składających się na metabolizm. Z czasem przekształciła się w siateczkę śródplazmatyczną u eukariontów[55][56].
Bakterie nie posiadają jądra komórkowego. Materiał genetyczny zlokalizowany jest w pojedynczych chromosomach oraz w plazmidach. Chromosom znajduje się w nieregularnym organellum komórkowym – nukleoidzie. Nukleoidy znajdują się w cytoplazmie[57] i zawierają oprócz chromosomów, różnorodne białka i RNA. Jedynie Planctomycetes są wyjątkiem od tej reguły. Jako jedyne mają one nukleoid otoczony błoną, która występuje także przy innych organellach i dzieli komórkę na kilka części[58]. Jak wszystkie żywe organizmy bakterie zawierają rybosomy służące do produkcji i przemian białek. Mają one jednak inną strukturę niż te występujące u archeonów i eukariontów[59].
Materiałami zapasowymi bakterii są różnorodne substancje, takie jak glikogen[60], polifosforan[61], siarka[62] lub polihydroksyalkaniany[63] (jak polihydroksymaślan). Magazynują je w ziarnkach, z których mogą być uwalniane w razie potrzeby. Fotosyntetyczne bakterie planktoniczne należące do Cyanobacteria wytwarzają pęcherzyki gazu, dzięki którym mogą regulować głębokość, na której się znajdują w toni wodnej, optymalizując w ten sposób warunki środowiska, co w cyklu 24-godzinnym, obserwujemy jako dobowe migracje pionowe[59].
Struktury zewnętrzne

Podstawowe elementy struktury zewnętrznej bakterii to:
- ściana komórkowa,
- wić,
- fimbrie i pilusy,
- śluz.
Komórki bakteryjne posiadają błonę komórkową. Jest ona zwykle otoczona także dodatkowym organellum – ścianą komórkową, zbudowaną z peptydoglikanu i polisacharydów. W całość, nazywaną mureiną, łączą je peptydy zawierające D-aminokwasy[65]. Z tego powodu ściana komórkowa bakterii różni się od tych, które spotyka się u grzybów (są one zbudowane z chityny) i roślin (zbudowanych z celulozy). Bakteryjna ściana komórkowa różni się także od tych, które posiadają inne prokarionty, gdyż archeony nie zawierają peptydoglikanu. Ściana komórkowa jest podstawową osłoną bakterii, zwiększającą ich odporność i umożliwiającą prawidłowe funkcjonowanie. Antybiotyki β-laktamowe zwalczają bakterie właśnie poprzez blokowanie syntezy peptydoglikanu, czym zaburzają budowę bakteryjnej ściany komórkowej[66].
Szczególną właściwością ścian jest ich przepuszczalność. Różnice w przepuszczalności ścian komórkowych różnych gatunków bakterii umożliwia ich identyfikację na podstawie barwienia metodą Grama. Używając tej metody rozróżniania, bakterie podzielono na bakterie Gram-dodatnie i bakterie Gram-ujemne. Zakwalifikowanie badanej bakterii do jednej z tych grup, ułatwia jej identyfikację[67].
Gram-dodatnie bakterie posiadają grubą ścianę komórkową zbudowaną z wielu warstw peptydoglikanu i kwasów teichoinowych. Z kolei bakterie Gram-ujemne mają stosunkowo cienką ścianę, również złożoną z kilku warstw peptydoglikanu, ale jest ona otoczona drugą błoną lipidową zawierającą lipopolisacharydy oraz lipoproteiny. Większość bakterii jest Gram-ujemna, tylko 2 typy, Firmicutes i Actinobacteria są Gram-dodatnie (dawniej nazywane odpowiednio bakteriami nisko Gram-dodatnimi i wysoko Gram-dodatnimi)[68]. Różnice w przepuszczalności ścian komórkowych mogą wpływać na skuteczność antybiotyków w walce z bakteriami, na przykład wankomycyna nadaje się do zwalczania bakterii Gram-dodatnich, ale jest nieskuteczna w walce z Gram-ujemnymi, takimi jak Haemophilus influenzae czy Pseudomonas aeruginosa (pałeczka ropy błękitnej)[69].
U wielu bakterii występuje warstwa „powierzchniowa” (S-layer), złożona ze sztywno i ciasno ułożonych cząsteczek białka, przykrywających od zewnątrz komórkę[70]. Warstwa ta chroni bakterie przed czynnikami chemicznymi i fizycznymi, a także może stanowić wielocząsteczkową barierę, zapobiegającą przenikaniu różnych substancji ze środowiska do wnętrza komórki. S-layer ma wiele funkcji, mniej lub bardziej złożonych, jednak nie wszystkie zostały w pełni poznane. Wiadomo natomiast, że warstwa ta może decydować o zjadliwości niektórych bakterii, np. z rodzaju Campylobacter lub zawierać enzymy, pełniące rozmaite funkcje (np. u Bacillus stearothermophilus)[71].
Wić u bakterii jest sztywną strukturą białkową o średnicy 20 nanometrów i długości dochodzącej do kilku mikrometrów. Istnieją bakterie, które posiadają większą ilość wici, umożliwiających szybsze wykonywanie ruchów. Wici występujące u Prokaryota są zbudowane inaczej niż te, które posiadają organizmy zaliczane do jądrowców (Eukaryota). Wić bakterii składa się ze spiralnie skręconych włókien białkowych: (flagelliny). Wici bakteryjne wprowadzane są w ruch przez występujące w błonie komórkowej bakterii białka motoryczne, które w odróżnieniu od białek motorycznych komórek eukariotycznych – nie wykorzystują cząsteczek ATP jako źródła energii, lecz czerpią ją bezpośrednio z gradientu protonowego, który występuje pomiędzy zewnętrzną i wewnętrzną stroną błony komórkowej. Białka te wprawiają w ruch obrotowy strukturę, która jest podstawą bakteryjnej wici. Gdy wici obracają się w kierunku przeciwnym do ruchu wskazówek zegara, tworzą wiązkę, która odpowiada za ukierunkowany ruch komórki. Gdy poruszają się one zgodnie z ruchem wskazówek zegara, wici zaczynają pracować skokowo i nie współpracują ze sobą, sprawiając, że bakteria koziołkuje, zmieniając zarazem kierunek ruchu. Wyliczono, że bakterie posiadające wić potrafią płynąć z prędkością 25 mikrometrów na sekundę. Oznacza to, że w ciągu sekundy pokonują odległość 10 razy większą niż ich rozmiary. Gdyby ludzie poruszali się z taką szybkością, to pokonywaliby odległość 100 metrów w około 5 sekund[72].
Fimbrie natomiast, to włókna białkowe o średnicy wynoszącej 2-10 nanometrów i długości kilku mikrometrów. Są rozsiane po całej powierzchni komórki. Uważa się, że fimbrie służą do przyłączania bakterii do innych powierzchni, przez co są jednym z głównych czynników określających zjadliwość bakterii chorobotwórczych[73].
Pilusy są specyficznymi tworami nieznacznie większymi niż fimbrie. Pozwalają one na przeniesienie materiału genetycznego pomiędzy dwiema bakteriami w procesie zwanym koniugacją[74].
Bakterie wytwarzają kapsuły lub warstwy śluzu, którym się otaczają. Śluz bywa niezwykle zróżnicowany – może być zwykłą warstwą zdezorganizowanego polimeru, występującego w okolicy komórki lub złożoną otoczką stworzoną z glikokaliksu. Struktury te mają za zadanie osłaniać bakterie przed wrogami takimi jak inne bakterie, bakteriofagi lub leukocyty organizmów eukariotycznych, np. makrofagi[75]. Kapsuły i śluz mogą być również antygenami, dzięki którym bakterie mogą się rozpoznawać. Ułatwiają one również rozpoznawanie odpowiednich struktur w celu dołączenia się do nich, gdy bakterie tworzą biofilm[76].
Zgromadzenie zewnętrznych struktur komórkowych jest uzależnione od bakteryjnych systemów wydzielniczych. Białka wytwarzane we wnętrzu bakterii są wydzielane do środowiska, gdzie okładają się wokół komórki lub są wydalane całkowicie. Wiele czynników jest charakterystycznych tylko dla jednej bakterii, określają one wirulencję patogenów[77].
Endospory

Znaczenie endospor u bakterii
Niektóre bakterie potrafią tworzyć struktury przetrwalnikowe zwane endosporami, które pozwalają przetrwać niekorzystne warunki. Są one wytwarzane przez bakterie Gram-dodatnie należące do rodzajów: Bacillus, Clostridium, Sporohalobacter, Anaerobacter i Heliobacterium. Charakteryzuje je niezwykła odporność[78]. W prawie wszystkich przypadkach jedna komórka wytwarza jedną endosporę, więc nie jest to proces reprodukcji, chociaż Anaerobacter potrafią wytwarzać aż siedem endospor z jednej komórki[79]. Endospora składa się z cytoplazmy wraz z DNA i rybosomami otoczonej przez nieprzepuszczalną ścianę.
Odporność endospor
Endospory nie wykazują metabolizmu i są odporne na ekstremalne warunki fizyczne (wysokie promieniowanie UV, promieniowanie gamma, wysokie temperatury, zmiany ciśnienia i osuszanie) oraz działanie substancji chemicznych (detergenty, środki dezynfekujące)[80]. W tym stanie mikroorganizmy mogą przeczekać niekorzystne warunki, będąc gotowymi do rozwoju przez miliony lat[81][82], nawet gdy znajdą się w próżni, np. w przestrzeni kosmicznej[83]. Endospory niektórych patogenów są szczególnie groźne dla człowieka, np. Bacillus anthracis wywołujący wąglik lub Clostridium tetani wywołujący tężec. Endospory rozwijają się w żywe komórki bakteryjne wtedy, gdy dostaną się do środowiska, w którym mają ku temu dogodne warunki, np. do krwi[84].
Metabolizm
Podział bakterii według ich metabolizmu
W przeciwieństwie do innych grup organizmów wśród bakterii można znaleźć przedstawicieli bardzo różnych strategii metabolicznych[85]. Różnice w sposobie uzyskiwania energii i różne substancje wykorzystywane w reakcjach katabolicznych i anabolicznych zostały uwzględnione przy ich podziale systematycznym. Jednak niejednokrotnie taka klasyfikacja nie oddaje filogenezy bakterii[86]. Bakteryjne strategie metaboliczne dzieli się ze względu na trzy kryteria: źródła energii, sposoby jej uzyskiwania i substraty reakcji chemicznych. Dodatkowym kryterium jest występowanie akceptorów elektronów pozwalających na beztlenowe oddychanie[87]. Stąd jednym z kryteriów podziału jest wykorzystywanie lub niewykorzystywanie tlenu, co daje podział na bakterie tlenowe (aerobowe) i beztlenowe (anaerobowe). Podział ten bywa użyteczny przy zwalczaniu bakterii, gdyż dla wielu chorobotwórczych bakterii beztlenowych tlen jest toksyczny (anaeorobowość obligatoryjna). Wśród bakterii zdarza się też anaerobowość fakultatywna, gdy tlen nie jest konieczny do oddychania, ale nie jest też zabójczy. Niektóre bakterie tworzą kolonie, w których jedne komórki żyją w warunkach tlenowych (fotosyntezują i oddychają tlenowo), a inne (tzw. heterocysty) są od tlenu izolowane i przeprowadzają reakcje, które obecność wolnego tlenu by zaburzała (np. wiązanie azotu atmosferycznego). Jest to zjawisko typowe dla niektórych sinic (np. trzęsidłowców).
| Grupa bakterii | Źródło energii | Składniki niezbędne do uzyskania energii | Przykłady |
|---|---|---|---|
| Fotoautotrofy | Światło słoneczne | Związki organiczne lub wiązanie węgla | sinice, zielone bakterie siarkowe, Chloroflexi i bakterie purpurowe |
| Litotrofy | Związki nieorganiczne | Związki organiczne lub wiązanie węgla | Thermodesulfobacteria, Hydrogenophilaceae, i Nitrospirae |
| Organotrofy | Związki organiczne | Związki organiczne (chemoheterotrofy) lub wiązanie węgla (chemoautotrofy) | Bacillus, Clostridium i Enterobacteriaceae |
Heterotrofizm u bakterii
Metabolizm węgla może być u bakterii heterotroficzny, gdzie związki organiczne zostają wykorzystane do produkcji energii. Wiele bakterii heterotroficznych jest pasożytami innych organizmów. Znane są również bakterie autotroficzne, zdobywające węgiel z dwutlenku węgla. Do typowych bakterii autotroficznych zalicza się cyjanobakterie (sinice), zielone bakterie siarkowe, niektóre bakterie purpurowe, ale też wiele chemolitotrofów, takich jak bakterie nitryfikacyjne i bakterie siarkowe[88].
Metabolizm fotoautotrofów
Innym kryterium podziału bakterii jest sposób produkcji użytecznej biologicznie energii – fotoautotrofy, używające światła do fotosyntezy oraz chemoautotrofy, które potrzebują substancji chemicznych do uzyskiwania energii w trakcie ich utleniania. Utleniaczem może być tlen, ale w warunkach beztlenowych także inne substancje.
Poza tym bakterie dzieli się na litotrofy, które używają związków mineralnych jako donorów elektronów oraz organotrofy, które jako donorów używają związków organicznych.
Metabolizm chemotrofów
Organizmy chemotroficzne używają do wytwarzania energii, w procesach oddychania i innych reakcjach (np. biosyntezie), określonych substancji chemicznych. Fototrofy używają ich tylko do biosyntezy, natomiast energię czerpią ze światła. Organizmy oddychające, jako źródło energii wykorzystują związki chemiczne, pobierając elektrony od zredukowanego substratu i przenosząc je do akceptorów (reakcja redoks). Energia ta może zostać użyta do wytworzenia ATP i w postaci tego nośnika – do kolejnych reakcji metabolicznych. U organizmów tlenowych akceptorem elektronów (tj. utleniaczem) jest tlen. U bakterii beztlenowych są to inne substancje chemiczne, np. azotany, siarczany albo dwutlenek węgla. Reakcje te są podstawą wielu ważnych ekologicznie procesów, takich jak denitryfikacja, redukcja siarczanów i octanogeneza.
Fermentacja u chemotrofów
Innym sposobem życia chemotrofów, występującym w przypadku braku wyżej wymienionych akceptorów elektronów jest wykorzystywanie fermentacji, gdzie elektrony zredukowanego substratu są przenoszone do utlenionych nośników pośrednich, aby wytworzyć zredukowane produkty fermentacji (np. etanol). Fermentacja jest możliwa, ponieważ energia zawarta w substratach jest większa niż energia zawarta w produktach reakcji, dzięki czemu mogą one zsyntetyzować ATP i wykorzystać ten typ metabolizmu[89][90].
Ten proces ma także wielkie znaczenie w biologicznej reakcji na zanieczyszczenie. Bakterie siarkowe charakteryzuje produkcja niezwykle toksycznych substancji na bazie rtęci (metylortęci i dimetylortęci). Anaerobowe bakterie korzystają z fermentacji pozwalającej wytworzyć energię i siłę redukcyjną, przy czym dochodzi do ubocznego wytwarzania metabolitów (takich jak etanol, co ma znaczenie np. w piwowarstwie)[91]. Fakultatywne anaeroby mogą przechodzić między fermentacją a wykorzystywaniem innych różnorodnych akceptorów elektronów, w zależności od warunków środowiska.
Oddychanie beztlenowe litotrofów
Litotrofy mogą używać związków nieorganicznych jako źródła energii. Donorami elektronów w tym przypadku są substancje takie jak wodór, tlenek węgla, amoniak (proces nitryfikacji), monotlenek żelaza (tlenek żelaza(II)), zredukowane jony żelaza i kilka (również zredukowanych) związków siarki. Metan może także posłużyć bakteriom metanotroficznym do anabolizmu węgla i jako źródło elektronów[91]. Zarówno aerobowe fototrofy, jak i chemolitotrofy, używają tlenu jako ostatecznego akceptora elektronów, jednak w sytuacji niedoboru tlenu przechodzą one z powrotem na wykorzystywanie w tym celu związków nieorganicznych. Litotrofy w większości są autotroficzne, natomiast organotrofy – heterotroficzne. Pewne bakterie potrafią wiązać azot atmosferyczny w procesie diazotrofii. Są to bakterie azotowe, czasem żyjące w symbiozie z roślinami jako bakterie brodawkowe. Ten szlak metaboliczny mający duże znaczenie dla środowiska (geochemiczny obieg azotu) można znaleźć u bakterii przyjmujących niemal wszystkie strategie metaboliczne, zatem niektóre bakterie potrafią wiązać zarówno atmosferyczny azot, jak i węgiel (w procesie fotosyntezy), nie jest jednak uniwersalny[92].
Wzrost i reprodukcja
Wzrost komórek bakteryjnych, podobnie jak wszystkich innych komórek, polega na stopniowym zwiększaniu objętości, poprzez produkcję nowych białek i innych elementów strukturalnych, oraz gromadzenie substancji pochodzących ze środowiska. Bakterie rosną, aż osiągną pewną wielkość, po której następuje ich podział na dwie bakterie pochodne. Podział ten nosi nazwę podziału komórki i jest jednym ze sposobów rozmnażania bezpłciowego[93]. Przy odpowiednich warunkach bakterie mogą dzielić się co około 9,8 minuty[94]. Komórki potomne są identyczne z rodzicielską.
Niektóre bakterie posiadają bardziej złożoną budowę i struktury ułatwiające rozmnażanie, np. Myxobacteria i Streptomyces. Bakterie te wytwarzają strzępki na swojej powierzchni, które następnie dojrzewają i odrywają się od komórki macierzystej.
U niektórych typów bakterii mogą występować procesy płciowe, lecz nie mają one żadnego związku z reprodukcją.

W laboratoriach w celu obserwacji i hodowli, bakterie umieszcza się na odpowiednich stałych lub ciekłych podłożach hodowlanych (mikrobiologicznych). Stałe, takie jak pożywka agarowa (której głównym wypełniaczem jest pozyskiwany z glonów agar-agar) są używane w celu izolacji odpowiednich kultur bakteryjnych. Z płynnych korzysta się najczęściej, gdy należy wykonać pomiar wzrostu dużych ilości bakterii lub szacować ich ilość w badanym materiale. Komórka w pożywce ma zapewnione wszystkie niezbędne jej do życia składniki. Dodatkowo mogą one bardzo łatwo rozprzestrzeniać w całym podłożu. Trudno jednak wyizolować pojedyncze komórki, ponieważ bakterie mnożą się bardzo szybko i w krótkim czasie wypełniają prawie całą, dostępną im powierzchnię. Mieszaniny pożywek z dodatkowymi substancjami (np. antybiotykami) pozwalają na sprawdzenie właściwości bakterii, a także na przypisanie ich do danego podgatunku[95].
W większości laboratoriów do hodowli bakterii przeznacza się odpowiednie składniki odżywcze, w celu osiągnięcia jak największej ilości bakterii w krótkim czasie. Faza intensywnego wzrostu populacji bakterii na danej pożywce jest czasem określana w przybliżeniu jako faza wzrostu wykładniczego.
Jednakże w naturalnych warunkach, w których może braknąć pożywienia, bakterie nie mogą rozmnażać się bez przerwy. Z tego powodu opracowały one odpowiednią strategię rozrodczą. Gdy nastąpi nagły wzrost ilości pożywienia bakterie mogą gwałtownie się rozmnażać, podobnie do glonów, które w takich warunkach (zwykle latem) tworzą zakwity[96]. Przez dobór odpowiednich składników podłoża można również prowadzić hodowle różnicowe służące do identyfikacji mikroorganizmów.
Wzrost bakterii można podzielić na trzy etapy. Kiedy środowisko zmienia się, np. zwiększa się ilość pożywienia, albo bakterie dostaną się do nowego miejsca, muszą odpowiednio przystosować się do nowych warunków życia. Zmiany te wpływają także na ich rozwój. Pierwszym stadium rozwoju bakterii jest tzw. faza pierwotnego zahamowania. W tym czasie rozwijają się one bardzo wolno przygotowując się do zwiększenia ilości pożywienia w ich pobliżu, dzięki któremu będą mogły szybko urosnąć. Stadium charakteryzuje wysoki poziom biosyntezy niezbędny do wyprodukowania dużych ilości białka[97]. Drugim stadium jest faza logarytmicznego wzrostu, znane też jako stadium wykładnicze. Charakteryzuje je niezwykle szybki wzrost bakterii. Tempo wzrastania komórek jest oznaczane jako tempo wzrostu (k), a czas jaki jest potrzebny do podziału nazywa się czasem pokolenia (g). Podczas tej fazy zwiększa się metabolizowanie pożywienia, aż go zabraknie, co spowoduje zatrzymanie procesu i przejście do fazy trzeciej. Jest to stadium, które stanowi moment przejścia pomiędzy poprzednimi. Bakterie powoli stabilizują swoje procesy życiowe, część z nich obumiera. Te które przetrwają wracają do fazy zahamowania[98].

Bakterie wypracowały wiele różnych mechanizmów ułatwiających im przetrwanie. Jedną z możliwości Streptomyces jest produkcja antybiotyków (streptomycyna, neomycyna) w celu likwidacji innych drobnoustrojów znajdujących się w pobliżu. Sama bakteria jest na nie odporna[100]. Oprócz tego część bakterii wytwarza bakteriocyny, które doprowadzają do bakteriostazy, czyli zahamowania wzrostu wrażliwych na nie gatunków. Dodatkowo wiele bakterii przystosowało się do życia w środowisku tworząc kolonie (np. biofilmy) w miejscu o zwiększonej ilości pożywienia. Dzięki temu mogą lepiej pozyskiwać substancje odżywcze ze środowiska[101]. Te sposoby uzyskiwania lepszych warunków do rozwoju są niezwykle cenne, gdyż zapewniają minimalizację kosztów wynikających z konkurencji i częściowe bezpieczeństwo[102].
Genetyka
Replikony bakteryjne
Bakterie posiadają zwykle pojedynczy chromosom, którego wielkość wynosi zaledwie od około 160 000 par zasad u endosymbiotycznych Candidatus Carsonella ruddii[103] do 13,033,779 par u Sorangium cellulosum[104]. Krętki z rodzaju Borrelia są jedynym wyjątkiem, gdyż mają pojedynczy chromosom liniowy. Należy tu Borrelia burgdorferi, który wywołuje boreliozę, zwaną także krętkowicą kleszczową oraz chorobą z Lyme[105]. Bakteryjne geny zwykle są umieszczone na pojedynczym odcinku DNA i chociaż u bakterii zdarzają się także różne typy intronów, to są one o wiele rzadsze niż u eukariontów[106]. Bakterie mogą także posiadać plazmidy, które są cząsteczkami DNA replikującymi się samodzielnie, niezależnie od chromosomu bakteryjnego. Plazmidy, w przeciwieństwie do chromosomów bakteryjnych, nie niosą genów metabolizmu podstawowego, nie są więc bezwzględnie niezbędne do życia komórki bakteryjnej. Mogą jednak nieść geny odpowiadające np. za oporność na antybiotyki, oraz wirulencję bakterii.
Wymiana materiału genetycznego
Bakterie potrafią także wymieniać się genami między sobą. Zjawisko to może nastąpić na trzy różne sposoby. Po pierwsze bakterie mogą pobrać dany gen ze środowiska w procesie nazywanym transformacją. Drugą metodą jest przeniesienie genów w procesie transdukcji, kiedy bakteriofag wprowadza swoje geny do chromosomu. Trzecią możliwość stanowi koniugacja bakteryjna, gdzie DNA jest przenoszone poprzez bezpośredni kontakt komórek bakterii.
Ochrona genomu bakterii przed wirusami
Jednym z typów bakteryjnego genomu jest połączenie genów bakterii z materiałem genetycznym bakteriofagów. Wiele bakterii jest atakowanych przez te wirusy, które „wstrzykują” do ich chromosomów własny materiał genetyczny. Bakteriofagowe geny mają wielki wpływ na fenotyp bakterii. Dzięki temu na drodze ewolucji niegroźne bakterie zamieniały się w niebezpieczne dla życia innych organizmów, takie jak Escherichia coli O157:H7 czy Clostridium botulinum po przejęciu niesionych przez faga genów pewnej toksyny[107]. Bakterie potrafią jednak bronić się przed zainfekowaniem przez fagi. Służy im do tego specjalny system obronny nazywany systemem ograniczenia modyfikacji, który potrafi degradować obce DNA i rozbijać je na pojedyncze nukleotydy[108]. System ten używa także odpowiednich kolejności CRISPR, dzięki któremu może zapamiętywać szczególne cechy danego bakteriofaga i w późniejszym kontakcie z nim znacznie lepiej go zwalczać, poprzez blokowanie syntezy materiału genetycznego faga i bakterii oraz dalszemu uniemożliwieniu przeprowadzenia intenferencji RNA[109][110]. CRISPR stanowi więc odporność nabytą bakterii na infekcje wirusową.
Mutacje w genomie bakterii
Bakterie jako organizmy rozmnażające się bezpłciowo dziedziczą identyczny materiał genetyczny od ich rodziców (można nawet powiedzieć, że są ich klonami). Mimo to każda bakteria kształtuje swój własny fenotyp, co jest spowodowane zmianami w DNA. Poza tym wśród bakterii można sztucznie spowodować zmianę. Naturalnie może ona powstać na skutek mutacji oraz rekombinacji genetycznej. Mutacje powstają na skutek błędów w czasie tworzenia repliki DNA lub jako skutek oddziaływania mutagenu. Szansa na powstanie i czas potrzebny do zajścia mutacji są różne w obrębie każdego gatunku, a nawet tej samej bakterii[111]. Genetyczne zmiany u bakterii są powodowane mutacjami przy replikacji genów albo na skutek różnorodnych „nacisków” ze strony człowieka, gdy na wybrany gen oddziałuje się licznymi mutagenami, prowadzi to do zakłócenia procesów wewnętrznych i w konsekwencji do mutacji[112].
Koniugacja jako poziomy transfer genów
Podczas koniugacji jedna komórka („dawca”) wytwarza rurkowate cytoplazmatyczne wyrostki, tzw. pilusy, umożliwiające kontakt między komórkami bakterii. Po wymianie cytoplazmy wraz z materiałem genetycznym (plazmidami) komórki rozdzielają się. Proces ten ma różne odmiany. Wszystkie sposoby wymiany materiału genetycznego nazywają się poziomym transferem genów. Bakterie mogą wykorzystywać wszystkie te metody w naturalnym środowisku[113]. Transfer genowy jest szczególnie cenny przy wytwarzaniu oporności na antybiotyki, gdyż umożliwia bakterii odpornej na działanie antybiotyku uodparnianie innych, poprzez przekazywanie im genów warunkujących odporność, przez co może doprowadzić do uodpornienia całej populacji[114]. Z tego powodu poziomy transfer genów może być z medycznego punktu widzenia niezwykle groźny, gdy zachodzi wśród bakterii chorobotwórczych. Odkrycie poziomego transferu genów (transformacji u dwoinki zapalenia płuc) przez Fredericka Griffitha przyczyniło się do rozwoju genetyki molekularnej i później pozwoliło wyjaśnić rolę DNA.
Ruch

Rodzaje ruchów u bakterii
Część bakterii posiada zdolność do aktywnego ruchu. Poruszanie może odbywać się za pomocą wici, ruchu ślizgowego, ruchu wirowego lub zmian wyporności[115]. W przypadku ruchu wirowego bakteria używa IV typu pilusów, korzystając z nich jak z haka. Mocuje się nimi w podłożu i podciąga się ze stosunkowo dużą siłą (>80 pikoniutonów)[116]. Mikroby mogą poruszać się z dużą prędkością, na przykład przecinkowiec cholery (Vibrio cholerae) należący do najbardziej ruchliwych bakterii osiąga prędkość 200 μm/s, czyli w ciągu minuty jest w stanie pokonać odległość większą niż 1 cm. Ovobacter propellens potrafi poruszać się z prędkością nawet 1 mm/s[117].
Mechanizm działania wici
Bakterie charakteryzuje niezwykła różnorodność wici. Może ona być pojedyncza i długa, podwójna (jedna z przodu, a druga z tyłu) lub wiązka wici na części lub całej komórce bakteryjnej. Wić należy do najlepszych środków napędu wykorzystywanych przez większość organizmów. Tworzy ją 20 białek, ale do jej kontroli i przymocowania bakteria używa ich 30[115]. Wić to obracająca się struktura zewnątrzkomórkowa wprawiana w ruch przez kinetosom, który napędza gradient H+ wytwarzany przez pompę protonową.
Rzęski politrychalne
Wiele bakterii (np. Pałeczka okrężnicy (E. coli)) posiada możliwość wykonywania kilku różnych ruchów: w przód (pływanie), w dół lub w górę. Możliwości wykonywania kilku ruchów sprawiają, że mogą one poruszać się trójwymiarowo w błądzeniu losowym[118].
Rzęski peritrychalne
Unikatowy rodzaj wici posiadają krętki (Spirochateae), u których są one umieszczone pomiędzy dwiema błonami w przestrzeni międzyplazmatycznej. Ich ciało ma charakterystyczny kształt linii śrubowej, wijąc się, gdy bakteria porusza się[115].
Ruch zależny od aktyny
Niektóre Listeria i Shigella potrafią wykorzystywać cytoszkielet wewnątrz komórki gospodarza. Wytwarzają strukturę przypominającą ogon lub wić, która ułatwia im pokonywanie dużych odcinków w ciele żywiciela[119].
Rodzaje taksji u bakterii
Ruchliwe bakterie reagują na bodźce, wykonując ruchy do przodu lub do tyłu. Bakterie poruszają się dzięki różnym taksjom (chemotaksja, fototaksja, magnetotaksja i in.)[120][121]. Specyficzna pod tym względem jest grupa Myxobacteria, wśród której bakterie poruszają się grupowo, tworząc owocniki[49]. Ruchy myksobakterii można zaobserwować tylko na stałych pożywkach, w przeciwieństwie do E. coli, która wykonuje ruchy wyłącznie w płynach.
U różnych bakterii występują następujące rodzaje taksji:
- geotaksje, jako efekt zmian metabolizmu, pionowe przemieszczanie się w toni wodnej;
- fototaksje, wywołane reakcjami związanymi z wyszukiwaniem optymalnych warunków świetlnych;
- chemotaksje, czyli ruchy od lub do substancji chemicznych obecnych w środowisku; pozwala wyszukać pokarm lub rozpoznać obecność innych komórek; bodźce chemiczne odbierane są tu za pomocą białek receptorowych znajdujących się w błonie komórkowej;
- aerotaksje; ruch ku miejscom o optymalnym stężeniu tlenu (pewien rodzaj chemotaksji);
- magnetotaksje; są to ruchy wzdłuż pola linii pola magnetycznego, tak by bakteria żyjąca w mule wędrowała w głąb osadu (ku warunkom beztlenowym); umożliwiają je specjalne organelle – magnetosomy zwierające tlenki żelaza, umieszczone w pobliżu nasady rzęsek[48].
Początki i wczesna ewolucja
Przodkami współczesnych bakterii były jednokomórkowe mikroorganizmy, które pojawiły się na Ziemi jako pierwsze formy życia około 4 miliardów lat temu. Przez około 3 miliardy lat wszystkie organizmy były mikroskopijne, a bakterie i archeony były dominującymi formami życia[122][123] (do czasu pojawienia się pierwszych bezkręgowców i roślin). Istnieją skamieniałości bakterii, takie jak stromatolity, jednak brak znaczących różnic morfologicznych pomiędzy nimi a współczesnymi bakteriami, uniemożliwia ocenianie na ich podstawie wieku różnych gatunków, a także traktowania ich jako skamieniałości przewodnich. Natomiast analiza sekwencji genowych pozwala określić niektóre funkcje dawnych komórek bakteryjnych. Wykazano, że te pierwsze komórki bakteryjne różniły się od pierwszych linii organizmów eukariotycznych i archeonów[124]. Ostatnim wspólnym przodkiem organizmów bakteryjnych i Archaea był organizm hipertermofilny, który występował najprawdopodobniej około 2,5 miliarda do 3,2 miliarda lat temu[125][126]. Istniejące dziś rozbieżności między domenami Eubacteria, Eukaryota i Archaea są wynikiem różnicowania się podczas długiej ewolucji. Uważa się, że dzisiejsze organizmy eukariotyczne powstały poprzez wejście w symbiozę z ówczesnymi komórkami bakteryjnymi[127][128].
Pomiędzy komórkami prokariotycznymi a eukariotycznymi istnieją liczne różnice. U prokariontów brak na przykład występujących w niemal wszystkich komórkach eukariotycznych organelli komórkowych takich jak jądro komórkowe czy mitochondria (lub hydrogenosomy). W XX w. sugerowano, że odpowiednikiem mitochondriów lub hydrogenosomów mogą być mezosomy, które ostatecznie jednak okazały się artefaktem[129]. Mitochondria wykazują pewne podobieństwa w swojej budowie do pewnych bakterii, co daje podstawy do stwierdzenia, że bakterie (zapewne pierwotne proteobakterie) na drodze endosymbiozy zostały wchłonięte przez eukarionty i przekształciły się w mitochondria. Niektóre bakterie endosymbiotyczne (sinice) zredukowały się wewnątrz komórek eukariotycznych tworząc chloroplasty i prowadząc do powstania glonów i roślin. Istnieje wiele grup glonów, w przypadku których wykazano znaczne podobieństwa, w tym genetyczne, ich chloroplastów i bakterii, co pozwala twierdzić, że ich ewolucja zaczęła się od komórek bakterii[130][131].
Klasyfikacja i identyfikacja

Klasyfikacja biologiczna bakterii stara się opisać dokładnie każdy ich gatunek oraz zgrupować je według pokrewieństwa. Bakterie można sklasyfikować na podstawie różnic w ich budowie (np. występowania ściany komórkowej), typie metabolizmu albo na różnicach w organellach komórkowych i DNA, np. po występowaniu kwasów tłuszczowych, pigmentu, antygenów i benzochinonu[132]. Mimo to używanie tych różnic jako kryteriów nie było najlepszym wyjściem, gdyż nie dawało pewności, czy dane bakterie należą do jednego gatunku, ale są dosyć zróżnicowanymi odmianami, czy też należą do dwóch oddzielnych taksonów. Główną przyczyną tych niepewności był fakt, że nawet przy użyciu zaawansowanego sprzętu bakterie są do siebie wizualnie bardzo podobne i nie posiadają wyróżniających je struktur oraz istnienie różnych postaci poziomego transferu genów między niespokrewnionymi ze sobą gatunkami[133]. Dzięki temu transferowi nawet blisko spokrewnione ze sobą bakterie mogą inaczej przeprowadzać metabolizm i mieć inne organelle. Dla zwiększenia precyzji taksonomicznej w systematyce bakterii wykorzystuje się liczne osiągnięcia biologii molekularnej, która używa różnorodnych technik do badania DNA, np. sprawdzanie ilości cytozyny i guaniny w hybrydyzacji genomu oraz badaniu materiału nieulegającego transferowi, tj. rRNA[134]. Najnowsze dane dotyczące systematyki bakterii podaje IJSEM (International Journal of Systematic Bacteriology), LPSN (List of Prokaryotic names with Standing in Nomenclature) oraz różnego rodzaju publikacje naukowe.
Prawidłowa identyfikacja bakterii w laboratorium ma szczególne znaczenie w medycynie. Dzięki niej można mieć pewność co do patogenu, z jakim ma się do czynienia. Choroby były jedną z przyczyn rozwoju bakteriologii i systematyki bakterii, ponieważ lekarze nie wiedzieli z czym i jak mają walczyć.
Barwienie metodą Grama, opracowane przez Hansa Christiana Grama w roku 1884, było odkryciem przełomowym w dziedzinie mikrobiologii (zwłaszcza lekarskiej). Jego metoda bazowała na charakterystyce budowy ściany komórkowej bakterii[135]. Grube warstwy peptydoglikanu u bakterii Gram-dodatnich są barwione na kolor purpurowy, podczas gdy Gram-ujemne o znacznie cieńszej ścianie komórkowej są barwione na różowo. Dzięki informacjom uzyskanym z wyników barwienia oraz po cechach morfologicznych organizmów można je zakwalifikować do ziarenkowców, laseczek, pałeczek. Mimo to istnieją patogeny, których nie można sklasyfikować na podstawie testu Grama, np. prątki lub Nocardia, do wykrywania których wykorzystuje się barwienie kwasowe i barwienie metodą Ziehla-Neelsena[136]. Istnieją jednak bakterie, które można zidentyfikować tylko na podstawie obserwacji ich wzrostu w pożywkach lub innych technik, np. serologicznych.
Kultury bakteryjne oraz techniki ich pozyskiwania są różne dla różnych bakterii. W plwocinie można znaleźć bakterie, które wywołują np. zapalenie płuc. Do innych stosuje się badanie kału lub moczu. Bakterie takie jak salmonella można zidentyfikować na podstawie reakcji, w jakie wchodzą z innymi bakteriami na pożywkach. Substancje i płyny, takie jak krew lub płyn mózgowo-rdzeniowy, które w normalnych sytuacjach są sterylne, w przypadku infekcji zapełniają się bakteriami. W przypadku błędnie pobranego materiału wyhodowanie bakterii nie musi oznaczać infekcji. Dodatkowo wszelkie bakterie jakie w nich się znajdują można przenieść na pożywki w celu ich hodowli i identyfikacji[95][137].
Jako metodę klasyfikacji bakterii coraz częściej używa się badań i eksperymentów molekularnych. Dzięki reakcji łańcuchowej polimerazy można szybko i łatwo (w warunkach laboratoryjnych) sprawdzić sekwencje genomu bakterii i porównać je z różnymi szczepami[138]. Te metody pozwalają także na wykrywanie „żywych, ale nie rozmnażających się” bakterii, które przeprowadzają metabolizm, ale nie są w stanie dokonywać podziałów[139]. Jednak mimo używania najlepszych znanych ludzkości metod badawczych nie można dokładnie stwierdzić ile gatunków bakterii istnieje na Ziemi ani ile szczepów zawiera dany gatunek. Ludzie znają mniej niż 9000 gatunków bakterii (łącznie z sinicami)[140], a oszacowania mówią o istnieniu od 107 do 109 gatunków bakterii, przy czym może być ich znacznie więcej[141][142].
Historia klasyfikacji
XVIII i XIX w.
Pierwszą próbę zaklasyfikowania mikroskopijnych żyjątek podjął Karol Linneusz, który w dwunastej edycji swojego Systema Naturæ utworzył dla nich osobny rodzaj: Chaos i umieścił – obok zwierząt niższych i większych protistów – w rzędzie Zoophyta, który zaliczył do gromady Vermes królestwa zwierząt[143]. Tak powierzchowne potraktowanie tej grupy – dziś obejmującej kilka królestw – skrytykował Otto Friedrich Müller, który ustanowił w 1773 r. rząd Infusoria obejmujący początkowo 13 rodzajów, do których w 1786 r. – na kartach pierwszej monografii z dziedziny klasyfikacji mikroorganizmów – zostało przyłączonych pięć kolejnych[144][145]; bakterie mieściły się – obok innych drobnych jednokomórkowców – w rodzajach Monas i Vibrio[146]. W ostatnich dekadach XVIII w. wiedza na temat pierwotniaków i glonów była sukcesywnie rozwijana, podczas gdy niewielkie w rozmiarach prokarionty pozostawały słabo poznane[146]. Tożsamość wielu wcześnie opisanych taksonów bakterii nie jest znana; pierwszy gatunek bakterii opisano dopiero w 1809 r. (choć jego przynależność do nich nie została uznana do 1892 r.[147])[148].
Od lat 20. XIX w. takson mikroorganizmów traktowany był najczęściej w randze gromady[149], choć pojawiały się również propozycje utworzenia osobnego królestwa, w którym znalazłyby się również np. gąbki[150]. Termin „bakterie” ⟨niem. Bacterien⟩ wprowadził w 1838 r. niemiecki biolog Christian Gottfried Ehrenberg jako nazwę zwyczajową dla opisanego 10 lat wcześniej rodzaju Bacterium[12][151][152], jednakże odpowiednikiem współcześnie rozumianych bakterii był takson Vibrionia – utworzony przez Ehrenberga w 1830 r. w ramach zapewne pierwszej[a][153][154] klasyfikacji bakterii jako sekcja[b] rodziny Epitricha obejmująca rodzaje: Bacterium (pałeczki), Vibrio (przecinkowce) oraz Spirillum (śrubowce); w 1838 r. takson Vibrionia został awansowany do rangi rodziny i wliczone zostały do niego dwa nowe rodzaje: Spirochaeta (krętki) oraz Spirodiscus (elastyczne, zwinięte pałeczki)[151][155][156]. Podczas gdy rodzaje: Vibrio, Spirochaeta oraz Spirillum są wciąż powszechnie stosowane[157], rodzaj Bacterium wyszedł z użycia i – mimo propozycji użycia go jako tymczasowego dla niektórych[c] gatunków o statusie incertae sedis – został uznany za nomen rejiciendum w 1951 r. (wraz z rodziną Bacteriaceae)[152][158]; tożsamość rodzaju Spirodiscus przez długi czas pozostawała zagadką, jednakże w 1954 r. okazało się, iż jest on prawdopodobnie synonimem Ophiocytium – rodzaju eukariontów z grupy różnowiciowców[159][160]. Rodzina (a wcześniej sekcja) Vibrionia zaliczona została do zwierząt, za czym przemawiać miała ruchliwość napędzana wicią (wykluczająca je z królestwa roślin); w związku z tym Ehrenberg doszukiwał się w nich (jak i w innych mikroorganizmach) cech typowo zwierzęcych (m.in. przewodu pokarmowego, układu nerwowego, naczyń krwionośnych i kończyn), co skutkowało zaliczeniem ich do rzędu Anentera („bezjelitowych”) w ramach gromady Polygastrica („wielożołądkowych”) należącej do Phytozoa („zwierząt roślinopodobnych”)[151][155][161]; wspomnianą klasyfikację mikrobów skrytykował Karl Theodor Ernst von Siebold w swojej pracy na temat anatomii porównawczej, jednakże przedstawiona przez niego alternatywa nie uwzględniała rodziny Vibrionia[161]. Choć Ehrenberg nie miał pełnej świadomości, jak istotną część biomasy stanowią bakterie, odnotował, iż występują one w całej Europie oraz w Libii[151]. W 1841 r. Félix Dujardin przydzielił bakterie (Vibrioniens) do monotypowego rzędu „asymetrycznych Infusoria”; uznawał trzy rodzaje: Bacterium, Vibrio oraz Spirillum (do którego włączył Spirochaeta) – położenie Spirodiscus uznał za niejasne[154].
W swojej klasyfikacji bezkręgowców z 1852 r., Maximilian Perty zwrócił uwagę m.in. na to, że wiele mikroorganizmów nie wpisuje się w dotychczasowy podział świata żywego (na rośliny i zwierzęta), i nie można rozpatrywać ich anatomii analogicznie do zwierzęcej; mimo to zaliczył je do królestwa Animalia jako podkrólestwo Archezoa dzielące się na dwie gromady: Rhizopoda oraz Infusoria; ta druga obejmowała m.in. bakterie, które podzielił na dwie grupy: Spirillina (Spirillum, Spirochaeta, Spirodiscus[d]) i Bacterina (Bacterium, Vibrio oraz nowe rodzaje: Metallacter, Sporonema)[162]. Choć Perty zachował rodzinę Vibrionia (pod zmienioną nazwą: Vibrionida), przypisał ją do monotypowej sekcji Lampozoida (w tym kontekście – taksonu nadrzędnego wobec rodziny a podrzędnego wobec rzędu)[162]; wprowadził też kilka nowych gatunków będących jednak tylko stadiami rozwojowymi już znanych, co wykazały późniejsze analizy[146].
Bakterie zostały również uwzględnione w pierwszej ewolucyjnej systematyce – opracowanej przez Ernsta Haeckla w 1866 r.[163][164]; o ile podział bakterii (Vibrionida) autorstwa Ehrenberga pozostawił on bez zmian, o tyle przeklasyfikował je do nowo utworzonego królestwa protistów (prymitywnych organizmów o spornej pozycji systematycznej), gdzie zaliczył je do Monera – najprostszych żyjątek, których (pozorny) brak organizacji wewnętrznej ani organelli skłonił Haeckla do wykluczenia ich z grona komórek i określenia mianem cytod[164]. Dwa lata później – w pracy Monographie der Moneren – zmodyfikował on definicję cytod, opierając ją na kryterium bezjądrowości – spełnianym (spośród wówczas znanych organizmów) jedynie przez bakterie[2][165], o czym Haeckel nie wiedział, gdyż nukleusy niektórych eukariontów były niewykrywalne dziewiętnastowiecznym sprzętem[166]; w pierwszych dwu edycjach swojej książki Natürliche Schöpfungsgeschichte – z 1868 i 1873 r. – nie przeprowadził większych zmian w klasyfikacji protistów (prócz nadania linneuszowskich kategorii systematycznych), a o Vibrionida praktycznie nie wspominał (choć wiadomo ze wcześniejszych prac, iż mieścił je w obrębie Gymnomonera – cytod nieopancerzonych); natomiast już 5 lat później uściślił pozycję bakterii, przypisując je do nowo utworzonego rzędu Tachymonera[167]. Koncepcja trzeciego królestwa nie przyjęła się jednak, i biolodzy wciąż wliczali mikroorganizmy do grona roślin lub zwierząt[163].
Również wewnętrzny podział bakterii podlegał licznym zmianom w drugiej połowie XIX w.; w 1869 r. Hermann Hoffmann zaproponował włączenie do nich rodzaju Micrococcus, obejmujący formy odkryte przez Ernsta Halliera w 1868 r. i początkowo uznane za zarodniki grzybów (do których część badaczy zaliczała także inne bakterie – nazywane wtedy Schizomycetes)[146][156][168]; zmianę tę uwzględnił w 3 lata później Ferdinand Cohn w swojej klasyfikacji[156]:
- Plemię Sphaerobacteria – rodzaj Micrococcus
- Plemię Microbacteria – rodzaj Bacterium
- Plemię Desmobacteria – rodzaje Bacillus (Metallacter Perty, 1852 + Sporonema Perty, 1852) i Vibrio
- Plemię Spirobacteria – rodzaje Spirillum i Spirochaete (Spirochaeta)
W 1875 r. Cohn rozwinął swój podział bakterii i włączył do nich sinice (w obrębie dwu różnych taksonów, sugerując ich polifiletyczny charakter), pokrewieństwo tych dwu grup skłoniło go do umiejscowienia ich w królestwie roślin[169], co stało się powszechną praktyką pod koniec XIX w.; dalsza rozbudowa i reorganizacja jego klasyfikacji podjęta w latach 1883–1885 przez Friedricha Wilhelma Zopfa uznana została za jedną z najistotniejszych zmian systematycznych w historii bakteriologii, do której dodatkowe, niewielkie poprawki wprowadził w 1889 r. Ferdinand Hueppe[156][170]. W 1884 r. Anton de Bary zaproponował podział bakterii na dwie grupy z uwagi na zdolność do tworzenia endospor[171][170]; podobny pomysł miał Philippe Édouard Léon Van Tieghem, który umieścił je z sinicami w jednym rzędzie (jako dwie równorzędne jednostki – inaczej niż u Cohna)[172], co skrytykował w 1889 r. Ernst Haeckel, twierdząc, że choć obie gałęzie są sobie bliskie, to jednak pierwsza dała początek przodkom zwierząt, a druga – roślin, w związku z czym należy zaliczyć je do osobnych podkrólestw: Protozoa i Protophyta[173]; Haeckel podtrzymał swoje stanowisko w pracy Systematiche phylogenie z 1894 r.[174], uznając nawet sinice za starsze ewolucyjnie od bakterii, podobnie w pracy z 1904 r.[175]; stosował jednak określenie Monera odnoszące się do obu tych grup, choć nie funkcjonowało ono w jego klasyfikacji. W 1886 r. Carl Flügge uznawał cztery grupy bakterii: ziarniaki, pałeczki, formy spiralne oraz formy różne[170]. W tym samym roku Carl Joseph Schroeter jako pierwszy awansował bakterie do kategorii klasy, którą podzielił na trzy rzędy: Cocobacteria (ziarniaki), Eubacteria (pałeczki) oraz Desmobacteria (filamenty)[170]; podobne podziały zastosowali De Toni i Travisan (1889) oraz Ludwig (1892)[156]. Adolf Engler w swojej pracy z 1892 r. połączył sinice z pozostałymi Bakteriami w jeden podtyp – Schizophyta – królestwa roślin[176].
Na podobnych zasadach jak de Bary oparli się Karl Bernhard Lehmann i Rudolf Neumann, których klasyfikacja z 1896 r.[177] została uznana w retrospekcji, w 1920 r., za najbardziej satysfakcjonującą z opartych na kryteriach czysto morfologicznych[156]; jednakże to klasyfikacja Waltera Miguli, z 1894 r.[178], zgodnie z którą bakterie zostały podzielone w pierwszej kolejności na siarkowe oraz niesiarkowe, a drugorzędne kryterium stanowiła motoryka, zyskała największą popularność i stosowali ją w swoich pracach m.in. Frederick Chester i Erwin Frink Smith, choć, jak się później okazało, niezbyt dobrze odzwierciedlała ona pokrewieństwo między gatunkami. Z kolei Alfred Fischer uznawał dwa rzędy bakterii: Trichobacterinae i Haplobacterinae, tworzące odpowiednio jedno- i wielokomórkowe formy wegetatywne[156][179]; na tej klasyfikacji oparł się Lotsy (1907), dodając myksobakterie jako trzeci rząd[170]. A. Vaughan Jennings uważał zaś, że bakterie należy podzielić na dwie podstawowe grupy – Paraschizae i Diaschizae – których reprodukcja zachodziła poprzez podział wzdłużny i poprzeczny odpowiednio[170].
| Van Tieghem, 1884 | Zopf, 1885 | Migula, 1894 | Lehmann i Neumann, 1896 | Fischer, 1897 |
|---|---|---|---|---|
|
|
|
|
|
XX i XXI w.
Wspólną wadę wcześniej wspomnianych klasyfikacji, uznawanie jedynie dwu rodzajów pałeczkowców, dostrzegł W. Kruse, który w 1896 r. zaproponował zwiększenie ich liczby do piętnastu – w oparciu o wnikliwe badania parametrów takich jak zdolność do tworzenia endospor, struktura błony komórkowej, motoryka, patogenność, a także rzadziej brane pod uwagę dotychczas barwienie, produkcję pigmentów i właściwości biochemiczne tudzież fizjologiczne[170]. I to właśnie te cechy stały się istotnym wyróżnikiem w systematyce bakterii na początku XX w.[180]
Położenie systematyczne krętka bladego pozostowało zagadką przez długi czas od jego odkrycia w 1905 r.; przez niektórych uważany był za bakterię, przez innych – za pierwotniaka[170].
W 1908 r. Charles-Edward Amory Winslow zrewidował klasyfikację ziarniaków, wyróżniając dwie ich podrodziny: na ogół pasożytnicze Paracoccaceae oraz saprofityczne Metacoccaceae. Co istotne, różnica w trybie odżywiania korelowała z innymi: Paracoccaceae były zazwyczaj Gram-dodatnie, zdolne do wytważania kwasów, ale wykazujące się ubogim wzrostem, Metacoccaceae posiadały zaś cechy zupełnie przeciwne. Kształty form morfologicznych nie wykazywały związku z pozostałymi parametrami, i tym samym uznane zostały za mniej ważne; wzrosło za to znaczenie koloru pigmentów[156].
W 1909 r. Orla Jensen porównał fizjologię bakterii, z punktu widzenia systematyka ważniejszą od morfologii, do składu chemicznego kryształu, który w klasyfikacji minerałów odgrywa – w przeciwieństwie do struktury krystalicznej – pierwszorzędną rolę; nie przykładał on zatem większej wagi do obecności wici per se, lecz dostrzegł, że różnice w układzie wici u bakterii posiadających je korelują z fundamentalnymi różnicami w fizjologii. Jensen podzielił więc bakterie na dwa rzędy: Cephalotrichinae (monotrychalne, lofotrychalne lub bezwiciowe) oraz Peritrichinae (perytrychalne lub bezwiciowe). Do pierwszego z nich należały tlenowce występujące głównie w wodzie lub wilgotnej ziemi, nie rosnące obficie w tradycyjnych organicznych pożywkach i nie tworzące endospor; Peritrichinae z kolei charakteryzowały się bardziej wyspecjalizowanym metabolizmem i zaliczały się do nich najbardziej rozpowszechnione gatunki gnilne i pasożytnicze. Bakterie pobierające energię ze związków nieorganicznych uznane zostały przezeń za najprymitywniejsze, te pobierające ją z węglowodanów a azot ze związków nieorganicznych za drugie w kolejności, a formy wykorzystujące związki organiczne do pozyskiwania i energii, i azotu, za najbardziej zaawansowane ewolucyjnie. W oparciu o szczegółową analizę metabolizmu zostało w tej klasyfikacji wyróżnionych jedenaście rodzin[156]:
- Rząd Cephalotrichinae
- Rodzina Oxydobacteriaceae (Methanomonas, Carboxydomonas, Hydrogenomonas, Acetimonas, Nitrosomonas, Nitromonas, Azotomonas) – obligatoryjne tlenowce o zazwyczaj pałeczkowatym kształcie pobierające energię z prostych związków węgla, wodoru i azotu
- Rodzina Actinomycetes (Rhizomonas, Corynemonas, Mycomonas, Actinomyces) – nitkowate bakterie tworzące rozgałęzione struktury
- Rodzina Thiobacteriaceae (Sulfomonas, Thiomonas, Thiococcus, Thiospirillum) – bezbarwne bakterie siarkowe
- Rodzina Rhodobacteriaceae (Rhodomonas, Rhabdomonas, Rhododictyon, Amoebomonas, Rhodothece, Rhodopolycoccus, Lamprocystis, Rhodocystis, Rhodocapsa, Rhodosarcina, Rhodospirillum) – czerwone bakterie siarkowe
- Rodzina Trichobacteriaceae (Cladothrix, Crenothrix, Beggiatoa, Thiothrix, Leptothrix, Spirophyllum, Spirochaeta) – w większości żelazowe wodne bakterie tworzące filamenty
- Rodzina Luminibacteriaceae (Denitromonas, Liquidomonas, Liquidovibrio, Liquidococcus, Solidococcus) – fosforo- lub fluoroescencyjne bakterie denitryfikacyjne
- Rodzina Reducibacteriaceae (Solidovibrio, Spirillum) – formy spiralne, aktywnie rozkładające siarczany
- Rząd Peritrichinae
- Rodzina Acidobacteriaceae (Denitrobacterium, Bacterium, Poropionibacterium, Caseobacterium, Micrococcus, Sarcina) – tlenowce lub fakultatywne beztlenowce metabolizujące głównie węglowodany, tworząc kwasy
- Rodzina Alkalibacteriaceae (Liquidobacterium, Bacillus, Urobacillus) – tlenowce lub fakultatywne beztlenowce metabolizujące głównie związki azotu, tworząc amoniak
- Rodzina Butyribacteriaceae (Butyrobacillus, Pectobacillus, Cellulobacillus) – zdolne do tworzenia endospor beztlenowce metabolizujące głównie węglowodany, tworząc kwasy, zwłaszcza kwas masłowy
- Rodzina Putribacteriaceae (Putribacillus, Botulobacillus) – zdolne do tworzenia endospor beztlenowce metabolizujące głównie białka, powodując gnicie
Nazewnictwo bakterii, wówczas powszechnie zaliczanych do królestwa roślin, określały międzynarodowe zasady nomenklatury botanicznej (International Rules for Botanical Nomenclature) z 1910 r., których wiele nazw zaproponowanych przez Jensena nie spełniały[156]. W 1911 r. Ludwig Heim zaproponował podział na dwa rzędy: bakterii właściwych (Schizomycetes) i nitkowców (Trichomycetes)[170]; w 1912 r. Wilhelm Benecke uznawał rzędy: Desmobacterinae (bakterii pochewkowych) i Haplobacterinae (pozostałych)[181]; z kolei w 1913 r. Jean Paul Vuillemin stwierdził, że jedynie wyższe formy tworzące filamenty zasługują na miano odrębnego rzędu, który nazwał Microsiphonees[170]. Rok później Edwin O. Jordan stwierdził obecność dwu podstawowych problemów dotychczasowych klasyfikacji: istnienie nader obszernych rodzajów oraz trój-, cztero- a nawet pięcioczłonowych nazw systematycznych gatunków, takich jak Bacterium coli communis, Granulobacillus saccharobutryricus mobilis non-liquefaciens czy Micrococcus acidi paralactici liquefaciens Halensi. W związku z wynikającą nieprzejrzystością, a także z brakiem konsensu naukowego, organizacja amerykańskich biologów (Society of American Bacteriologists) powołała w 1920 r. komitet do spraw klasyfikacji bakterii, który, obok licznych innych propozycji, wyprodukował następujący podział na cztery rzędy[156]:
- Myxobacteriales o komórkach połączonych w ciągu fazy wegetatywnej w pseudoplazmodium, które przechodzi później w wyrafinowaną fazę produkcji cyst
- Thiobacteriales o komórkach wolnych lub tworzących filamenty, żyjących w wodzie, niełatwo kultywowanych, pobierających energię głównie z procesów utleniania, często zawierających siarkę lub purpurowe pigmenty i rozwijających się najlepiej w obecności siarkowodoru
- Chlamydobacteriales o komórkach tworzących filamenty, zazwyczaj posiadających osłonkę, niezawierających siarki ale, nierzadko, żelazo
- Eubacteriales o komórkach najmniej wyróżniających się i najmniej wyspecjalizowanych
W 1923 r. powstała pierwsza edycja Bergey's Manual, w której zastosowano opracowany w 1916 r. przez Roberta Buchanana podział na sześć rzędów: Eubacteriales, Chlamydobacteriales, Actinomycetales, Thiobacteriales, Myxobacteriales i Spirochaetales[170][182][180].
W 1925 r. Édouard Chatton powrócił do koncepcji Haeckla o istnieniu trzeciego królestwa (protistów), w obrębie którego za podstawowy uznał podział na jądrowce i bezjądrowce (wtedy równoważne z bakteriami), nie przypisując jednak tym grupom kategorii systematycznych[183]; rok później Bruno Schussnig również uznał przynależność bakterii do protistów (nazywanych przezeń Protophyta) w ramach dwu typów: Bacteriophyta i Cyanophyta (sinic)[184]. Jednakże już kilka lat wcześniej, w roku 1917 bakterie określone zostały – przez Günthera Enderleina – mianem odrębnego królestwa[185].
W 1933 r. Ernst August Pribram podzielił klasę bakterii na trzy podklasy: Algobacteria żyjące w wodzie, Eubacteria żyjące w organizmach zwierząt lub w odpadkach pochodzenia zwierzęcego bądź roślinnego oraz Mycobacteria występujące w glebie. Trzy lata później Albert Kluyver wraz z C. B. van Nielem opracowali podział na lofotrychalne pałeczki i im pokrewne (Pseudomonadaceae), perytrychalne pałeczki i im pokrewne (Mycobacteriaceae), bezwiciowe pałeczki niespokrewnione blisko z wiciowymi (Mycobacteriaceae) oraz ziarniaki (Micrococcaceae)[185].
W swojej klasyfikacji z 1938 r. Herbert Copeland uznawał bakterie za jedno z czeterech królestw (obok zwierząt, roślin wraz z grzybami oraz protistów)[186].
W piątej edycji Bergey’s Manual z 1939 r. został wprowadzony siódmy rząd – Caulobacteriales – do którego należał odkryty w 1935 r. rodzaj Caulobacter[182][187].
W latach sześćdziesiątych XX w. na znaczeniu zyskały takie metody jak chemotaksonomia, taksonomia numeryczna czy hybrydyzacja DNA z DNA. W 1962 r. Robert Stanier i C. B. van Niel, za namową A. Lwoffa, byłego ucznia Édouarda Chattona, wskazali na istnienie dwu podstawowych grup organizmów żywych z uwagi na obecność jądra komórkowego bądź jego brak[180]; 1968 r. Robert George Everitt Murray nazwał je odpowiednio: królestwem Eukaryotae i królestwem Prokaryotae (bakterii)[188][189]; w 1969 r. Robert Whittaker stworzył popularną klasyfikację pięciu królestw: zwierząt, roślin, grzybów, protistów i bakterii[190]. W 1972 bakterie zostały uznane za pełnoprawne królestwo w ósmej edycji Bergey’s Manual[180]. W 1977 r. Carl Woese zaproponował wydzielenie archeonów na podstawie badań sugerujących, iż są one przynajmniej równie od bakterii odrębne jak od eukariontów, co doprowadziło do powstania w 1990 r. klasyfikacji trzech domen[2][1][163] – do dziś kontrowersyjnej, gdyż niektóre badania wskazują na pochodzenie archeonów np. od Planctobacteria[191].
Od lat osiemdziesiątych do najczęściej stosowanych metod stosowanych przez systematyków należą: analiza genotypowa, MLSA (Multilocus Sequence Analysis), ANI (rodzaj miary podobieństwa średniego genów wspólnych) i analiza całego genomu[180].
| Bory de Saint Vincent, 1824 | Ehrenberg, 1830 | Ehrenberg, 1838 | Perty, 1852 | Haeckel, 1878 | Van Tieghem, 1884 | Engler, 1892 | Haeckel, 1894 | Enderlein, 1917 | Schussnig, 1925 | Copeland, 1938 | Woese i inni, 1990 | Ruggiero i inni, 2015 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nadkrólestwo lub domena | Bacteria | Prokaryota | |||||||||||
| Królestwo | Animal | Animalia | Animalia | Animalia | Protista | Végétal | Pflantzen | Protista | Mychota | Protophyta | Monera | Bacteria | |
| Podkrólestwo | Archezoa | ||||||||||||
| Typ, gromada lub Hauptgruppe | Thallophytes | Euthallophyta | Archezoa | Bacteriophyta | |||||||||
| Podtyp lub podgromada | Schizophyta | ||||||||||||
| Phytozoa | Phytozoa | ||||||||||||
| Gromada lub klasa | Microscopiques | Polygastrica | Polygastrica | Infusoria | Monera | Algues | Bacteria | ||||||
| Rząd | Gymnodés | Anentera | Anentera | Phytozoida | Tachymonera | Cyanophycées | |||||||
| Gymnica | |||||||||||||
| Sekcja sensu Perty | Lampozoida | ||||||||||||
| Rodzina | Vibrionides | Epitricha | Vibrionia | ||||||||||
| Sekcja sensu Ehrenberg | Vibrionia | ||||||||||||
| Rodzaje | Vibrio, Melanella |
Obecna systematyka
Ze względów historycznych termin „bakterie” bywa rozumiany nieprecyzyjnie. Tradycyjnie (mniej więcej do połowy XX w.) obejmował wszystkie prokarionty z wyjątkiem sinic, zaliczanych do glonów. Już jednak w systemie Ernsta Haeckla grupa Moneres została włączona do odrębnego od roślin i zwierząt królestwa Protista. System ten jednak nie zyskał powszechnej akceptacji, a bakterie traktowane były jak specyficzne rośliny zarodnikowe[192], a mikrobiologia (zwłaszcza w zakresie niezwiązanym bezpośrednio z medycyną) jak gałąź botaniki.
Przez długi czas uważano, że główna linia podziału bezjądrowców znajduje się między typowymi bakteriami (nazywanymi wówczas po prostu „bakteriami”) a sinicami. Dopiero w drugiej połowie XX w. odkryto, że istotniejsze różnice mogą występować między typowymi bakteriami, z sinicami włącznie, a tzw. „archebakteriami”. Nazwa „archebakterie” sugeruje, że są one najstarszą ewolucyjnie zachowaną gałęzią bakterii, gdyż odkryto je w ekstremalnych środowiskach, przypominających pod pewnymi względami warunki pierwotnej Ziemi. Obecnie uważa się inaczej, w związku z czym częściej stosuje się nazwę „archeony”; jednakże niektóre badania wskazują na pochodzenie archeonów np. od Planctobacteria i część naukowców uważa, iż termin „bakterie” winien się również do nich odnosić[191].
Według „systematyki pięciu królestw” wszystkie prokarionty zgrupowano w jedno królestwo Monera z dwoma podkrólestwami: Eubacteria (czyli „bakterie właściwe”) i Archaea (archeony), a sinice zaliczono do tych pierwszych jako niższy takson.
Dokładniejsze badania na poziomie molekularnym zasugerowały, że z ewolucyjnego punktu widzenia archeony są równie odległe od reszty prokariontów, jak od eukariontów, a pod pewnymi względami nawet bliższe tym ostatnim. Spowodowało to zaproponowanie „systematyki trzech domen”, według której „bakterie właściwe” stanowią jedną z domen, obok archeonów i eukariontów. W takim ujęciu słowo „bakteria” powinno odnosić się do podkrólestwa Eubacteria, równoważnego z domeną Bacteria. Należy jednak zaznaczyć, że nie wszyscy naukowcy zgadzają się z taką interpretacją, wskazują na błędy w interpretacji danych molekularnych i uważają, że termin „bakterie” winien być używany także wobec archeonów.
Nie istnieje oficjalna systematyka prokariontów, choć można się spotkać z przekonaniem, że jest nią Bergey’s Manual jako używana najszerzej i będąca podstawą wielu innych; podobny status – w zakresie nazewnictwa bakterii – przypisywany bywa Approved List of Bacterial Names[193]. Jednakże istnieje wiele klasyfikacji i różne synonimiczne nazwy taksonów, z których żadnej nie można uznać za błędną – w końcu systematyka jest w dużej mierze kwestią opinii, pokrewieństwa wciąż pozostają w wielu przypadkach nierozstrzygnięte, a zdecydowana większość gatunków bakterii nie została jeszcze poznana[193]. Wśród istotniejszych klasyfikacji bakterii można wymienić:
- Bergey’s Manual of Systematics of Archaea and Bacteria (BMSAM) stanowiąca istotną pracę źródłową również w kwestii ekologii, fizjologii i innych biologicznych właściwości wszystkich opisanych taksonów prokariontów, poprzedzona przez Bergey’s Manual of Systematic Bacteriology i Bergey’s Manual of Determinitive Bacteriology[194];
- List of Prokaryotic names with Standing in Nomenclature (LPSN) na bieżąco uaktualniana i udoskonalana na stronie internetowej[195];
- NCBI Taxonomy na bieżąco uaktualniana i udoskonalana, obejmująca również wszystkie inne organizmy (komórkowe i bezkomórkowe)[196];
- A complete domain-to-species taxonomy for Bacteria and Archaea (Parks i inni, 2020) uwzględniająca metagenomy i tym samym uznająca wiele nienazwanych jeszcze oficjalnie taksonów, dostępna na stronie GTDB[197];
- A Higher Level Classification of All Living Organisms (Ruggiero i inni, 2015) obejmująca również wszystkie inne organizmy żywe (poza kontrowersyjną grupą organizmów bezkomórkowych)[198];
- Revised higher classification of kingdom Eubacteria and its four subkingdoms and 14 phyla zawarta w pracy Multidomain ribosomal protein trees and the planctobacterial origin of neomura (eukaryotes, archaebacteria) (Cavalier-Smith i Chao, 2020), poprzedzona przez klasyfikacje zawarte w pracach Cavalier-Smitha: 1992b, 2002a i 2006a[199][200][201][191].
Zasady nazewnictwa taksonów bakteryjnych do 1975 r. były takie jak w przypadku roślin i grzybów. Od tego roku obowiązuje odrębny, Międzynarodowy Kodeks Nomenklatury Bakterii (ang. The International Code of Nomenclature of Bacteria, ICNB). Wszystkie uznawane za poprawne nazwy naukowe bakterii, po weryfikacji ich poprawności wobec zasad określonych w kodeksie, umieszczane są na liście „Approved Lists of Bacterial Names” i publikowane w czasopiśmie „International Journal of Systematic and Evolutionary Microbiology”[202]. Celem kodyfikacji nomenklatury naukowej bakterii jest stworzenie stabilnego systemu nazewnictwa, pozwalającego na unikanie nieporozumień i dublowanie nazw. Zgodnie z kodeksem (reguła 5b ICNB) bakterie dzielone są na 5 kategorii: gatunki (species), rodzaje (genus), rodziny (familia), rzędy (ordo) i klasy (classis). Podział może być uszczegóławiany poprzez dodawanie kategorii pomocniczych: podgatunek, podrodzina, plemię i podplemię, podrząd i podklasa. Odmiana (varietas) w nomenklaturze bakteryjnej jest synonimem podgatunku. Skutkiem wywodzenia się nomenklatury bakteryjnej z botanicznej jest wiele podobieństw, np. identyczne typowe końcówki nazw dla taksonów odpowiednich rang systematycznych jak u protistów roślinopodobnych zgodnie z Międzynarodowym Kodeksie Nomenklatury Botanicznej, zapis kursywą nazw naukowych różnych rang systematycznych[203]. Zgodnie z dziewiątą zasadą Bacteriological Code, nazwy taksonów od rzędu do plemienia tworzy się poprzez dodanie do rdzenia nazwy rodzaju typowego odpowiedniego przyrostka; dodatkowo w 1997 r. Stackebrant i inni zaproponowali końcówki dla klas i podklas, a Whitman i inni w 2018 r. – dla typów; przy uwzględnieniu tych sugestii można więc wymienić następujące przyrostki: -ota (dla typów) -ia (dla klas), -idae (dla podklas), -ales (dla rzędów), -ineae (dla podrzędów), -aceae (dla rodzin), -oideae (dla podrodzin), -eae (dla plemion) oraz -inae (dla podplemion)[203][204][205].

Chociaż istnieją wskazania dotyczące nomenklatury bakterii, określanie kategorii systematycznych jest w dużej mierze subiektywne, a nie oparte na jakichkolwiek szczegółowych kryteriach, choć często przyjmowanym warunkiem przynależności organizmów do jednego gatunku jest hybrydyzacja między ich DNA na poziomie 70%, ANI (rodzaj miary podobieństwa średniego genów wspólnych) na poziomie 95% oraz podobieństwo genu kodującego 16S rRNA na poziomie 98,7% (alternatywnie 99% lub 99,5%)[206][207]. Przeprowadzone w 2014 r. badania na podstawie zestawu sekwencji genu kodującego 16S rRNA ponad 8 tys. klasyfikowanych gatunków bakterii (i archeonów) pokazały, że jego podobieństwo na poziomie przynajmniej 94,8% oznaczało przynależność do jednego rodzaju, 87,65% – rodziny, 83,55% – rzędu, 80,38% – klasy, a 77,43% – typu; wziąwszy pod uwagę przedział ufności, autorzy pracy postanowili zaproponować następujące kryteria podobieństwa genu 16S rDNA dwu różnych organizmów (nie zmieniając przyjętych dla gatunku 98,7%) dla uznania ich przynależności do jednego taksonu o randze[206]:
- rodzaju – 94,5%,
- rodziny – 86,5%,
- rzędu – 82,0%,
- klasy – 78,5%,
- typu – 75,0%.
Co ciekawe, zastosowanie tych kryteriów dla ogólnodostępnej bazy rRNA – SILVA – umożliwiło wykrycie 1,3 tys. typów, 2,2 tys. klas, 4,2 tys. rzędów, 61 tys. rodzajów i 210 tys. gatunków – wielokrotnie więcej niż było znanych nauce. Jednakże w związku ze spadkiem w liczbie rocznie wykrywanych gatunków pomimo stale rosnącej liczby sekwencji, wysunięto przypuszczenie, iż całkowita liczba gatunków mieści się – wbrew wielu wcześniejszym spekulacjom – w granicach od 400 tys. do 2 mln[206].
Warto jednak wspomnieć, że nie wszyscy naukowcy przychylni są definowaniu kategorii systematycznych jedynie na podstawie badań genetycznych; Thomas Cavalier-Smith nazwał je fałszywie obiektywnym, uznając, że skala podobieństwa genetycznego nie ma bezpośredniego przełożenia na różnice w budowie ani większego znaczenia ewolucyjnego[191].
W zależności od klasyfikacji, uznaje się od zaledwie kilkunastu do ponad stu typów bakterii. Poniższa tabelka zawiera ogólnikowe opisy najważniejszych z nich oraz stanowi porównanie ich nazewnictwa i przynależności w obrębie czterech klasyfikacji.:
takson nie budzący wątpliwości grupa nieuwzględniona w danej klasyfikacji w większości Gram-dodatnie w większości Gram-ujemne
Filogeneza
Drzewo filogenetyczne bakterii wciąż stanowi w dużej mierze zagadkę; monofiletyzm wielu taksonów wysokiej rangi jest wątpliwy, a wciąż odkrywane są nowe ugrupowania o niepewnej pozycji systematycznej. Do ważniejszych opublikowanych w ostatnich latach na ten temat prac należą: Ciccarelli i innych z 2006 r. zawierająca propozycję zautomatyzowanej procedury ustalania pokrewieństw[20], Battistuzzi i Hedgesa z 2008 r. przedstawiająca dowody na istnienie dwu znacznych ugrupowań monofiletycznych (Terrabacteria i Hydrobacteria) zaproponowanych przez Battistuzzi, Feijao i Hedgesa w roku 2004[126], Lang, Darlinga i Eisena z 2013 r. obejmująca kilka drzew skonstruowanych różnymi metodami (w tym nowymi)[21], Browna i innych z 2015 r. dotycząca domniemanego kladu Patescibacteria siostrzanego dla grupy pozostałych bakterii i możliwie obejmującego nawet 250 typów a nieposiadającego żadnego wyizolowanego przedstawiciela[253], Hug i innych z 2016 r. uwzględniająca grupy znane jedynie z metagenomów (m.in. Patescibacteria) przy ustalaniu pokrewieństw wszystkich organizmów (z naciskiem na prokarionty)[254], Carnevali i innych z 2019 r. skupiona przede wszystkim na sinicach i ich krewnych[255], Zhu i innych z 2019 r. zawierająca drzewo skonstruowane na podstawie ponad 10 tys. genomów (w tym metagenomów)[256] oraz Cavalier-Smitha i Chao z 2020 r. wskazująca na pochodzenie archeonów i eukariontów bezpośrednio od bakterii[191]. Rolę odgrywa też drzewo opracowywane przez SILVA[257], jak również 'The All-Species Living Tree’ Project[258].
Poniższy kladogram oparty jest głównie na pracy Hug i innych z 2016 r.[254]; dla uproszczenia nie został jednak uwzględniony klad Patescibacteria ani inne znane jedynie z metagenomów, a ujętymi grupami są wyłącznie typy zawarte w BMSAB[194] oraz nieuwzględnione tam grupy Armatimonadetes, Caldisericia, Elusimicrobia i Melainabacteria. W przypadkach, gdy kilka typów potraktowanych zostało zbiorowo w źródłowym kladogramie bez opisania pokrewieństwa między nimi, zostały użyte prace: Zhu i innych oraz Carnevali i innych z 2019 r.[256][255]
Oxybacteria Armatimonadetes Firmicutes (+ Tenericutes) Chloroflexi (+ Thermomicrobia) Actinobacteria Synthermota, Hadobacteria, Fusobacteria Aquificae Sphingobacteria Planctobacteria Thermodesulfobacteria Proteobacteria (sensu Cavalier-Smith) Spirochaetes
|
(Archaea + Eukaryota) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Alternatywna propozycja z 2020 r. autorstwa Cavalier-Smitha i Chao, w ramach której archeony i eukarionty wywodzą się bezpośrednio od bakterii została przedstawiona – bez żadnych zmian, gdyż uwzględnia ona wszystkie grupy użyte w kladogramie i tylko te grupy – poniżej[191].
Oxybacteria Armatimonadetes Firmicutes (+ Tenericutes) Chloroflexi (+ Thermomicrobia) Actinobacteria Synthermota, Hadobacteria, Fusobacteria Aquificae Sphingobacteria Planctobacteria Thermodesulfobacteria Proteobacteria (sensu Cavalier-Smith) Spirochaetes
| Bacteria |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Współżycie z innymi organizmami

Bakterie niejednokrotnie żyją z innymi organizmami. Ich stosunkowo prosta budowa mimo wszystko pozwala im stworzyć bardziej skomplikowanej struktury, z innymi bakteriami (biofilm), lecz znacznie korzystniejsze jest jej utworzenie razem z innymi organizmami. Te różnorodne sposoby współżycia mogą być antagonistyczne i nieantagonistyczne. Wśród najczęściej występujących stosunków międzygatunkowych są symbioza (mutualizm), pasożytnictwo i komensalizm. Bakterie są bardzo małe, co pozwala im na występowanie w dużej ilości w biotopie. Dotyczy to zwłaszcza komensali, które żyją na wszystkich roślinach i zwierzętach, łącznie z ludźmi, u których powodują rozkład niektórych składników potu, przez co ma on charakterystyczny zapach, podobnie jak reszta ciała ludzkiego.
Symbioza
Pewne bakterie nie są w stanie przetrwać w izolacji, podobnie jak organizmy w których żyją (np. człowiek). Ta interakcja międzygatunkowa charakteryzuje się czerpaniem obustronnych korzyści przez organizmy. Jednym ze szczególnych powiązań mutualitycznych jest współżycie bakterii z Archaea. Beztlenowe bakterie potrzebują kwasów organicznych, takich jak kwas masłowy czy kwas propionowy. Produkują natomiast wodór, który jest zużywany przez archeony metanogenowe[259]. Co więcej, gdyby bakterie te nie współżyły z Archaea, byłoby to niekorzystne nie tylko dla archeonów (które nie miałyby zapewnionej podaży wodoru), ale również dla samych bakterii, gdyż wysokie stężenie tego pierwiastka jest dla nich toksyczne. Tak więc, gdyby nie było organizmów zużywających wodór, bakterie te nie mogłyby się prawidłowo rozwijać i rozmnażać.
Niektóre drobnoustroje żyjące w ryzosferze przeprowadzają wiązanie azotu cząsteczkowego, przekształcając azot z postaci gazowej w związki chemiczne złożone także z innych pierwiastków[260]. Jest to istotny proces dla roślin oraz organizmów z wyższych poziomów troficznych, gdyż jest to podstawowy sposób przekształcania azotu atmosferycznego w postacie zdatne do asymilacji biologicznej. Współżycie bakterii i roślin określa się bakterioryzą. Wiele innych bakterii znaleziono u zwierząt, np. w ludzkim organizmie jest ich około 1000 gatunków, zwłaszcza w jelitach, gdzie tworzą florę bakteryjną. Pełnią one wiele ważnych funkcji, bez których człowiek nie mógłby żyć. Produkują (syntezują) wiele witamin, w tym witaminę K, kwas foliowy, biotynę. Oprócz tego przetwarzają białka znajdujące się w mleku w kwas mlekowy (głównie Lactobacillus) oraz rozkładają złożone węglowodany do prostszych związków chemicznych[261][262][263]. Obecność tej flory utrudnia rozwój patogenów (głównie na skutek konkurencji, zgodnie z zasadą Gausego) i z tego powodu są one jednymi z najważniejszych probiotyków zalecanych jako suplement diety[264].
Patogenność
Jeżeli bakterie szkodzą innym organizmom, wywołując u nich chorobę, określa się je mianem patogenów. Infekcje bakteryjne (bakteriozy) są jedną z przyczyn zgonów ludzi. Wywołują one, między innymi, kiłę, rzeżączkę, dur brzuszny, trąd, cholerę, dżumę, gruźlicę oraz odpowiadają za niektóre zatrucia pokarmowe. Mimo to nie każda bakteria może od razu wywołać infekcję. Wiele bakterii, na przykład Helicobacter pylori, występuje u wielu ludzi, ale tylko czasami ta obecność skutkuje chorobą. Mimo to nosiciele tej bakterii muszą uważać, gdyż zwiększa ona szanse na wystąpienie innych problemów zdrowotnych (np. choroby wrzodowej). Poza tym bakterie mogą także atakować rośliny, co jest powodem wielkich strat w rolnictwie. Mogą one wywołać raka bakteryjnego, zarazę ogniową, kanciastą plamistość, guzowatość korzeni. Atakują też zwierzęta, przez co dodatkowo zagrażają rolnictwu, gdyż mogą wywołać choroby zwierząt gospodarskich (chorobę Johna, mastitis, salmonellozę).
Każdy gatunek bakterii ma charakterystyczne „spektrum” działania na gospodarza. Gronkowiec lub paciorkowiec może np. spowodować infekcję skóry, zapalenie płuc, zapalenie opon mózgowych, a nawet spowodować sepsę, czyli odpowiedź układu immunologicznego (odpornościowego), o bardzo gwałtownym przebiegu, którego skutkiem jest wstrząs i wazodylatacja (zwiotczenie mięśni wokół naczyń krwionośnych), co prowadzi do śmierci organizmu[265]. Dodatkowo wiele bakterii mogących powodować chorobę ustroju przebywa w jelicie, składając się na jego florę, ale nie wywołując infekcji. Istnieją też mikroorganizmy, które niezmiernie rzadko powodują chorobę lub takie, które rzadko pojawiają się w organizmie, jak riketsje, które są pasożytami wewnętrznymi. Jedną z chorób wywoływanych przez riketsje (riketsjoz), czasem uznawaną za najgroźniejszą z tej grupy, jest tyfus plamisty. Inne gatunki mogą wywoływać tyfus plamisty Gór Skalistych, gorączkę okopową i kilka innych chorób. Wśród chlamydii, gromady bakterii będących pasożytami wewnętrznymi, znajduje się gatunek wywołujący u ludzi jeden z typów zapalenia płuc (Chlamydophila pneumoniae) albo zapalenie układu moczowego. Mogą one w skrajnych przypadkach wywoływać nawet chorobę wieńcową serca[266]. W końcu gatunki takie jak Pseudomonas aeruginosa, Burkholderia cenocepacia i Mycobacterium avium są jedną z przyczyn zakażenia oportunistycznego, wywoływanego przez potencjalnie niegroźne bakterie, mogące jednak zbytnio namnożyć się przy osłabionej odporności, czyli u ludzi dotkniętych immunosupresją lub mukowiscydozą[267][268].

W przypadku infekcji spowodowanej przez bakterie bardzo często do ich zwalczania stosuje się antybiotyki, które mają działanie bakteriobójcze, jeżeli zabijają bakterie lub bakteriostatyczne, jeżeli ich działanie polega na uniemożliwianiu ich prawidłowego wzrostu i rozmnażania. Istnieje bardzo wiele rodzajów antybiotyków, ale każdy jest inhibitorem dla jakiegoś procesu przeprowadzanego tylko przez komórki bakteryjne. Na przykład istnieją antybiotyki o silnej toksyczności, takie jak chloramfenikol lub puromycyna, które działają jednak tylko na rybosomy bakterii, a nie na komórki eukariontów[269]. Antybiotyki są jednak stosowane nie tylko w przypadku ludzi, ale także przy chorobach i profilaktyce zwierząt gospodarczych, co niejednokrotnie może im zaszkodzić, a dodatkowo zwiększa szansę na uodpornienie się szczepu[270]. Rozwojowi bakterii można zapobiegać przez zabiegi antyseptyczne, w tym sterylizację miejsca planowanego nakłucia przed zrobieniem zastrzyku, oraz staranne oczyszczenie samej igły. Również przyrządy stomatologiczne są odpowiednio czyszczone przed wykonaniem zabiegu, by uniknąć możliwości przeniesienia na ich powierzchni patogenów na innych ludzi. Środki do dezynfekcji, na przykład alkohol etylowy, stosowane są, by usunąć wszelkie bakterie z jakiejś powierzchni i zarazem zmniejszyć ryzyko infekcji.
Znaczenie bakterii w przemyśle

Bakterie, między innymi Lactobacillus znajdujące się w mleku po dodaniu do drożdży, są stosowane od tysięcy lat przy wytwarzaniu różnych produktów spożywczych (kiszonej kapusty, sera, sosu sojowego, wina, octu, jogurtu)[117][271][272].
Zdolność bakterii do degradacji (rozkładania) wielu związków organicznych jest niezwykle przydatna dla człowieka i z tego powodu są one wykorzystywane w przemyśle i gospodarce. Mikroorganizmy zdolne do rozkładania węglowodorów są używane do likwidacji wycieków ropy naftowej lub innych olejów z tankowców, dzięki czemu ułatwiają usuwanie skutków wielu katastrof ekologicznych[273]. Przykładem zastosowania bioremediacji była likwidacja wylewu ropy do morza przy Zatoce Księcia Williama po katastrofie tankowca Exxon Valdez w 1989 roku. Bakterie zostały użyte, by zwiększyć skuteczność usuwania skutków katastrofy ekologicznej. Dodatkowo rozrzucono je także na plażach, gdzie były w stanie zutylizować ropę, która wsiąkła w piasek. Stosuje się je także do unieszkodliwiania toksycznych odpadów przemysłowych[274]. W przemyśle chemicznym bakterie są bardzo ważne przy produkcji enancjomerów oraz wytwarzaniu czystych substancji chemicznych, mających służyć jako środki do wytwarzania leków lub agrochemikaliów[275].
Bakterie mogą również zostać użyte do biologicznego zwalczania szkodników w miejsce pestycydów. Zwykle używa się Bacillus thuringiensis (zwaną również BT), Gram-dodatnią bakterię, która występuje w glebach. Jej podgatunki są używane do zwalczania gąsienic motyli. Są one składnikiem środków, takich jak Dipel i Thuricide[276]. Z powodu nietoksycznych składników oraz zastosowania bakterii groźnych tylko dla niektórych organizmów są one bezpieczne dla środowiska. Bardzo rzadko dochodzi do sytuacji, w której środki te mogą zaszkodzić ludziom lub zwierzętom pożytecznym oraz samym roślinom[277][278].
Z powodu zdolności bakterii do szybkiego wzrostu są one cennym obiektem badań molekularnych. Przez modyfikowanie ich struktury genetycznej i sprawdzeniu, jak zmiany te kształtują fenotyp populacji, naukowcy mogą sprawdzić, jakie geny, enzymy i funkcje metabolityczne charakteryzują poszczególne bakterie oraz jak je zmieniać. Wiedzę tę można użyć przy modyfikowaniu bardziej złożonych organizmów, np. roślin lub zwierząt[279]. Dzięki temu można zrozumieć dokładniej, jak bardzo złożony jest świat żywych organizmów i jak proste pierwiastki były w stanie stworzyć życie[280][281]. Poznanie tych funkcji umożliwia także bioinżynierii produkcję insuliny, witamin, przeciwciał oraz innych substancji[282][283]. Są one wytwarzane po modyfikacji genetycznej bakterii, która na podstawie nowych genów produkuje np. hormony.
Uwagi
- ↑ Rodzina Vibrionides Bory de Saint Vincent, 1824 obejmowała w większości organizmy nieprzynależące do bakterii, którym jednakże odpowiadały rodzaje: Vibrio oraz Melanella (Bacterium + Spirillum). Przypisy obok.
- ↑ Sekcja ⟨łac. sectio⟩ – kategoria systematyczna w tym kontekście nadrzędna wobec rodzaju a podrzędna wobec rodziny, choć we współczesnej bakteriologii nadrzędna wobec gatunku a podrzędna wobec rodzaju.
- ↑ Będących pałeczkami niezdolnymi do tworzenia endospor.
- ↑ Perty (słusznie) kwestionował przynależność rodzaju Spirodiscus do bakterii, argumentując, iż może on skupiać zarodniki grzybów.
- ↑ Liczba widniejąca na stronie internetowej GTDB będąca wynikiem łączenia grup o jednakowych nazwach różniących się jedynie dodatkową literą (np. Verrucomicrobia z Verrucomicrobia A), przypis obok.
- ↑ Większość poniższych opisów czerpie z przypisu obok; ewentualne inne źródła również są podane; przypisy dotyczą również koloru komórki.
- ↑ Abyssubacteria, Aureabacteria, Bdellovibrionta C, Bdellovibrionta D, Bipolaricaulota, Caldatribacteriota, Calescibacteriota, Delongbacteria, Desantisbacteria, Desulfobacterota B, Desulfobacterota C, Desulfobacterota D, Dormibacterota, Edwardsbacteria, Eisenbacteria, Fermentibacterota, Firestonebacteria, Firmicutes G, Gemmatimonadota A, Goldbacteria, Krumholzibacteriota, Lindowbacteria, Marinisomatota, Moduliflexota, Muirbacteria, Myxococcota A, Myxococcota B, Nitrospinota A, Nitrospinota B, Patescibacteria, Riflebacteria, Schekmanbacteria, Sumerlaetota, Tectomicrobia, Thermodesulfidobacterota, Wallbacteria, Zixibacteria, 4572-55, AABM5-125-24, ARS69, B130-G9, B64-G9, BMS3Abin14, CG03, CG2-30-53-67, CG2-30-70-394, CSP1-3, CSSED10-310, DTU030, FCPU426, FEN-1099, GCA-001730085, J088, KSB1, NPL-UPA2, OLB16, RBG-13-66-14, RUG730, SAR324, SLNR01, SURF-8, SZUA-182, SZUA-79, T1SED10-198M, TA06, TA96 A, UBA10199, UBA2233, UBA3054, UBA6262, UBA9089, UBP13, UBP14, UBP15, UBP17, UBP18, UBP4, UBP6, UBP7, UBP7 A, WOR-3.
Przypisy
- ↑ a b c Woese CR., Kandler O., Wheelis ML. Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya. „Proceedings of the National Academy of Sciences of the United States of America”. 87 (12), s. 4576–4579, 1990. DOI: 10.1073/pnas.87.12.4576. PMID: 2112744. PMCID: PMC54159.
- ↑ a b c d Woese CR., Fox GE. Phylogenetic structure of the prokaryotic domain: the primary kingdoms. „Proceedings of the National Academy of Sciences of the United States of America”. 74 (11), s. 5088–5090, 1977. DOI: 10.1073/pnas.74.11.5088. PMID: 270744. PMCID: PMC432104.
- ↑ Alessandro Minelli, Biological Systematics, Dordrecht: Springer Netherlands, 1994, s. 218–219, DOI: 10.1007/978-94-011-9643-7, ISBN 978-0-412-62620-3 [dostęp 2021-04-15] (ang.).
- ↑ Stefan Luketa, New views on the megaclassification of life, „Protistology”, 7 (14), 2012, s. 218–237 (ang.).
- ↑ a b c Nicholas A. Lyons, Roberto Kolter, On The Evolution of Bacterial Multicellularity, „Current opinion in microbiology”, 24, 2015, s. 21–28, DOI: 10.1016/j.mib.2014.12.007, ISSN 1369-5274, PMID: 25597443, PMCID: PMC4380822 [dostęp 2021-03-11].
- ↑ H.N. Schulz, B.B. Jorgensen. Big bacteria. „Annu Rev Microbiol”. 55, s. 105–137, 2001. DOI: 10.1146/annurev.micro.55.1.105. PMID: 11544351.
- ↑ J.K. Fredrickson, J.M. Zachara, D.L. Balkwill, D. Kennedy i inni. Geomicrobiology of High-Level Nuclear Waste-Contaminated Vadose Sediments at the Hanford Site, Washington State. „Applied and Environmental Microbiology”. 70 (7), s. 4230–4241, lipiec 2004. DOI: 10.1128/AEM.70.7.4230-4241.2004. PMID: 15240306. [dostęp 2008-08-30].
- ↑ Whitman WB., Coleman DC., Wiebe WJ. Prokaryotes: the unseen majority. „Proceedings of the National Academy of Sciences of the United States of America”. 95 (12), s. 6578–6583, czerwiec 1998. PMID: 9618454.
- ↑ Rappé MS., Giovannoni SJ. The uncultured microbial majority. „Annual Review of Microbiology”. 57, s. 369–394, 2003. DOI: 10.1146/annurev.micro.57.030502.090759. PMID: 14527284.
- ↑ Porter JR., van Leeuwenhoek A. Antony van Leeuwenhoek: tercentenary of his discovery of bacteria. „Bacteriological Reviews”. 40 (2), s. 260–269, czerwiec 1976. PMID: 786250.
- ↑ Anthony Leewenhoeck. An Abstract of a Letter from Mr. Anthony Leewenhoeck at Delft, Dated Sep. 17. 1683. Containing Some Microscopical Observations, about Animals in the Scurf of the Teeth, the Substance Call’d Worms in the Nose, the Cuticula Consisting of Scales. „Philosophical Transactions”. 14, s. 568–574, 1684. Royal Society Publishing. DOI: 10.1098/rstl.1684.0030. [dostęp 2008-11-22].
- ↑ a b Online Etymology Dictionary. [dostęp 2008-09-03].
- ↑ Louis Pasteur, Jourbert Chamberland. The Germ Theory and Its Applications to Medicine and Surgery. „Comptes Rendus de l’ Academie des Sciences”. lxxxvi, s. 1037–1043, 1878-04-29. [dostęp 2008-09-03].
- ↑ The Nobel Prize in Physiology or Medicine 1905. [dostęp 2008-09-03].
- ↑ O’Brien SJ., Goedert JJ. HIV causes AIDS: Koch’s postulates fulfilled. „Current Opinion in Immunology”. 8 (5), s. 613–618, październik 1996. PMID: 8902385.
- ↑ Thurston AJ. Of blood, inflammation and gunshot wounds: the history of the control of sepsis. „The Australian and New Zealand Journal of Surgery”. 70 (12), s. 855–861, 2000. DOI: 10.1046/j.1440-1622.2000.01983.x. PMID: 11167573.
- ↑ Schwartz RS., Ehrlich P. Paul Ehrlich’s magic bullets. „The New England Journal of Medicine”. 350 (11), s. 1079–1080, 2004. DOI: 10.1056/NEJMp048021. PMID: 15014180.
- ↑ Amanda Yarnell. Salvarsan. „Chemical & Engineering News”. 83 (25), 20 czerwca 2005.
- ↑ Paul Ehrlich: The Nobel Prize in Physiology or Medicine 1908. Nobelprize.org. [dostęp 2008-09-05]. (ang.).
- ↑ a b F.D. Ciccarelli, Toward Automatic Reconstruction of a Highly Resolved Tree of Life, „Science”, 311 (5765), 2006, s. 1283–1287, DOI: 10.1126/science.1123061, ISSN 0036-8075 [dostęp 2021-03-10] (ang.).
- ↑ a b Jenna Morgan Lang, Aaron E. Darling, Jonathan A. Eisen, Phylogeny of Bacterial and Archaeal Genomes Using Conserved Genes: Supertrees and Supermatrices, „PLOS One”, 8 (4), 2013, e62510, DOI: 10.1371/journal.pone.0062510, ISSN 1932-6203, PMID: 23638103, PMCID: PMC3636077 [dostęp 2021-03-10] (ang.).
- ↑ Piero Cammarano i inni, The Archaea Monophyly Issue: A Phylogeny of Translational Elongation Factor G(2) Sequences Inferred from an Optimized Selection of Alignment Positions, „Journal of Molecular Evolution”, 49 (4), s. 524–537, ISSN 0022-2844 [dostęp 2021-03-10] (ang.).
- ↑ Evolution: Two Domains of Life or Three?, „Current Biology”, 30 (4), 2020, R177–R179, DOI: 10.1016/j.cub.2020.01.010, ISSN 0960-9822 [dostęp 2021-03-10] (ang.).
- ↑ E. Mayr, Two empires or three?, „Proceedings of the National Academy of Sciences of the United States of America”, 95 (17), 1998, s. 9720–9723, DOI: 10.1073/pnas.95.17.9720, ISSN 0027-8424, PMID: 9707542 [dostęp 2021-03-10].
- ↑ Thomas Cavalier-Smith, The Neomuran Revolution and Phagotrophic Origin of Eukaryotes and Cilia in the Light of Intracellular Coevolution and a Revised Tree of Life, „Cold Spring Harbor Perspectives in Biology”, 6 (9), 2014, a016006, DOI: 10.1101/cshperspect.a016006, ISSN 1943-0264, PMID: 25183828 [dostęp 2021-03-10] (ang.).
- ↑ James A. Lake i inni, Genome beginnings: rooting the tree of life, „Philosophical Transactions of the Royal Society B: Biological Sciences”, 364 (1527), 2009, s. 2177–2185, DOI: 10.1098/rstb.2009.0035, ISSN 0962-8436, PMID: 19571238, PMCID: PMC2873003 [dostęp 2021-03-16] (ang.).
- ↑ Ruben E. Valas, Philip E. Bourne, The origin of a derived superkingdom: how a gram-positive bacterium crossed the desert to become an archaeon, „Biology Direct”, 6, 2011, s. 16, DOI: 10.1186/1745-6150-6-16, ISSN 1745-6150, PMID: 21356104, PMCID: PMC3056875 [dostęp 2021-03-16].
- ↑ Emmanuel G. Reynaud, Damien P. Devos, Transitional forms between the three domains of life and evolutionary implications, „Proceedings. Biological Sciences”, 278 (1723), 2011, s. 3321–3328, DOI: 10.1098/rspb.2011.1581, ISSN 1471-2954, PMID: 21920985, PMCID: PMC3177640 [dostęp 2021-03-16].
- ↑ FrankG. Rodgers i inni, Intercellular structure in a many-celled magnetotactic prokaryote, „Archives of Microbiology”, 154 (1), 1990, DOI: 10.1007/BF00249172, ISSN 0302-8933 [dostęp 2021-03-11] (ang.).
- ↑ Carolina N. Keim i inni, Multicellular life cycle of magnetotactic prokaryotes, „FEMS Microbiology Letters”, 240 (2), 2004, s. 203–208, DOI: 10.1016/j.femsle.2004.09.035, ISSN 0378-1097 [dostęp 2021-03-11] (ang.).
- ↑ a b Fernanda Abreu i inni, ‘Candidatus Magnetoglobus multicellularis’, a multicellular, magnetotactic prokaryote from a hypersaline environment, „International Journal of Systematic and Evolutionary Microbiology”, 57 (6), 2007, s. 1318–1322, DOI: 10.1099/ijs.0.64857-0, ISSN 1466-5026 [dostęp 2021-03-10].
- ↑ Masashi Yamaguchi, Cedric O’Driscoll Worman, Deep-sea microorganisms and the origin of the eukaryotic cell, „Japanese Journal of Protozoology”, 47 (1, 2), web.archive.org, 2014 [dostęp 2021-03-11] [zarchiwizowane z adresu 2017-08-09].
- ↑ Marc Facciotti, Cellular Structure of Bacteria and Archaea [online], Biology LibreTexts, 29 marca 2019 [dostęp 2021-03-11] (ang.).
- ↑ Nicoletta Lanese: Biggest bacterium ever discovered amazes scientists with its complexity. Live Science. [dostęp 2022-02-27]. (ang.).
- ↑ Ed Yong, Mikrobiom. Najmniejsze organizmy, które rządzą światem, wyd. I, tłum. Magdalena Rabsztyn-Anioł, Kraków: Wydawnictwo Uniwersytetu Jagiellońskiego, 2018, s. 35, ISBN 978-83-233-4358-5.
- ↑ Heide N. Schulz, Bo Barker Jørgensen. Big Bacteria. „Annual Review of Microbiology”. 55, s. 105–137, 2001. DOI: 10.1146/annurev.micro.55.1.105.
- ↑ Robertson J, Gomersall M, Gill P. Mycoplasma hominis: growth, reproduction, and isolation of small viable cells. „J Bacteriol.”. 2 (124), s. 1007–1018, 1975. PMID: 1102522. PMCID: PMC235991.
- ↑ Introduction to Bacteriology and Bacterial Structure/Function [online].
- ↑ Velimirov, B. Nanobacteria, Ultramicrobacteria and Starvation Forms: A Search for the Smallest Metabolizing Bacterium. „Microbes and Environments”. 2 (16), s. 67–77, 2001. DOI: 10.1264/jsme2.2001.67.
- ↑ Ingo Fritz, Carsten Strömpl, Wolf-Rainer Abraham. Phylogenetic relationships of the genera Stella, Labrys and Angulomicrobium within the ‘Alphaproteobacteria’ and description of Angulomicrobium amanitiforme sp. nov.. „International Journal of Systematic and Evolutionary Microbiology”. 54, s. 651–657, 2004. DOI: 10.1099/ijs.0.02746-0. PMID: 15143003.
- ↑ Kevin D. Young. The Selective Value of Bacterial Shape. „Microbiology and Molecular Biology Reviews”. 70 (3), s. 660–703, sierpień 2006. DOI: 10.1128/MMBR.00001-06. [dostęp 2008-11-22].
- ↑ a b Douwes KE, Schmalzbauer E, Linde HJ, Reisberger EM i inni. Branched filaments no fungus, ovoid bodies no bacteria: Two unusual cases of mycetoma. „Journal of the American Academy of Dermatology”. 49 (2), s. 170–173, 2003. PMID: 12894113.
- ↑ Donlan RM. Biofilms: microbial life on surfaces. „Emerging Infectious diseases”. 8 (9), s. 881–890, 2002. DOI: 10.3201/eid0809.020063. PMID: 12194761. PMCID: PMC2732559.
- ↑ Rodney M. Donlan, J. William Costerton. Biofilms: Survival Mechanisms of Clinically Relevant Microorganisms. „Clinical Microbiology Reviews”. 15 (2), s. 167–193, Apr 2002. DOI: 10.1128/CMR.15.2.167-193.2002. PMID: 11932229. PMCID: PMC118068.
- ↑ a b Lawrence J. Shimkets. Intercellular Signaling During Frutining-Body Development of Myxococcus xanthus. „Annual Review of Microbiology”. 53, s. 525–549, 1999. DOI: 10.1146/annurev.micro.53.1.525.
- ↑ Fernanda Abreu i inni, Deciphering unusual uncultured magnetotactic multicellular prokaryotes through genomics, „The ISME Journal”, 8 (5), 2014, s. 1055–1068, DOI: 10.1038/ismej.2013.203, ISSN 1751-7362, PMID: 24196322, PMCID: PMC3996684 [dostęp 2021-03-10].
- ↑ Ece Karatan, Paula Watnick, Signals, Regulatory Networks, and Materials That Build and Break Bacterial Biofilms, „Microbiology and Molecular Biology Reviews”, 73 (2), 2009, s. 310–347, DOI: 10.1128/MMBR.00041-08, ISSN 1092-2172, PMID: 19487730 [dostęp 2021-03-11] (ang.).
- ↑ a b Witold Mizerski: Tablice biologiczne, praca zbiorowa. Warszawa: Adamantan, 2013, s. 55. ISBN 978-83-7350-243-7.
- ↑ a b Dale Kaiser. Signaling in Myxobacteria. „Annual Review of Microbiology”. 58, s. 75–98, 2004. DOI: 10.1146/annurev.micro.58.030603.123620. PMID: 15487930.
- ↑ JM Berg, JL Tymoczko, L Stryer: Biochemistry. New York: W.H. Freeman and Company, 2002. ISBN 0-7167-4955-6.
- ↑ Yu-Ling Shih, Lawrence Rothfield. The Bacterial Cytoskeleton. „Microbiology and Molecular Biology Review”. 70 (3), s. 729–754, 2006. DOI: 10.1128/MMBR.00017-06. PMID: 16959967. PMCID: PMC1594594.
- ↑ Z. Gitai. The New Bacterial Cell Biology: Moving Parts and Subcellular Architecture. „Cell”. 120 (5), s. 577–586, 2005-03-11. DOI: 10.1016/j.cell.2005.02.026.
- ↑ Kerfeld CA, Sawaya MR, Tanaka S, et al. Protein structures forming the shell of primitive bacterial organelles. „Science (journal)”. 5736 (309), s. 936–938, sierpień 2005. DOI: 10.1126/science.1113397. PMID: 16081736.
- ↑ Yeates TO, Kerfeld CA, Heinhorst S, Cannon GC, Shively JM. Protein-based organelles in bacteria: carboxysomes and related microcompartments. „Nat. Rev. Microbiol.”, s. 681–691, sierpień 2008. DOI: 10.1038/nrmicro1913. PMID: 18679172.
- ↑ Bobik, T. A. Polyhedral organelles compartmenting bacterial metabolic processes. „Applied Microbiology and Biotechnology”. 5 (70), s. 517–525, 2006. DOI: 10.1007/s00253-005-0295-0.
- ↑ Bryant DA, Frigaard NU. Prokaryotic photosynthesis and phototrophy illuminated. „Trends Microbiol.”. 11 (14), s. 488, 2006. DOI: 10.1016/j.tim.2006.09.001.
- ↑ Thanbichler M, Wang S, Shapiro L. The bacterial nucleoid: a highly organized and dynamic structure. „J Cell Biochem”. 3 (96), s. 506–521, 2005. DOI: 10.1002/jcb.20519. PMID: 15988757.
- ↑ Fuerst J. Intracellular compartmentation in planctomycetes. „Annu Rev Microbiol”, s. 299–328, 2005. DOI: 10.1146/annurev.micro.59.030804.121258. PMID: 15910279.
- ↑ a b Walsby A. Gas vesicles. „Microbiol Rev”. 1 (58), s. 94–144, 1994. PMID: 8177173.
- ↑ Yeo M, Chater K. The interplay of glycogen metabolism and differentiation provides an insight into the developmental biology of Streptomyces coelicolor. „Microbiology”. Pt 3 (151), s. 855–861, 2005. DOI: 10.1099/mic.0.27428-0. PMID: 15758231.
- ↑ Shiba T, Tsutsumi K, Ishige K, Noguchi T. Inorganic polyphosphate and polyphosphate kinase: their novel biological functions and applications. „Biochemistry (Mosc)”. 3 (65), s. 315–323, 2000. PMID: 10739474.
- ↑ Brune DC. Isolation and characterization of sulfur globule proteins from Chromatium vinosum and Thiocapsa roseopersicina. „Arch Microbiol”. 163 (6), s. 391–399, 1995. DOI: 10.1007/BF00272127. PMID: 7575095.
- ↑ D. Kadouri, E. Jurkevitch, Y. Okon, S. Castro-Sowinski. Ecological and agricultural significance of bacterial polyhydroxyalkanoates. „Crit Rev Microbiol”. 31 (2), s. 55–67, 2005. DOI: 10.1080/10408410590899228. PMID: 15986831.
- ↑ Antoni Różalski, Ćwiczenia z mikrobiologii ogólnej. Skrypt dla studentów biologii., 1996, s. 117.
- ↑ van Heijenoort J. Formation of the glycan chains in the synthesis of bacterial peptidoglycan. „Glycobiology”. 3 (11), s. 25R-36R, 2001. DOI: 10.1093/glycob/11.3.25R. PMID: 11320055.
- ↑ Koch A. Bacterial wall as target for attack: past, present, and future research. „Clin Microbiol Rev”. 4 (16), s. 673–687, 2003. DOI: 10.1128/CMR.16.4.673-687.2003. PMID: 14557293.
- ↑ Hans Christian Gram: Über die isolierte Färbung der Schizomyceten in Schnitt- und Trockenpräparaten. 1884.
- ↑ Hugenholtz P. Exploring prokaryotic diversity in the genomic era. „Genome Biol”. 2 (3), s. REVIEWS0003, 2002. DOI: 10.1186/gb-2002-3-2-reviews0003. PMID: 11864374.
- ↑ Walsh F, Amyes S. Microbiology and drug resistance mechanisms of fully resistant pathogens. „Curr Opin Microbiol”. 5 (7), s. 439–444, 2004. DOI: 10.1016/j.mib.2004.08.007. PMID: 15451497.
- ↑ Engelhardt H, Peters J. Structural research on surface layers: a focus on stability, surface layer homology domains, and surface layer-cell wall interactions. „J Struct Biol”. 2–3 (124), s. 276–302, 1998. DOI: 10.1006/jsbi.1998.4070. PMID: 10049812.
- ↑ Beveridge T, Pouwels P, Sára M, Kotiranta A, Lounatmaa K, Kari K, Kerosuo E, Haapasalo M, Egelseer E, Schocher I, Sleytr U, Morelli L, Callegari M, Nomellini J, Bingle W, Smit J, Leibovitz E, Lemaire M, Miras I, Salamitou S, Béguin P, Ohayon H, Gounon P, Matuschek M, Koval S. Functions of S-layers. „FEMS Microbiol Rev”. 1–2 (20), s. 99–149, 1997. PMID: 9276929.
- ↑ Fizjologia z elementami anatomii i histologii. W: Jerzy Błoszyk, Małgorzata Maćkowiak, Anna (biologia) Michalak: Biologia: jedność i różnorodność. Warszawa: Wydawnictwo Szkolne PWN, 2008, s. 474. ISBN 978-83-7446-134-4.
- ↑ Beachey E. Bacterial adherence: adhesin-receptor interactions mediating the attachment of bacteria to mucosal surface. „J Infect Dis”. 3 (143), s. 325–345, 1981. PMID: 7014727.
- ↑ Silverman P. Towards a structural biology of bacterial conjugation. „Mol Microbiol”. 3 (23), s. 423–429, 1997. DOI: 10.1046/j.1365-2958.1997.2411604.x. PMID: 9044277.
- ↑ Stokes R, Norris-Jones R, Brooks D, Beveridge T, Doxsee D, Thorson L. The glycan-rich outer layer of the cell wall of Mycobacterium tuberculosis acts as an antiphagocytic capsule limiting the association of the bacterium with macrophages. „Infect Immun”. 10 (72), s. 5676–5686, 2004. DOI: 10.1128/IAI.72.10.5676-5686.2004. PMID: 15385466.
- ↑ Daffé M, Etienne G. The capsule of Mycobacterium tuberculosis and its implications for pathogenicity. „Tuber Lung Dis”. 3 (79), s. 153–169, 1999. DOI: 10.1054/tuld.1998.0200. PMID: 10656114.
- ↑ Finlay B, Falkow S. Common themes in microbial pathogenicity revisited. „Microbiol Mol Biol Rev”. 2 (61), s. 136–169, 1997. PMID: 9184008.
- ↑ Nicholson W, Munakata N, Horneck G, Melosh H, Setlow P. Resistance of Bacillus endospores to extreme terrestrial and extraterrestrial environments. „Microbiol Mol Biol Rev”. 3 (64), s. 548–572, 2000. DOI: 10.1128/MMBR.64.3.548-572.2000. PMID: 10974126. PMCID: PMC99004.
- ↑ Siunov A, Nikitin D, Suzina N, Dmitriev V, Kuzmin N, Duda V. Phylogenetic status of Anaerobacter polyendosporus, an anaerobic, polysporogenic bacterium. „Int J Syst Bacteriol”. s. 1119–1124. PMID: 10425769.
- ↑ Nicholson W, Fajardo-Cavazos P, Rebeil R, Slieman T, Riesenman P, Law J, Xue Y. Bacterial endospores and their significance in stress resistance. „Antonie Van Leeuwenhoek”. 1–4 (81), s. 27–32, 2002. DOI: 10.1023/A:1020561122764. PMID: 12448702.
- ↑ Vreeland R, Rosenzweig W, Powers D. Isolation of a 250 million-year-old halotolerant bacterium from a primary salt crystal. „Nature”. 6806 (407), s. 897–900, 2000. DOI: 10.1038/35038060. PMID: 11057666.
- ↑ Cano R, Borucki M. Revival and identification of bacterial spores in 25- to 40-million-year-old Dominican amber. „Science”. 5213 (268), s. 1060–1064, 1995. DOI: 10.1126/science.7538699. PMID: 7538699.
- ↑ Nicholson W, Schuerger A, Setlow P. The solar UV environment and bacterial spore UV resistance: considerations for Earth-to-Mars transport by natural processes and human spaceflight. „Mutat Res”. 1–2 (571), s. 249–264, 2005. PMID: 15748651.
- ↑ Hatheway C. Toxigenic clostridia. „Clin Microbiol Rev”. 1 (3), s. 66–98, 1990. PMID: 2404569.
- ↑ Nealson K. Post-Viking microbiology: new approaches, new data, new insights. „Orig Life Evol Biosph”. 1 (29), s. 73–93, 1999. DOI: 10.1023/A:1006515817767. PMID: 11536899.
- ↑ Xu J. Microbial ecology in the age of genomics and metagenomics: concepts, tools, and recent advances. „Mol Ecol”. 7 (15), s. 1713–1731, 2006. DOI: 10.1111/j.1365-294X.2006.02882.x. PMID: 16689892.
- ↑ Zillig W. Comparative biochemistry of Archaea and Bacteria. „Curr Opin Genet Dev”. 4 (1), s. 544–551, 1991. DOI: 10.1016/S0959-437X(05)80206-0. PMID: 1822288.
- ↑ Hellingwerf K, Crielaard W, Hoff W, Matthijs H, Mur L, van Rotterdam B. Photobiology of bacteria. „Antonie Van Leeuwenhoek”. 4 (65), s. 331–347, 1994. DOI: 10.1007/BF00872217. PMID: 7832590.
- ↑ Zumft W. Cell biology and molecular basis of denitrification. „Microbiol Mol Biol Rev”. 4 (61), s. 533–616, 1997. PMID: 9409151. PMCID: PMC232623.
- ↑ Drake H, Daniel S, Küsel K, Matthies C, Kuhner C, Braus-Stromeyer S. Acetogenic bacteria: what are the in situ consequences of their diverse metabolic versatilities?. „Biofactors”. 1 (6), s. 13–24, 1997. DOI: 10.1002/biof.5520060103. PMID: 9233536.
- ↑ a b FMM Morel, Kraepiel AML, Amyot M. The chemical cycle and bioaccumulation of mercury. „Annual Review of Ecological Systems”, s. 543–566, 1998. DOI: 10.1146/annurev.ecolsys.29.1.543.
- ↑ Zehr J, Jenkins B, Short S, Steward G. Nitrogenase gene diversity and microbial community structure: a cross-system comparison. „Environ Microbiol”. 7 (5), s. 539–554, 2003. DOI: 10.1046/j.1462-2920.2003.00451.x. PMID: 12823187.
- ↑ Koch A. Control of the bacterial cell cycle by cytoplasmic growth. „Crit Rev Microbiol”. 1 (28), s. 61–77, 2002. DOI: 10.1080/1040-840291046696. PMID: 12003041.
- ↑ Eagon R. Pseudomonas natriegens, a marine bacterium with a generation time of less than 10 minutes. „J Bacteriol”. s. 736–737. PMID: 13888946. PMCID: PMC279347.
- ↑ a b Thomson R, Bertram H. Laboratory diagnosis of central nervous system infections. „Infect Dis Clin North Am”. 4 (15), s. 1047–1071, 2001. DOI: 10.1016/S0891-5520(05)70186-0. PMID: 11780267.
- ↑ Paerl H, Fulton R, Moisander P, Dyble J. Harmful freshwater algal blooms, with an emphasis on cyanobacteria. „ScientificWorldJournal”, s. 76–113, 2001. DOI: 10.1100/tsw.2001.16. PMID: 12805693.
- ↑ Prats C., López D., Giró A., Ferrer J., Valls J. Individual-based modelling of bacterial cultures to study the microscopic causes of the lag phase. „Journal of theoretical biology”. 4 (241), s. 939–953, sierpień 2006. DOI: 10.1016/j.jtbi.2006.01.029. PMID: 16524598.
- ↑ Hecker M, Völker U. General stress response of Bacillus subtilis and other bacteria. „Adv Microb Physiol”, s. 35–91, 2001. DOI: 10.1016/S0065-2911(01)44011-2. PMID: 11407115.
- ↑ Stewart EJ., Madden R., Paul G., Taddei F. Aging and death in an organism that reproduces by morphologically symmetric division. „PLoS biology”. 2 (3), s. e45, luty 2005. DOI: 10.1371/journal.pbio.0030045. PMID: 15685293.
- ↑ Challis G, Hopwood D. Synergy and contingency as driving forces for the evolution of multiple secondary metabolite production by Streptomyces species. „Proc Natl Acad Sci U S a”, s. 14555–14561, 2003. DOI: 10.1073/pnas.1934677100. PMID: 12970466.
- ↑ Kooijman S, Auger P, Poggiale J, Kooi B. Quantitative steps in symbiogenesis and the evolution of homeostasis. „Biol Rev Camb Philos Soc”. 3 (78), s. 435–463, 2003. DOI: 10.1017/S1464793102006127. PMID: 14558592.
- ↑ Prats C, López D, Giró A, Ferrer J, Valls J. Individual-based modelling of bacterial cultures to study the microscopic causes of the lag phase. „J Theor Biol”. 4 (241), s. 939–953, 2006. PMID: 16524598.
- ↑ Nakabachi A, Yamashita A, Toh H, Ishikawa H, Dunbar H, Moran N, Hattori M. The 160-kilobase genome of the bacterial endosymbiont Carsonella. „Science”. 5797 (314), s. 267, 2006. DOI: 10.1126/science.1134196. PMID: 17038615.
- ↑ Schneiker, S., O. Perlova, et al. Complete genome sequence of the myxobacterium Sorangium cellulosum. „Nature Biotechnology”. 25 (11), s. 1281–1289, 2007. DOI: 10.1038/nbt1354.
- ↑ Hinnebusch J, Tilly K. Linear plasmids and chromosomes in bacteria. „Mol Microbiol”. 5 (10), s. 917–922, 1993. DOI: 10.1111/j.1365-2958.1993.tb00963.x. PMID: 7934868.
- ↑ Belfort M, Reaban ME, Coetzee T, Dalgaard JZ. Prokaryotic introns and inteins: a panoply of form and function. „J. Bacteriol.”. 14 (177), s. 3897–3903, 1995. PMID: 7608058.
- ↑ Brüssow H, Canchaya C, Hardt W. Phages and the evolution of bacterial pathogens: from genomic rearrangements to lysogenic conversion. „Microbiol Mol Biol Rev”. 3 (68), s. 560–602, 2004. DOI: 10.1128/MMBR.68.3.560-602.2004. PMID: 15353570.
- ↑ Bickle TA, Krüger DH. Biology of DNA restriction. „Microbiol. Rev.”. 2 (57), s. 434–450, czerwiec 1993. PMID: 8336674.
- ↑ Barrangou R, Fremaux C, Deveau H, et al. CRISPR provides acquired resistance against viruses in prokaryotes. „Science (journal)”. 5819 (315), s. 1709–1712, marzec 2007. DOI: 10.1126/science.1138140. PMID: 17379808.
- ↑ Brouns SJ, Jore MM, Lundgren M, et al. Small CRISPR RNAs guide antiviral defense in prokaryotes. „Science (journal)”. 5891 (321), s. 960–964, sierpień 2008. DOI: 10.1126/science.1159689. PMID: 18703739.
- ↑ Denamur E, Matic I. Evolution of mutation rates in bacteria. „Mol Microbiol”. 4 (60), s. 820–827, 2006. DOI: 10.1111/j.1365-2958.2006.05150.x. PMID: 16677295.
- ↑ Wright B. Stress-directed adaptive mutations and evolution. „Mol Microbiol”. 3 (52), s. 643–650, 2004. DOI: 10.1111/j.1365-2958.2004.04012.x. PMID: 15101972.
- ↑ Davison J. Genetic exchange between bacteria in the environment. „Plasmid”. 2 (42), s. 73–91, 1999. DOI: 10.1006/plas.1999.1421. PMID: 10489325.
- ↑ Hastings P, Rosenberg S, Slack A. Antibiotic-induced lateral transfer of antibiotic resistance. „Trends Microbiol”. 9 (12), s. 401–404, 2004. DOI: 10.1016/j.tim.2004.07.003. PMID: 15337159.
- ↑ a b c Bardy SL., Ng SY., Jarrell KF. Prokaryotic motility structures. „Microbiology (Reading, England)”. Pt 2 (149), s. 295–304, luty 2003. PMID: 12624192.
- ↑ Merz A, So M, Sheetz M. Pilus retraction powers bacterial twitching motility. „Nature”. 6800 (407), s. 98–102, 2000. DOI: 10.1038/35024105. PMID: 10993081.
- ↑ a b Beata Bednarczuk: Słownik bakterii. Warszawa: adamantan, 2008, s. 247. ISBN 978-83-7350-076-1.
- ↑ Wu M, Roberts J, Kim S, Koch D, DeLisa M. Collective bacterial dynamics revealed using a three-dimensional population-scale defocused particle tracking technique. „Appl Environ Microbiol”. 7 (72), s. 4987–4994, 2006. DOI: 10.1128/AEM.00158-06. PMID: 16820497.
- ↑ Goldberg MB. Actin-based motility of intracellular microbial pathogens. „Microbiol Mol Biol Rev”. 4 (65), s. 595–626, 2001. DOI: 10.1128/MMBR.65.4.595-626.2001. PMID: 11729265.
- ↑ Lux R, Shi W. Chemotaxis-guided movements in bacteria. „Crit Rev Oral Biol Med”. 4 (15), s. 207–220, 2004. PMID: 15284186.
- ↑ Frankel R, Bazylinski D, Johnson M, Taylor B. Magneto-aerotaxis in marine coccoid bacteria. „Biophys J”. 2 (73), s. 994–1000, 1997. DOI: 10.1016/S0006-3495(97)78132-3. PMID: 9251816.
- ↑ Schopf J. Disparate rates, differing fates: tempo and mode of evolution changed from the Precambrian to the Phanerozoic. „Proc Natl Acad Sci U S a”. 15 (91), s. 6735–6742, 1994. DOI: 10.1073/pnas.91.15.6735. PMID: 8041691.
- ↑ DeLong E, Pace N. Environmental diversity of bacteria and archaea. „Syst Biol”. 4 (50), s. 470–478, 2001. DOI: 10.1080/106351501750435040. PMID: 12116647.
- ↑ Brown JR, Doolittle WF. Archaea and the prokaryote-to-eukaryote transition. „Microbiol. Mol. Biol. Rev.”. 4 (61), s. 456–502, 1997. PMID: 9409149.
- ↑ Di Giulio M. The universal ancestor and the ancestor of bacteria were hyperthermophiles. „J Mol Evol”. 6 (57), s. 721–730, 2003. DOI: 10.1007/s00239-003-2522-6. PMID: 14745541.
- ↑ a b Battistuzzi F, Feijao A, Hedges S. A genomic timescale of prokaryote evolution: insights into the origin of methanogenesis, phototrophy, and the colonization of land. „BMC Evol Biol”, s. 44, 2004. DOI: 10.1186/1471-2148-4-44. PMID: 15535883.
- ↑ Dyall S, Brown M, Johnson P. Ancient invasions: from endosymbionts to organelles. „Science”. 5668 (304), s. 253–257, 2004. DOI: 10.1126/science.1094884. PMID: 15073369.
- ↑ Poole A, Penny D. Evaluating hypotheses for the origin of eukaryotes. „Bioessays”. 1 (29), s. 74–84, 2007. DOI: 10.1002/bies.20516. PMID: 17187354.
- ↑ Ebersold HR, Cordier JL, Lüthy P. Bacterial mesosomes: method dependent artifacts. „Archives of Microbiology”. 1981. 130. s. 19–22. DOI: 10.1007/BF00527066. PMID: 6796029.
- ↑ Lang B, Gray M, Burger G. Mitochondrial genome evolution and the origin of eukaryotes. „Annu Rev Genet”, s. 351–397, 1999. DOI: 10.1146/annurev.genet.33.1.351. PMID: 10690412.
- ↑ Schulz H, Jorgensen B. Big bacteria. „Annu Rev Microbiol”, s. 105–137, 2001. DOI: 10.1146/annurev.micro.55.1.105. PMID: 11544351.
- ↑ Thomson R, Bertram H. Laboratory diagnosis of central nervous system infections. „Infect Dis Clin North Am”. 4 (15), s. 1047–1071, 2001. DOI: 10.1016/S0891-5520(05)70186-0. PMID: 11780267.
- ↑ Boucher Y, Douady CJ, Papke RT, Walsh DA, Boudreau ME, Nesbo CL, Case RJ, Doolittle WF. Lateral gene transfer and the origins of prokaryotic groups. „Annu Rev Genet”, s. 283–328, 2003. DOI: 10.1146/annurev.genet.37.050503.084247. PMID: 14616063.
- ↑ Gary J. Olsen, Carl R. Woese, Ross Overbeek, The winds of (evolutionary) change: breathing new life into microbiology, „Journal of Bacteriology”, 176 (1), 1994, s. 1–6, PMID: 8282683, PMCID: PMC205007.
- ↑ Hans Christian Gram: Über die isolierte Färbung der Schizomyceten in Schnitt- und Trockenpräparaten. Fortschr. Med., 1884.
- ↑ Woods G, Walker D. Detection of infection or infectious agents by use of cytologic and histologic stains. „Clin Microbiol Rev”. 3 (9), s. 382–404, 1996. PMID: 8809467. PMCID: PMC172900.
- ↑ Weinstein M. Clinical importance of blood cultures. „Clin Lab Med”. 1 (14), s. 9–16, 1994. PMID: 8181237.
- ↑ Louie M, Louie L, Simor AE. The role of DNA amplification technology in the diagnosis of infectious diseases. „CMAJ”. 3 (163), s. 301–309, 2000. PMID: 10951731.
- ↑ Oliver J. The viable but nonculturable state in bacteria. „J Microbiol”. 43 Spec No, s. 93–100, Feb 2005. PMID: 15765062.
- ↑ Numbers of Living Species in Australia and the World 2nd edition [zarchiwizowane 2009-10-07].
- ↑ Curtis T, Sloan W, Scannell J. Estimating prokaryotic diversity and its limits. „Proc Natl Acad Sci U S a”. 99 (16), s. 10494–10499, 2002. DOI: 10.1073/pnas.142680199. PMID: 12097644.
- ↑ Schloss P, Handelsman J. Status of the microbial census. „Microbiol Mol Biol Rev”. 4 (68), s. 686–691, 2004. DOI: 10.1128/MMBR.68.4.686-691.2004. PMID: 15590780.
- ↑ Carl von Linné, Systema naturæ, Tom. I. Pars II. Editio duodecima reformata., 1767 (łac.).
- ↑ Otto Friedrich Müller, Vermivm terrestrium et fluviatilium, seu, Animalium infusoriorum, helminthicorum et testaceorum, non marinorum, succincta historia, 1773 (łac.).
- ↑ Otto Friedrich Müller, Animalcula infusoria fluviatilia et marina, 1786 (łac.).
- ↑ a b c d Gerhart Drews, The roots of microbiology and the influence of Ferdinand Cohn on microbiology of the 19th century, „FEMS Microbiology Reviews”, 24 (3), 2000, s. 225–249, DOI: 10.1111/j.1574-6976.2000.tb00540.x, ISSN 0168-6445 [dostęp 2021-04-07].
- ↑ Roland Thaxter, On the Myxobacteriaceæ, a New Order of Schizomycetes, „Botanical Gazette”, 17 (12), 1892, s. 389–406, DOI: 10.1086/326866, ISSN 0006-8071 [dostęp 2021-04-10] (ang.).
- ↑ George Garrity, David R. Boone, Richard W. Castenholz, Bergey’s Manual of Systematic Bacteriology, t. Volume One: The Archaea and the Deeply Branching and Phototrophic Bacteria, 2001.
- ↑ Joseph M. Scamardella, Not plants or animals: a brief history of the origin of Kingdoms Protozoa, Protista and Protoctista, „International Microbiology”, 2, 1999 (ang.).
- ↑ Jean Vincent Félix Lamouroux, Jean Baptiste Bory de Saint-Vincent, Jacques Amand Eudes-Deslongchamps, Histoire naturelle des zoophytes, ou animaux rayonnes, faisant suite à l’Histoire naturelle des vers de Bruguière;, 1824, Psychodiaires (fr.).
- ↑ a b c d Christian Gottfried Ehrenberg, Die Infusionsthierchen als vollkommene Organismen. Ein Blick in das tiefere organische Leben der Natur, 1838 (niem.).
- ↑ a b R.S. Breed, H.J. Conn, The Status of the Generic Term Bacterium Ehrenberg 1828, „Journal of Bacteriology”, 31 (5), 1936, s. 517–518, DOI: 10.1128/JB.31.5.517-518.1936, ISSN 0021-9193, PMID: 16559906, PMCID: PMC543738 [dostęp 2021-04-05].
- ↑ Jean Vincent Félix Lamouroux, Jean Baptiste Bory de Saint-Vincent, Jacques Amand Eudes-Deslongchamps, Histoire naturelle des zoophytes, ou animaux rayonnes, faisant suite à l’Histoire naturelle des vers de Bruguière;, 1824, Microscopiques (fr.).
- ↑ a b Félix Dujardin, Histoire naturelle des zoophytes. Infusoires, comprenant la physiologie et la classificatin de ces animaux, et la manière de les étudier à l’aide du microscope., 1841 (fr.).
- ↑ a b Christian Gottfried Ehrenberg, der Infusorien und ihrer geographischen Verbreitung, [w:] Abhandlungen der Königlichen Akademie der Wissenschaften zu Berlin., 1830 (niem.).
- ↑ a b c d e f g h i j k C.-E.A. Winslow i inni, The Families and Genera of the Bacteria, „Journal of Bacteriology”, 2 (5), 1917, s. 505–566, ISSN 0021-9193, PMID: 16558764, PMCID: PMC378727 [dostęp 2021-04-05].
- ↑ Martha E Trujillo i inni red., Bergey’s Manual of Systematics of Archaea and Bacteria, wyd. 1, Wiley, 17 kwietnia 2015, DOI: 10.1002/9781118960608, ISBN 978-1-118-96060-8 [dostęp 2021-03-15] (ang.).
- ↑ S.P. Lapage i inni, Opinions Relating to the Nomenclature of Bacteria, ASM Press, 1992 [dostęp 2021-04-05] (ang.).
- ↑ Herbert F. Copeland, Spirodiscus Ehrenberg Identified as Ophiocytium Nägeli, „Science”, 119 (3090), 1954, s. 388–388, DOI: 10.1126/science.119.3090.388, ISSN 0036-8075, PMID: 17732378 [dostęp 2021-04-05] (ang.).
- ↑ Jai Prakash Keshri, The genus Ophiocytium Nageli and Centritractus Lemmermann (Heterococcales, Xanthophyta) in West Bengal, India., „Journal of Economic and Taxonomic Botany”, 29 (1), styczeń 2005, ISSN 0250-9768.
- ↑ a b Karl Theodor Ernst von Siebold, Hermann Friedrich Stannius, Lehrbuch der vergleichenden Anatomie der Wirbellosen Thiere, 1860 (niem.).
- ↑ a b Maximilian Perty, Zur Kenntniss kleinster Lebensformen. Nach Bau, Funktionen, Systematik, mit Specialverzeichniss der in der Schweiz beobachteten, 1852 (niem.).
- ↑ a b c Thomas Cavalier-Smith, Deep phylogeny, ancestral groups and the four ages of life, „Philosophical Transactions of the Royal Society B: Biological Sciences”, 365 (1537), 2010, s. 111–132, DOI: 10.1098/rstb.2009.0161, ISSN 0962-8436, PMID: 20008390, PMCID: PMC2842702 [dostęp 2021-04-08] (ang.).
- ↑ a b Ernst Haeckel, Generelle Morphologie der Organismen. Allgemeine Grundzüge der organischen Formen-Wissenschaft, mechanisch begründet durch die von Charles Darwin reformirte Descendenz-Theorie, 1866 (niem.).
- ↑ M. Stephenson, L.H. Stickland, Hydrogenase: The bacterial formation of methane by the reduction of one-carbon compounds by molecular hydrogen, „The Biochemical Journal”, 27 (5), 1933, s. 1517–1527, DOI: 10.1042/bj0271517, ISSN 0264-6021, PMID: 16745264, PMCID: PMC1253060 [dostęp 2021-04-09].
- ↑ Ernst Haeckel, Natürliche Schöpfungsgeschichte. Gemeinverständliche wissenschaftliche Vorträge über die Entwickelungslehre im Allgemeinen und diejenige von Darwin, Goethe und Lamarck und Besonderen, 1873 (niem.).
- ↑ Ernst Haeckel, Das Protistenreich, 1878 (niem.).
- ↑ Hugo von Mohl, Diederich Franz Leonhard von Schlechtendal, Botanische Zeitung, 1857, s. 760 (niem.).
- ↑ Beiträge zur Biologie der Pflanzen., t. 1, Berlin [etc.]: Duncker & Humblot [etc.] [dostęp 2022-02-26].
- ↑ a b c d e f g h i j k R.E. Buchanan, Studies in the Nomenclature and Classification of the Bacteria, „Journal of Bacteriology”, 2 (2), 1917, s. 155–164, ISSN 0021-9193, PMID: 16558735, PMCID: PMC378699 [dostęp 2022-02-26].
- ↑ A. de Bary, Vergleichende Morphologie und Biologie der Pilze, Mycetozoen und Bacterien., Leipzig: Engelmann, 1884, DOI: 10.5962/bhl.title.45509 [dostęp 2022-02-26].
- ↑ Philippe Édouard Léon Van Tieghem, Traité de botanique, wyd. 1, 1884, XXIII, 1103–1114 [dostęp 2022-02-26] (fr.).
- ↑ Ernst Haeckel, Natürliche schöpfungsgeschichte: Gemeinverständliche wissenschaftliche vorträge über die entwickelungslehre im allgemeinen und diejenige von Darwin, Goethe und Lamarck im besonderen, wyd. 8. umgearb. und verm. aufl., Berlin: George Reimer, 1889, DOI: 10.5962/bhl.title.15249 [dostęp 2022-02-26].
- ↑ Ernst Haeckel, Systematische phylogenie, Berlin: Georg Reimer, 1894, DOI: 10.5962/bhl.title.3947 [dostęp 2022-02-26].
- ↑ Ernst Heinrich Philipp August Haeckel, Die lebenswunder; gemeinverständliche studien über biologische philosophie, Stuttgart, A. Kröner, 1904, s. 215–218 [dostęp 2022-02-26].
- ↑ Adolf Engler, Syllabus der Vorlesungen über specielle und medicinisch-pharmaceutische Botanik. Eine Uebersicht über das gesammte Pflanzensystem mit Berücksichtigung der Medicinal- und Nutzpflanzen, wyd. Grosse Ausg., Berlin: Gebrüder Borntraeger, 1892, DOI: 10.5962/bhl.title.69853 [dostęp 2022-02-26].
- ↑ Rudolf Otto Neumann, Karl Bernhard Lehmann, Atlas und Grundriss der Bakteriologie und Lehrbuch der speziellen ..., t. 2, Lehmann, 1896 [dostęp 2022-02-26] (niem.).
- ↑ R.E. Buchanan, R.S. Breed, L.F. Rettger, A Diagramatic Summary of Various Bacterial Classifications, „Journal of Bacteriology”, 16 (6), 1928, s. 387–396, ISSN 0021-9193, PMID: 16559348, PMCID: PMC375037 [dostęp 2022-02-26].
- ↑ Alfred Fischer, Vorlesungen über Bakterien., Jena: Fischer, 1897, s. 32–34, DOI: 10.5962/bhl.title.1910 [dostęp 2022-02-26].
- ↑ a b c d e Karl Heinz Schleifer, Classification of Bacteria and Archaea: past, present and future, „Systematic and Applied Microbiology”, 32 (8), 2009, s. 533–542, DOI: 10.1016/j.syapm.2009.09.002, ISSN 1618-0984, PMID: 19819658 [dostęp 2022-02-26].
- ↑ Wilhelm Benecke, Bau und leben der bakterien, Leipzig: B. G. Teubner, 1912, s. 186–188, DOI: 10.5962/bhl.title.3729 [dostęp 2022-02-26].
- ↑ a b Robert S. Breed, E.G.D. Murray, A. Parker Hitchens, The Outline Classification Used in the Bergey Manual of Determinative Bacteriology, „Bacteriological Reviews”, 8 (4), 1944, s. 255–260, ISSN 0005-3678, PMID: 16350097, PMCID: PMC440881 [dostęp 2022-02-26].
- ↑ Édouard Chatton, Pansporella perplexa. Réflexions sur la biologie et la phylogénie des protozoaires, „Annales des sciences naturelles. Zoologie et Biologie Animale.”, Gallica, 1925, s. 36, 76 [dostęp 2022-02-26] (fr.).
- ↑ Bruno Schussnig, Betrachtungen über das System der niederen Pflanzen., 1926.
- ↑ a b American Society for Microbiology. i inni, Bergey’s manual of determinative bacteriology, wyd. Abridged 6th ed., Geneva, N.Y.: Biotech, 1948, s. 11–30, DOI: 10.5962/bhl.title.60376 [dostęp 2022-02-26].
- ↑ Herbert F. Copeland, The Kingdoms of Organisms, „The Quarterly Review of Biology”, 13 (4), 1938, s. 383–420, DOI: 10.1086/394568, ISSN 0033-5770 [dostęp 2022-02-26] (ang.).
- ↑ Caulobacter Henrici & Johnson, 1935 [online], gbif.org [dostęp 2022-02-26] (ang.).
- ↑ Robert George Everitt Murray, Microbial structure as an aid to microbial classification and taxonomy, „SPISY (Faculté des Sciences de l’Université J.E. Purkyne Brno)”, 43, 1968, s. 249–252.
- ↑ Jan Sapp, The Prokaryote-Eukaryote Dichotomy: Meanings and Mythology, „Microbiology and Molecular Biology Reviews”, 69 (2), 2005, s. 292–305, DOI: 10.1128/MMBR.69.2.292-305.2005, ISSN 1092-2172, PMID: 15944457, PMCID: PMC1197417 [dostęp 2022-02-26].
- ↑ R.H. Whittaker, New Concepts of Kingdoms of Organisms: Evolutionary relations are better represented by new classifications than by the traditional two kingdoms., „Science”, 163 (3863), 1969, s. 150–160, DOI: 10.1126/science.163.3863.150, ISSN 0036-8075 [dostęp 2022-02-26] (ang.).
- ↑ a b c d e f g Thomas Cavalier-Smith, Ema E-Yung Chao, Multidomain ribosomal protein trees and the planctobacterial origin of neomura (eukaryotes, archaebacteria), „Protoplasma”, 257 (3), 2020, s. 621–753, DOI: 10.1007/s00709-019-01442-7, ISSN 0033-183X, PMID: 31900730, PMCID: PMC7203096 [dostęp 2021-03-15].
- ↑ Zbigniew Podbielkowski, Irena Rejment-Grochowska, Alina Skirgiełło: Rośliny zarodnikowe. Wyd. 2. Warszawa: PWN, 1980.
- ↑ a b Classification, taxonomy and systematics of bacteria (prokaryotes) [online], web.archive.org, 29 maja 2013 [dostęp 2021-03-15] [zarchiwizowane z adresu 2013-05-29].
- ↑ a b c Martha E Trujillo i inni red., Bergey’s Manual of Systematics of Archaea and Bacteria, wyd. 1, Wiley, 17 kwietnia 2015, DOI: 10.1002/9781118960608, ISBN 978-1-118-96060-8 [dostęp 2021-03-15] (ang.).
- ↑ LPSN – List of Prokaryotic names with Standing in Nomenclature [online], lpsn.dsmz.de [dostęp 2021-03-15] (ang.).
- ↑ Conrad Schoch, NCBI Taxonomy, National Center for Biotechnology Information (US), 11 lutego 2020 [dostęp 2021-03-15] (ang.).
- ↑ Donovan H. Parks i inni, A complete domain-to-species taxonomy for Bacteria and Archaea, „Nature Biotechnology”, 38 (9), 2020, s. 1079–1086, DOI: 10.1038/s41587-020-0501-8, ISSN 1546-1696, PMID: 32341564 [dostęp 2021-03-15].
- ↑ a b Michael A. Ruggiero i inni, A Higher Level Classification of All Living Organisms, „PLOS One”, 10 (4), 2015, art. nr e0119248, DOI: 10.1371/journal.pone.0119248, PMID: 25923521, PMCID: PMC4418965 [dostęp 2021-03-11] (ang.).
- ↑ Cavalier-Smith T. The neomuran origin of archaebacteria, the negibacterial root of the universal tree and bacterial megaclassification. „Int J Syst Evol Microbiol”. Pt 1 (52), s. 7–76, 2002. PMID: 11837318.
- ↑ T. Cavalier-Smith, Origins of Secondary Metabolism, Derek J. Chadwick, Julie Whelan (red.), Chichester, UK: John Wiley & Sons, Ltd., 28 września 2007, s. 64–87, DOI: 10.1002/9780470514344.ch5, ISBN 978-0-470-51434-4 [dostęp 2021-03-17].
- ↑ Thomas Cavalier-Smith, Cell evolution and Earth history: stasis and revolution, „Philosophical Transactions of the Royal Society of London. Series B. Biological Sciences”, 361 (1470), 2006, s. 969–1006, DOI: 10.1098/rstb.2006.1842, ISSN 0962-8436, PMID: 16754610, PMCID: PMC1578732 [dostęp 2021-03-15].
- ↑ Approved Lists of Bacterial Names. American Society for Microbiology. [dostęp 2009-03-11]. (ang.).
- ↑ a b International Code of Nomenclature of Bacteria (1990 Revision). International Union of Microbiological Societies. [dostęp 2009-03-11]. (ang.).
- ↑ E. Stackebrandt, F.A. Rainey, N.L. Ward-Rainey, Proposal for a New Hierarchic Classification System, Actinobacteria classis nov., „International Journal of Systematic Bacteriology”, 47 (2), 1997, s. 479–491, DOI: 10.1099/00207713-47-2-479, ISSN 0020-7713 [dostęp 2021-03-14] (ang.).
- ↑ Why has the suffix of phyla names been changed to -ota? [online], gtdb.ecogenomic.org [dostęp 2021-03-14] (ang.).
- ↑ a b c Pablo Yarza i inni, Uniting the classification of cultured and uncultured bacteria and archaea using 16S rRNA gene sequences, „Nature Reviews Microbiology”, 12 (9), 2014, s. 635–645, DOI: 10.1038/nrmicro3330, ISSN 1740-1534 [dostęp 2021-03-15] (ang.).
- ↑ Johan Goris i inni, DNA–DNA hybridization values and their relationship to whole-genome sequence similarities, „International Journal of Systematic and Evolutionary Microbiology”, 57 (1), 2007, s. 81–91, DOI: 10.1099/ijs.0.64483-0, ISSN 1466-5026 [dostęp 2021-03-15] (ang.).
- ↑ GTDB – Tree [online], gtdb.ecogenomic.org [dostęp 2021-03-15].
- ↑ How are the number of taxa at each rank counted? [online], gtdb.ecogenomic.org [dostęp 2021-03-15] (ang.).
- ↑ Eubacteria [online], tolweb.org [dostęp 2021-03-15].
- ↑ J.A. Servin i inni, Evidence Excluding the Root of the Tree of Life from the Actinobacteria, „Molecular Biology and Evolution”, 25 (1), 2007, s. 1–4, DOI: 10.1093/molbev/msm249, ISSN 0737-4038 [dostęp 2021-03-15] (ang.).
- ↑ S. L’Haridon i inni, Desulfurobacterium atlanticum sp. nov., Desulfurobacterium pacificum sp. nov. and Thermovibrio guaymasensis sp. nov., three thermophilic members of the Desulfurobacteriaceae fam. nov., a deep branching lineage within the Bacteria, „International Journal of Systematic and Evolutionary Microbiology”, 56 (12), 2006, s. 2843–2852, DOI: 10.1099/ijs.0.63994-0, ISSN 1466-5026 [dostęp 2021-03-15] (ang.).
- ↑ George M. Garrity i inni, Phylum BIII. Thermodesulfobacteria phy. nov. David R. Boone, Richard W. Castenholz, George M. Garrity (red.), New York, NY: Springer, 2001, s. 389–393, DOI: 10.1007/978-0-387-21609-6_20, ISBN 978-0-387-21609-6 [dostęp 2021-03-15] (ang.).
- ↑ Hideyuki Tamaki i inni, Armatimonas rosea gen. nov., sp. nov., of a novel bacterial phylum, Armatimonadetes phyl. nov., formally called the candidate phylum OP10, „International Journal of Systematic and Evolutionary Microbiology”, 61 (6), 2011, s. 1442–1447, DOI: 10.1099/ijs.0.025643-0, ISSN 1466-5026 [dostęp 2021-03-15] (ang.).
- ↑ Iain C. Sutcliffe, A phylum level perspective on bacterial cell envelope architecture, „Trends in Microbiology”, 18 (10), 2010, s. 464–470, DOI: 10.1016/j.tim.2010.06.005 [dostęp 2021-03-15] (ang.).
- ↑ George M. Garrity, John G. Holt, Jerome J. Perry, Phylum BVII. Thermomicrobia phy. nov. David R. Boone, Richard W. Castenholz, George M. Garrity (red.), New York, NY: Springer New York, 2001, s. 447–450, DOI: 10.1007/978-0-387-21609-6_24, ISBN 978-1-4419-3159-7 [dostęp 2021-03-16] (ang.).
- ↑ Steven L. Percival, David W. Williams, Cyanobacteria, Elsevier, 2014, s. 79–88, DOI: 10.1016/b978-0-12-415846-7.00005-6, ISBN 978-0-12-415846-7 [dostęp 2021-03-15] (ang.).
- ↑ Rochelle M. Soo i inni, An Expanded Genomic Representation of the Phylum Cyanobacteria, „Genome Biology and Evolution”, 6 (5), 2014, s. 1031–1045, DOI: 10.1093/gbe/evu073, ISSN 1759-6653, PMID: 24709563, PMCID: PMC4040986 [dostęp 2021-03-15] (ang.).
- ↑ Daniel R. Brown, Tenericutes, American Cancer Society, 2018, s. 1–3, DOI: 10.1002/9781118960608.pbm00025.pub2, ISBN 978-1-118-96060-8 [dostęp 2021-03-15] (ang.).
- ↑ Brad A. Lock, Jim Wellehan, Ophidia (Snakes), Elsevier, 2015, s. 60–74, DOI: 10.1016/b978-1-4557-7397-8.00008-6, ISBN 978-1-4557-7397-8 [dostęp 2021-03-15] (ang.).
- ↑ K.W. Bennett, A. Eley, Fusobacteria: New taxonomy and related diseases, „Journal of Medical Microbiology”, 39 (4), 1993, s. 246–254, DOI: 10.1099/00222615-39-4-246, ISSN 0022-2615 [dostęp 2021-03-15] (ang.).
- ↑ Wayback Machine [online], web.archive.org, 14 czerwca 2011 [dostęp 2021-03-15] [zarchiwizowane z adresu 2011-06-14].
- ↑ Andreas Brune, Elusimicrobium, American Cancer Society, 2018, s. 1–6, DOI: 10.1002/9781118960608.gbm01490, ISBN 978-1-118-96060-8 [dostęp 2021-03-15] (ang.).
- ↑ Christian Boedeker i inni, Determining the bacterial cell biology of Planctomycetes, „Nature Communications”, 8, 2017, s. 14853, DOI: 10.1038/ncomms14853, ISSN 2041-1723, PMID: 28393831, PMCID: PMC5394234 [dostęp 2021-03-15].
- ↑ John A. Fuerst, Planctomycetes–New Models for Microbial Cells and Activities, Elsevier, 2017, s. 1–27, DOI: 10.1016/b978-0-12-804765-1.00001-1, ISBN 978-0-12-804765-1 [dostęp 2021-03-15] (ang.).
- ↑ Olga M. Lage i inni, Planctomycetes, Thomas M. Schmidt (red.), Oxford: Academic Press, 2019, s. 614–626, ISBN 978-0-12-811737-8 [dostęp 2021-03-16] (ang.).
- ↑ G.C. Yap, P.Y. Hong, B.W. Lee, MICROFLORA OF THE INTESTINE | The Natural Microflora of Humans, Elsevier, 2014, s. 634–638, DOI: 10.1016/b978-0-12-384730-0.00207-x, ISBN 978-0-12-384733-1 [dostęp 2021-03-15] (ang.).
- ↑ Peter H. Janssen, Pathway of Glucose Catabolism by Strain VeGlc2, an Anaerobe Belonging to the Verrucomicrobiales Lineage of Bacterial Descent, „Applied and Environmental Microbiology”, 64 (12), 1998, s. 4830–4833, DOI: 10.1128/AEM.64.12.4830-4833.1998, ISSN 0099-2240, PMID: 9835570 [dostęp 2021-03-15] (ang.).
- ↑ B.P. Hedlund, J.J. Gosink, J.T. Staley, Verrucomicrobia div. nov., a new division of the bacteria containing three new species of Prosthecobacter, „Antonie Van Leeuwenhoek”, 72 (1), 1997, s. 29–38, DOI: 10.1023/a:1000348616863, ISSN 0003-6072, PMID: 9296261 [dostęp 2021-03-15].
- ↑ a b Xin-Xin Qian i inni, Identification of novel species of marine magnetotactic bacteria affiliated with Nitrospirae phylum, „Environmental Microbiology Reports”, 11 (3), 2019, s. 330–337, DOI: 10.1111/1758-2229.12755, ISSN 1758-2229 [dostęp 2021-03-16] (ang.).
- ↑ Alexander Siegl i inni, Single-cell genomics reveals the lifestyle of Poribacteria, a candidate phylum symbiotically associated with marine sponges, „The ISME journal”, 5 (1), 2011, s. 61–70, DOI: 10.1038/ismej.2010.95, ISSN 1751-7362, PMID: 20613790, PMCID: PMC3105677 [dostęp 2021-03-16].
- ↑ Damien P. Devos, Re-interpretation of the evidence for the PVC cell plan supports a Gram-negative origin, „Antonie Van Leeuwenhoek”, 105 (2), 2014, s. 271–274, DOI: 10.1007/s10482-013-0087-y, ISSN 1572-9699, PMID: 24292377 [dostęp 2021-03-16].
- ↑ Svetlana N Dedysh, Jaap S Sinninghe Damsté, Acidobacteria, John Wiley & Sons Ltd (red.), Chichester, UK: John Wiley & Sons, Ltd, 22 stycznia 2018, s. 1–10, DOI: 10.1002/9780470015902.a0027685, ISBN 978-0-470-01590-2 [dostęp 2021-03-15] (ang.).
- ↑ J.M. Macy i inni, Chrysiogenes arsenatis gen. nov., sp. nov., a New Arsenate-Respiring Bacterium Isolated from Gold Mine Wastewater, „International Journal of Systematic Bacteriology”, 46 (4), 1996, s. 1153–1157, DOI: 10.1099/00207713-46-4-1153, ISSN 0020-7713 [dostęp 2021-03-15] (ang.).
- ↑ a b Corentine Alauzet, Estelle Jumas-Bilak, The Phylum Deferribacteres and the Genus Caldithrix, Eugene Rosenberg i inni red., Berlin, Heidelberg: Springer, 2014, s. 595–611, DOI: 10.1007/978-3-642-38954-2_162, ISBN 978-3-642-38954-2 [dostęp 2021-03-16] (ang.).
- ↑ Hirotsugu Fujitani i inni, Isolation of sublineage I Nitrospira by a novel cultivation strategy: Isolation of uncultured Nitrospira, „Environmental Microbiology”, 16 (10), 2014, s. 3030–3040, DOI: 10.1111/1462-2920.12248 [dostęp 2021-03-15] (ang.).
- ↑ Silke Ehrich i inni, A new obligately chemolithoautotrophic, nitrite-oxidizing bacterium, Nitrospira moscoviensis sp. nov. and its phylogenetic relationship, „Archives of Microbiology”, 164 (1), 1995, s. 16–23, DOI: 10.1007/BF02568729, ISSN 0302-8933 [dostęp 2021-03-15] (ang.).
- ↑ C R Woese, Bacterial evolution., „Microbiological Reviews”, 51 (2), 1987, s. 221–271, ISSN 0146-0749, PMID: 2439888, PMCID: PMC373105 [dostęp 2021-03-15].
- ↑ Christoph M. Deeg i inni, Chromulinavorax destructans, a pathogen of microzooplankton that provides a window into the enigmatic candidate phylum Dependentiae, „PLOS Pathogens”, 15 (5), 2019, e1007801, DOI: 10.1371/journal.ppat.1007801, ISSN 1553-7374, PMID: 31150530, PMCID: PMC6561590 [dostęp 2021-03-16] (ang.).
- ↑ Ming L. Wu i inni, Ultrastructure of the Denitrifying Methanotroph “Candidatus Methylomirabilis oxyfera,” a Novel Polygon-Shaped Bacterium, „Journal of Bacteriology”, 194 (2), 2012, s. 284–291, DOI: 10.1128/JB.05816-11, ISSN 0021-9193, PMID: 22020652, PMCID: PMC3256638 [dostęp 2021-03-16] (ang.).
- ↑ Mirjana Rajilić-Stojanović, Willem M de Vos, The first 1000 cultured species of the human gastrointestinal microbiota, „Fems Microbiology Reviews”, 38 (5), 2014, s. 996–1047, DOI: 10.1111/1574-6976.12075, ISSN 0168-6445, PMID: 24861948, PMCID: PMC4262072 [dostęp 2021-03-15].
- ↑ Donald A. Bryant, Phototrophy and Phototrophs, Elsevier, 2019, B9780128096338206729, DOI: 10.1016/b978-0-12-809633-8.20672-9, ISBN 978-0-12-809633-8 [dostęp 2021-03-15] (ang.).
- ↑ Hui Zhang i inni, Gemmatimonas aurantiaca gen. nov., sp. nov., a Gram-negative, aerobic, polyphosphate-accumulating micro-organism, the first cultured representative of the new bacterial phylum Gemmatimonadetes phyl. nov., „International Journal of Systematic and Evolutionary Microbiology”, 53 (4), 2003, s. 1155–1163, DOI: 10.1099/ijs.0.02520-0, ISSN 1466-5026 [dostęp 2021-03-15] (ang.).
- ↑ Kelsea A. Jewell i inni, A phylogenetic analysis of the phylum Fibrobacteres, „Systematic and Applied Microbiology”, 36 (6), 2013, s. 376–382, DOI: 10.1016/j.syapm.2013.04.002 [dostęp 2021-03-16] (ang.).
- ↑ Eric Pelletier i inni, “Candidatus Cloacamonas Acidaminovorans”: Genome Sequence Reconstruction Provides a First Glimpse of a New Bacterial Division, „Journal of Bacteriology”, 190 (7), 2008, s. 2572–2579, DOI: 10.1128/JB.01248-07, ISSN 0021-9193, PMID: 18245282, PMCID: PMC2293186 [dostęp 2021-03-16] (ang.).
- ↑ spirochete, [w:] Encyclopædia Britannica [dostęp 2022-09-30] (ang.).
- ↑ Koji Mori i inni, Caldisericum exile gen. nov., sp. nov., an anaerobic, thermophilic, filamentous bacterium of a novel bacterial phylum, Caldiserica phyl. nov., originally called the candidate phylum OP5, and description of Caldisericaceae fam. nov., Caldisericales ord. nov. and Caldisericia classis nov, „International Journal of Systematic and Evolutionary Microbiology”, 59 (Pt 11), 2009, s. 2894–2898, DOI: 10.1099/ijs.0.010033-0, ISSN 1466-5026, PMID: 19628600 [dostęp 2021-03-15].
- ↑ Koji Mori, Satoshi Hanada, Thermodesulfobium, American Cancer Society, 2015, s. 1–5, DOI: 10.1002/9781118960608.gbm00753, ISBN 978-1-118-96060-8 [dostęp 2021-03-15] (ang.).
- ↑ Hiromi Nishida, Teruhiko Beppu, Kenji Ueda, Whole-genome comparison clarifies close phylogenetic relationships between the phyla Dictyoglomi and Thermotogae, „Genomics”, 98 (5), 2011, s. 370–375, DOI: 10.1016/j.ygeno.2011.08.001 [dostęp 2021-03-15] (ang.).
- ↑ E. Jumas-Bilak, L. Roudiere, H. Marchandin, Description of ‘Synergistetes’ phyl. nov. and emended description of the phylum ‘Deferribacteres’ and of the family Syntrophomonadaceae, phylum ‘Firmicutes’, „INTERNATIONAL JOURNAL OF SYSTEMATIC AND EVOLUTIONARY MICROBIOLOGY”, 59 (5), 2009, s. 1028–1035, DOI: 10.1099/ijs.0.006718-0, ISSN 1466-5026 [dostęp 2021-03-15] (ang.).
- ↑ Hans-Peter Horz i inni, Synergistes Group Organisms of Human Origin, „Journal of Clinical Microbiology”, 44 (8), 2006, s. 2914–2920, DOI: 10.1128/JCM.00568-06, ISSN 0095-1137, PMID: 16891512, PMCID: PMC1594628 [dostęp 2021-03-15].
- ↑ Radhey S. Gupta, Protein Phylogenies and Signature Sequences: A Reappraisal of Evolutionary Relationships among Archaebacteria, Eubacteria, and Eukaryotes, „Microbiology and Molecular Biology Reviews”, 62 (4), 1998, s. 1435–1491, ISSN 1092-2172, PMID: 9841678, PMCID: PMC98952 [dostęp 2021-03-15].
- ↑ Christopher T. Brown i inni, Unusual biology across a group comprising more than 15% of domain Bacteria, „Nature”, 523 (7559), 2015, s. 208–211, DOI: 10.1038/nature14486, ISSN 0028-0836 [dostęp 2021-03-18] (ang.).
- ↑ a b Laura A. Hug i inni, A new view of the tree of life, „Nature Microbiology”, 1 (5), 2016, s. 1–6, DOI: 10.1038/nmicrobiol.2016.48, ISSN 2058-5276 [dostęp 2021-03-18] (ang.).
- ↑ a b Paula B. Matheus Carnevali i inni, Hydrogen-based metabolism as an ancestral trait in lineages sibling to the Cyanobacteria, „Nature Communications”, 10, 2019, DOI: 10.1038/s41467-018-08246-y, ISSN 2041-1723, PMID: 30692531, PMCID: PMC6349859 [dostęp 2021-03-18].
- ↑ a b Qiyun Zhu i inni, Phylogenomics of 10,575 genomes reveals evolutionary proximity between domains Bacteria and Archaea, „Nature Communications”, 10, 2019, DOI: 10.1038/s41467-019-13443-4, ISSN 2041-1723, PMID: 31792218, PMCID: PMC6889312 [dostęp 2021-03-18].
- ↑ Alan Beccati i inni, SILVA tree viewer: interactive web browsing of the SILVA phylogenetic guide trees, „BMC Bioinformatics”, 18 (1), 2017, s. 433, DOI: 10.1186/s12859-017-1841-3, ISSN 1471-2105, PMID: 28964270, PMCID: PMC5622420 [dostęp 2021-03-18].
- ↑ Pablo Yarza i inni, The All-Species Living Tree project: A 16S rRNA-based phylogenetic tree of all sequenced type strains, „Systematic and Applied Microbiology”, 31 (4), 2008, s. 241–250, DOI: 10.1016/j.syapm.2008.07.001 [dostęp 2021-03-18] (ang.).
- ↑ Stams A, de Bok F, Plugge C, van Eekert M, Dolfing J, Schraa G. Exocellular electron transfer in anaerobic microbial communities. „Environ Microbiol”. 3 (8), s. 371–382, 2006. DOI: 10.1111/j.1462-2920.2006.00989.x. PMID: 16478444.
- ↑ Barea J, Pozo M, Azcón R, Azcón-Aguilar C. Microbial co-operation in the rhizosphere. „J Exp Bot”. 417 (56), s. 1761–1778, 2005. DOI: 10.1093/jxb/eri197. PMID: 15911555.
- ↑ O’Hara A, Shanahan F. The gut flora as a forgotten organ. „EMBO Rep”. 7 (7), s. 688–693, 2006. DOI: 10.1038/sj.embor.7400731. PMID: 16819463.
- ↑ Zoetendal E, Vaughan E, de Vos W. A microbial world within us. „Mol Microbiol”. 6 (59), s. 1639–1650, 2006. DOI: 10.1111/j.1365-2958.2006.05056.x. PMID: 16553872.
- ↑ Gorbach S. Lactic acid bacteria and human health. „Ann Med”. 1 (22), s. 37–41, 1990. DOI: 10.3109/07853899009147239. PMID: 2109988.
- ↑ Salminen S, Gueimonde M, Isolauri E. Probiotics that modify disease risk. „J Nutr”. 5 (135), s. 1294–1298, 2005. PMID: 15867327.
- ↑ Fish D. Optimal antimicrobial therapy for sepsis. „Am J Health Syst Pharm”. s. S13–9. PMID: 11885408.
- ↑ Belland R, Ouellette S, Gieffers J, Byrne G. Chlamydia pneumoniae and atherosclerosis. „Cell Microbiol”. 2 (6), s. 117–127, 2004. DOI: 10.1046/j.1462-5822.2003.00352.x. PMID: 14706098.
- ↑ Heise E. Diseases associated with immunosuppression. „Environ Health Perspect”, s. 9–19, 1982. DOI: 10.2307/3429162. PMID: 7037390. PMCID: PMC1568899.
- ↑ L Saiman. Microbiology of early CF lung disease. „Paediatr Respir Rev.”. 5 Suppl A. s. S367–369. PMID: 14980298.
- ↑ Yonath A, Bashan A. Ribosomal crystallography: initiation, peptide bond formation, and amino acid polymerization are hampered by antibiotics. „Annu Rev Microbiol”, s. 233–251, 2004. DOI: 10.1146/annurev.micro.58.030603.123822. PMID: 15487937.
- ↑ Khachatourians G. Agricultural use of antibiotics and the evolution and transfer of antibiotic-resistant bacteria. „CMAJ”. 9 (159), s. 1129–1136, 1998. PMID: 9835883. PMCID: PMC1229782.
- ↑ Johnson M, Lucey J. Major technological advances and trends in cheese. „J Dairy Sci”. 4 (89), s. 1174–1178, 2006. PMID: 16537950.
- ↑ Hagedorn S, Kaphammer B. Microbial biocatalysis in the generation of flavor and fragrance chemicals. „Annu. Rev. Microbiol.”, s. 773–800, 1994. DOI: 10.1146/annurev.mi.48.100194.004013. PMID: 7826026.
- ↑ Cohen Y. Bioremediation of oil by marine microbial mats. „Int Microbiol”. 4 (5), s. 189–193, 2002. DOI: 10.1007/s10123-002-0089-5. PMID: 12497184.
- ↑ Neves LC, Miyamura TT, Moraes DA, Penna TC, Converti A. Biofiltration methods for the removal of phenolic residues. „Appl. Biochem. Biotechnol.”, s. 130–152, 2006. DOI: 10.1385/ABAB:129:1:130. PMID: 16915636.
- ↑ Liese A, Filho M. Production of fine chemicals using biocatalysis. „Curr Opin Biotechnol”. 6 (10), s. 595–603, 1999. DOI: 10.1016/S0958-1669(99)00040-3. PMID: 10600695.
- ↑ Aronson AI, Shai Y. Why Bacillus thuringiensis insecticidal toxins are so effective: unique features of their mode of action. „FEMS Microbiol. Lett.”. 1 (195), s. 1–8, 2001. DOI: 10.1111/j.1574-6968.2001.tb10489.x. PMID: 11166987.
- ↑ Bozsik A. Susceptibility of adult Coccinella septempunctata (Coleoptera: Coccinellidae) to insecticides with different modes of action. „Pest Manag Sci”. 7 (62), s. 651–654, 2006. DOI: 10.1002/ps.1221. PMID: 16649191.
- ↑ Chattopadhyay A, Bhatnagar N, Bhatnagar R. Bacterial insecticidal toxins. „Crit Rev Microbiol”. 1 (30), s. 33–54, 2004. DOI: 10.1080/10408410490270712. PMID: 15116762.
- ↑ Serres M, Gopal S, Nahum L, Liang P, Gaasterland T, Riley M. A functional update of the Escherichia coli K-12 genome. „Genome Biol”. 9 (2), s. RESEARCH0035, 2001. DOI: 10.1186/gb-2001-2-9-research0035. PMID: 11574054.
- ↑ Almaas E, Kovács B, Vicsek T, Oltvai Z, Barabási A. Global organization of metabolic fluxes in the bacterium Escherichia coli. „Nature”. 6977 (427), s. 839–843, 2004. DOI: 10.1038/nature02289. PMID: 14985762.
- ↑ Reed JL, Vo TD, Schilling CH, Palsson BO. An expanded genome-scale model of Escherichia coli K-12 (iJR904 GSM/GPR). „Genome Biol.”. 9 (4), s. R54, 2003. DOI: 10.1186/gb-2003-4-9-r54. PMID: 12952533.
- ↑ Walsh G. Therapeutic insulins and their large-scale manufacture. „Appl Microbiol Biotechnol”. 2 (67), s. 151–159, 2005. DOI: 10.1007/s00253-004-1809-x. PMID: 15580495.
- ↑ Graumann K, Premstaller A. Manufacturing of recombinant therapeutic proteins in microbial systems. „Biotechnol J”. 2 (1), s. 164–186, 2006. DOI: 10.1002/biot.200500051. PMID: 16892246.
Bibliografia
- Władysław J.H. Kunicki-Goldfinger: Życie bakterii. Warszawa: Wydawnictwo Naukowe PWN, 1998. ISBN 978-83-01-14378-7.
Linki zewnętrzne
 Karolina Głowacka i Aleksandra Ziembińska-Buczyńska, Bakterie – czy to one sterują naszym „ja”?, kanał „Radio Naukowe” na YouTube, 27 kwietnia 2023 [dostęp 2023-09-06].
Karolina Głowacka i Aleksandra Ziembińska-Buczyńska, Bakterie – czy to one sterują naszym „ja”?, kanał „Radio Naukowe” na YouTube, 27 kwietnia 2023 [dostęp 2023-09-06].- DSMZ Bacterial Nomenclature (ang.)
- Genera of the domain of Bacteria. bacterio.cict.fr. [zarchiwizowane z tego adresu (2013-06-03)]. (ang.).
- Bacterial Motility and Behavior – Movies (ang.) – filmy przedstawiające różne kultury bakterii
