Eigenschaften des Wassers
| Strukturformel des Wassermoleküls | |
|---|---|
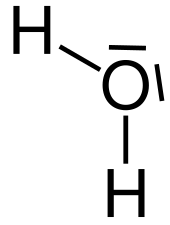
| |
| Kalottenmodell des Wassermoleküls | |

| |
| Allgemeines | |
| Name | Wasser |
| Andere Namen |
|
| Summenformel | H2O |
| CAS-Nummer | 7732-18-5 |
| PubChem | 962 |
| Kurzbeschreibung | transparente und nahezu farblose Flüssigkeit, zudem geschmacks- und geruchlos, wenn Reinstoff |
| zentrale Stoffdaten[2] | |
| Molare Masse | 18,015268 g·mol−1 [3] |
| Dichte | 3,98303 °C: 0,999975 g·cm−3 [4] 20 °C: 0,9982067 g·cm−3 [4] |
| Schmelzpunkt | 101,325 kPa: 0,002519 °C[5][6] |
| Siedepunkt | 101,325 kPa: 99,974 °C[5][7] |
| Tripelpunkt | 0,01 °C / 6,11655 hPa[7] |
| kritischer Punkt | 373,946 °C / 22,064 MPa / 322 kg/m³[7] |
| Isentropenexponent (Adiabatenexponent) | 1,3367 (100 °C, 1 bar) 1,3180 (200 °C, 1 bar)[8] |
| Sättigungsdampfdruck | 31,6874 hPa (25 °C) |
| spezifische Wärmekapazität | 4,184 kJ/(kg·K) (14,5 °C) |
| Wärmeleitfähigkeit | 0,597 W/(m·K) (20 °C) |
| Selbstdiffusionskoeffizient | 2,299·10−9 m2·s−1 (25 °C) |
| Verdampfungsenthalpie | 2257 kJ/kg / 40,8 kJ/mol |
| Schmelzenthalpie | 333,5 kJ/kg |
| Standardbildungsenthalpie | −285,8 kJ/mol (fl) −241,8 kJ/mol (g)[9] |
| elektrisches Dipolmoment | 6,152·10−30 C·m ≈ 1,84 D (Debye) |
| Brechungsindex | 1,33–1,35 (25 °C, sichtbares Licht) / 1,310 (Eis) |
| Dynamische Viskosität | 1,0 mPa s (20 °C) |
| relative Permittivität | 80,35 (20 °C) |
| pH-Wert (22 °C) | 7,0 |
| Löslichkeit | Gut in polaren, schlecht in unpolaren Lösungsmitteln |
| Kompressionsmodul K | 2,08·109 Pa |
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |
Die Eigenschaften des Wassers haben grundlegende Bedeutungen für das Leben auf der Erde. Diese physikalischen, chemischen, elektrischen und optischen Eigenschaften beruhen auf der Struktur des Wassermoleküls und den daraus resultierenden Verkettungen und Wechselwirkungen der Wassermoleküle untereinander über Wasserstoffbrückenbindungen, elektrische Dipolkräfte und weitere, wie die Van-der-Waals-Kräfte.
In der Natur kommt Wasser nicht als Reinstoff vor, es enthält praktisch immer gelöste Stoffe (vorwiegend Ionen von Salzen), wenn auch teils in kaum messbaren Konzentrationen. Solche gelösten Stoffe verändern die Eigenschaften des Wassers. Wasser ohne Metallionen kann im Labor und in der Technik durch Destillation hergestellt werden und wird destilliertes Wasser genannt. Zumeist wird in technischen Anwendungen demineralisiertes Wasser verwendet. Bei höheren Anforderungen wird dieses zu Reinstwasser aufbereitet.
Physikalische Eigenschaften
Die molare Masse des mittleren Wassers beträgt, errechnet aus den 2012 bestimmten Atommassen[10], 18,015268 g/mol[3].
Die Eigenschaften des Wassers sind besonders von der dreidimensionalen Verkettung der Wassermoleküle über Wasserstoffbrückenbindungen bestimmt, ohne die eine Substanz mit einer so geringen molaren Masse wie Wasser ganz andere Eigenschaften hätte.[11] Das gilt besonders für den hohen Schmelz- und Siedepunkt sowie für die Dichte, die unter Normaldruck bei rund 3,98 °C mit 0,999975 kg/dm3 am höchsten ist (siehe Dichte und Dichteanomalie).[4]
Von 1901 bis 1964 wurde die Einheit Liter mit dem Volumen von 1 kg Wasser bei der Temperatur seiner höchsten Dichte unter Normaldruck definiert.[12]
Die physikalischen Eigenschaften des Wassers sind auch stark von der Temperatur und dem Druck abhängig. So nehmen Oberflächenspannung[13] und Viskosität[14] mit zunehmender Temperatur ab. Ebenso ist die Kompressibilität[15] temperaturabhängig.
Aggregatzustände
 |
 |
Unter Normalbedingungen ist Wasser, wie im Phasendiagramm erkennbar, eine Flüssigkeit. Es ist der einzige bekannte Stoff, der auf der Erdoberfläche (siehe Hydrosphäre) in nennenswerten Mengen in allen drei klassischen Aggregatzuständen existiert. Das Phasendiagramm zeigt dabei, inwieweit der Aggregatzustand des Wassers von Temperatur und Druck abhängt. Der kritische Punkt des Wassers liegt bei 373,946 °C und 2,2064 · 107 Pa (322 kg/m³), der Tripelpunkt bei 0,01 °C und 611,657 ± 0,010 Pa.
Für die Eigenschaften und Besonderheiten der gasförmigen und festen Aggregatzustände des Wassers siehe die Artikel Wasserdampf und Eis. Bei überkritischem Wasser, also oberhalb des kritischen Punktes, ist eine Unterscheidung, ob ein Stoff flüssig oder gasförmig ist, nicht möglich.
Schmelz- und Siedepunkt
Im Vergleich mit seinen schwereren Analoga besitzt Wasser mit 100 °C einen außergewöhnlich hohen Siedepunkt (Schwefelwasserstoff (−61 °C), Selenwasserstoff (−41 °C), Tellurwasserstoff (−2 °C)). Dies lässt sich folgendermaßen begründen: Zum Übergang von der Flüssig- in die Gasphase müssen die anziehenden Kräfte zwischen benachbarten Molekülen überwunden werden. Bei Schwefel-, Selen- und Tellurwasserstoff bestehen diese im Wesentlichen aus Van-der-Waals-Kräften, die tendenziell bei größeren Molekülen höher ausfallen, da deren Polarisierbarkeit höher ist. Daher steigt der Siedepunkt mit steigender Molekülgröße von Schwefel- hin zu Tellurwasserstoff. (Unbedeutend sind in diesem Kontext hingegen die Unterschiede der molaren Masse, da die Erdanziehungskraft auf molekularer Ebene vernachlässigbar klein ist.) Im Gegensatz zu seinen schwereren Homologen ist Wasser ein stark polares Molekül. Dies bewirkt elektrostatische Anziehung zwischen den Einzelmolekülen.

Die stärksten intermolekularen Kräfte resultieren jedoch bei Wasser aus dessen Fähigkeit zur Ausbildung besonders starker Wasserstoffbrücken, die eine Form der Elektronenpaarbindung darstellen. Diese beiden Faktoren, Elektrostatische Anziehung und Wasserstoffbrücken, übersteigen Van-der-Waals-Kräfte in ihrer Stärke bei weitem, sodass Wasser trotz seiner geringen Molekülgröße den höchsten Siedepunkt dieser Reihe aufweist.
Wasser siedet also unter Normalbedingungen bei 100 °C und Eis schmilzt bei 0 °C. Wasser erstarrt demnach bei 0 °C; es kann allerdings auch bei Normalbedingungen unter 0 °C noch als Flüssigkeit vorliegen. Es handelt sich dann um unterkühltes Wasser. Hochreines Wasser kann theoretisch bis zu −48 °C flüssig bleiben.[16] Nach Computersimulationen geschieht dies durch Kristallisation in einer Tetraederform; im Zentrum des Kristalls ist ein Wassermolekül, welches von vier weiteren Molekülen umgeben ist. Bei dieser Temperatur gibt es nur noch diese Kristalle und keine freien Wassermoleküle mehr.[17][18] Bei Drücken zwischen 1000 und 2000 bar erstarrt Wasser unterhalb von −138 °C im amorphen Zustand.[19] Umgekehrt kann Eis auch für kurze Zeit über 0 °C noch fest bleiben, solange diese Temperatur nicht an der Oberfläche erreicht wird.[20][21] Der Siedepunkt des Wassers ist stark vom Sättigungsdampfdruck abhängig. Die Siedetemperatur sinkt bei Annäherung an den Tripelpunkt zusammen mit dem Siededruck und beide erreichen an diesem Punkt ihr Minimum. Wasser lässt sich zudem aber auch etwas über seinen Siedepunkt hinaus erhitzen, was man als Siedeverzug bezeichnet.
Auch im Wasser gelöste Stoffe verändern Siede- und Schmelzpunkt. So weist Wasser eine molare Schmelzpunkterniedrigung von 1,853 K·kg/mol und eine molare Siedepunkterhöhung von 0,513 K·kg/mol auf.
Früher wurde die Celsius-Temperaturskala über Schmelz- und Siedepunkt von Wasser definiert. Durch die aktuelle Definition der Celsius-Skala über die Kelvin-Skala sind Schmelz- und Siedepunkt von Wasser nicht mehr genau 0 °C und 100 °C, sondern liegen bei 0,002519 °C[5][6] (0,0024 °C nach BIPM[22]) und 99,9839 °C (99,9743 °C nach ITS-90).[5]
Eine Besonderheit beim Erstarren von Wasser ist der nach seinem Entdecker benannte Mpemba-Effekt, wonach heißes Wasser unter speziellen Bedingungen schneller gefriert als kaltes.
Erhitzen von Wasser

Wird Wasser in einem Topf auf einer Herdplatte erhitzt, erwärmt sich das Wasser am Boden schneller als das an der Oberfläche. So bildet sich ein labiler Temperaturgradient aus, der jedoch bald weitgehend durch Konvektion verschwindet. Erreicht das Wasser am Boden die Siedetemperatur, bilden sich dort Wasserdampfblasen. Beim Aufsteigen kühlen sie sich wieder ab und fallen zusammen. Sie erzeugen das typische prasselnde Geräusch, das kurz vor dem Sieden zu hören ist. Bei weiterer Wärmezufuhr kollabieren nur noch die kleinen Blasen, die großen steigen auf. Das Siedegeräusch wird leiser, um beim kompletten Sieden des Wassers ganz zu verschwinden.

Unter Mikrogravitation steigen die Dampfblasen im Wasser nicht auf. Stattdessen verharren sie in der Nähe des Topfbodens und konglomerieren zu größeren Blasen und schließlich zu einer einzigen großen Blase. Die fehlende Konvektion und die verringerte Wärmeleitung durch die Dampfblasen erschweren das schnelle Kochen von Wasser in einem Raumschiff.
Sublimation und Resublimation
Im Temperaturbereich von etwa 0 K bis 273,16 K (−273,15 °C bis +0,01 °C) und einem Druckbereich von Hochvakuum bis ungefähr 0,006 bar, im Bereich unterhalb des Tripelpunktes, existiert Wasser nicht in flüssiger Form, sondern nur gasförmig und fest. Eis geht in diesem Bereich, also am Sublimationspunkt, direkt in den gasförmigen Zustand über, ohne dass eine Aggregatzustandsänderung in eine Flüssigkeit stattfindet. Dieser Vorgang wird als Sublimation bzw. in Gegenrichtung als Resublimation bezeichnet. Im Vakuum findet die Sublimation bis fast 0 Kelvin (−273,15 °C) statt. Die Obergrenze ist hingegen durch den Tripelpunkt gegeben.
Spezifische Wärmekapazität
Flüssiges Wasser hat eine sehr hohe spezifische Wärmekapazität von etwa 4,2 kJ/(kg·K) (unter Normaldruck im Temperaturbereich 0 bis 100 °C zwischen 4,219 und 4,178 kJ/(kg·K)[23]). Man braucht also für die Erhitzung eines Kilogramms um ein Kelvin 4,2 Kilojoule an thermischer Energie. Das bedeutet, dass Wasser im Vergleich mit anderen Flüssigkeiten und Feststoffen recht viel Energie aufnehmen kann. Die vergleichsweise hohe spezifische Wärmekapazität von Wasser findet ihre Anwendung zum Beispiel bei Wärmespeichern von Heizungen.
Erhitzt man 1 kg Wasser von 15 °C auf 100 °C, dann benötigt man also 4,2 kJ/(kg·K) · 85 K · 1 kg = 357 kJ. Eine Kilowattstunde (kWh) sind 3,6 MJ. Um einen Liter Wasser von Leitungstemperatur unter normalem Druck auf 100 °C zu erhitzen, braucht man also etwa 0,1 kWh Energie. Um das Wasser dann verdampfen zu lassen, wird zusätzlich die 6-fache Menge Energie benötigt (siehe unten).
Wasserdampf (bei 100 °C) hat eine spezifische Wärmekapazität von 1,870 kJ/(kg·K) und Eis (bei 0 °C) 2,060 kJ/(kg·K). Feste Stoffe haben in der Regel eine deutlich niedrigere spezifische Wärmekapazität. So hat etwa Blei eine Wärmekapazität von 0,129 kJ/(kg·K), Kupfer eine von 0,380 kJ/(kg·K).
Schmelz- und Verdampfungsenthalpie
Für das Auftauen, also die Umwandlung von 0 °C kaltem Eis in 0 °C kaltes Wasser, muss eine Energie von 333,5 kJ/kg aufgebracht werden. Mit der gleichen Energiemenge kann man dieselbe Menge Wasser von 0 °C auf 80 °C erwärmen. Zur Umwandlung von 100 °C warmem Wasser in 100 °C warmen Dampf werden 2257 kJ/kg benötigt. Um 0 °C kaltes Wasser in 100 °C warmen Dampf zu verwandeln, benötigt man 100 K · 4,19 kJ/(kg·K) + 2257 kJ/kg = 2676 kJ/kg.
Die spezifische Verdampfungsenthalpie des Wassers liegt wesentlich höher als die von anderen Flüssigkeiten. Methanol hat eine Verdampfungsenthalpie von nur 845 kJ/kg und Quecksilber sogar von nur 285 kJ/kg. Vergleicht man allerdings die molaren Verdampfungsenthalpien, so hat Quecksilber mit 57,2 kJ/mol eine höhere als Wasser mit 40,6 kJ/mol.
In der Meteorologie haben die Schmelz- und Verdampfungsenthalpie des Wassers unter der thermodynamisch veralteten Bezeichnung Latente Wärme große Bedeutung.
Wärmeleitfähigkeit
Wasser hat im Vergleich zu anderen Flüssigkeiten eine hohe Wärmeleitfähigkeit, aber im Vergleich mit Metallen eine sehr geringe. Die Wärmeleitfähigkeit flüssigen Wassers nimmt mit steigender Temperatur zu, Eis leitet Wärme jedoch wesentlich besser als flüssiges Wasser.
Bei 20 °C weist Wasser eine Wärmeleitfähigkeit von 0,60 W/(m·K) auf. Zum Vergleich: Kupfer 394 W/(m·K) und Silber 429 W/(m·K). Selbst der schlechteste Wärmeleiter unter allen Metallen, Bismut kommt auf 7,87 W/(m·K).
Die Wärmeleitfähigkeit des Wassers in Form von Eis bei −20 °C beträgt immerhin 2,33 W/(m·K).
Dichte und Dichteanomalie

Wasser hat eine Dichte von rund einem Kilogramm pro Liter (ein Liter entspricht einem Kubikdezimeter). Dieses runde Verhältnis ist kein Zufall: es geht auf die Einheit Grave zurück, welche eine der historischen Wurzeln des heutigen internationalen Einheitensystems (SI) bildet. Ein Grave wurde als die Masse von einem Liter Wasser bei 4 °C definiert.
Bei Normaldruck hat Wasser seine größte Dichte bei 3,98 °C und zeigt damit eine Dichteanomalie. Diese besteht darin, dass sich Wasser unterhalb von 3,98 °C bei weiterer Temperaturverringerung, auch beim Wechsel zum festen Aggregatzustand, wieder ausdehnt, was man nur von wenigen Stoffen kennt.
Neben der Temperatur beeinflussen auch im Wasser gelöste Stoffe dessen Dichte, was man mit einem Aräometer messen kann. Da sich die gelösten Teilchen zwischen den Wassermolekülen verteilen und die Volumenzunahme gering ist, steigt dadurch die Dichte an. Die Zunahme der Dichte entspricht dabei in etwa der Masse an gelöstem Stoff pro Volumen und spielt eine wichtige Rolle für großräumige Wasserbewegungen, zum Beispiel im Rahmen der thermohalinen Zirkulation oder der Dynamik von Süßwasserlinsen.
Geruch und Geschmack
Wasser ist in reinem Zustand geschmack- und geruchlos.
Optische Eigenschaften


Brechung und Reflexionseigenschaften
Wasser hat im Bereich des sichtbaren Lichts einen Brechungsindex von ungefähr 1,33. Trifft Licht auf die Grenzfläche von Luft (Brechungsindex ≈ 1) und Wasser, wird es daher zum Lot hin gebrochen. Der Brechungsindex ist im Vergleich zu vielen anderen Materialien geringer, daher ist die Brechung durch Wasser weniger stark ausgeprägt als beispielsweise beim Übergang von Luft in die meisten Glassorten oder gar in Diamant. Es gibt aber auch Materialien wie Methanol, die einen geringeren Brechungsindex aufweisen. Die Lichtbrechung führt zu optischen Täuschungen, so dass man ein Objekt unter Wasser an einem anderen Ort sieht, als an dem es tatsächlich ist. Das Gleiche gilt für einen Blick aus dem Wasser in den Luftraum. Auf Fischfang spezialisierte Tiere, wie Fischreiher, oder nach Insekten über dem Wasser jagende Fische können diese Bild-Versetzung berücksichtigen und treffen ihre Beute deshalb meistens problemlos.
Das Reflexionsvermögen der Oberfläche Luft-Wasser beträgt nach den Fresnelschen Formeln bei senkrechtem Einfall etwa 2 %. Wie bei allen Materialien nimmt dieser Wert mit flacherem Einfallswinkel zu und ist bei streifendem Einfall näherungsweise 100 %. Das Reflexionsverhalten ist jedoch abhängig von der Polarisation des Lichtes. Dabei weist parallel polarisiertes Licht generell einen geringeren Reflexionsgrad als senkrecht polarisiertes Licht auf, das heißt, beim Auftreffen auf die Grenzfläche von Luft und Wasser wird Licht polarisiert. Durch den relativ geringen Brechungsindex von Wasser ist dieser Effekt jedoch geringer ausgeprägt als bei vielen anderen (transparenten) Materialien mit höherem Brechungsindex. Der Polarisationseffekt wird allgemein umso stärker, je flacher das Licht auf die Wasseroberfläche trifft. Dies wird beispielsweise in der Fotografie ausgenutzt, hier wird mit Hilfe eines Polarisationsfilters eine bestimmte Polarisation herausgefiltert, wodurch störende Reflexionseinflüsse reduziert werden können.
Trifft Licht vom Wasser her auf die Wasser-Luft-Grenzfläche, so kommt es als direkte Folge des Brechungsgesetzes ab einem Grenzwinkel von 49° zu einer Totalreflexion. Das bedeutet, dass flacher auf die Grenzfläche treffende Lichtstrahlen nicht aus dem Wasser austreten, sondern reflektiert werden.
Einige optische Effekte in der Atmosphäre sind an die Brechungseigenschaften des Wassers geknüpft. So wird zum Beispiel ein Regenbogen durch Wassertröpfchen oder ein Halophänomen durch Eiskristalle hervorgerufen, in denen das Licht gebrochen und dabei nach Spektralfarben aufgespalten wird. Auch die Abdunklung der Erde durch Wolken basiert auf Lichtbrechung und Totalreflexionen in beziehungsweise an Wassertröpfchen.
Absorptionsverhalten und Farbe

Wasser absorbiert Licht im sichtbaren Spektralbereich nur sehr schwach, das heißt, der Imaginärteil des komplexen Brechungsindex (Extinktionskoeffizient) ist näherungsweise 0. Wasser wird daher allgemein als transparent und farblos angesehen. Die große Lichtdurchlässigkeit des Wassers ermöglicht die Existenz von Algen und Pflanzen im Wasser, die Licht zum Leben benötigen.
Allerdings weist auch der geringe Extinktionskoeffizient im sichtbaren Spektralbereich Änderungen um mehrere Größenordnungen auf (siehe Abbildung). Im Wellenlängenbereich von ca. 400–440 nm ist der Extinktionskoeffizient und daher auch die Absorption (vgl. Lambert-Beersches Gesetz) am geringsten. Dies hat zur Folge, dass Licht dieser Wellenlängen erst nach mehreren Metern komplett absorbiert wird. Im roten sichtbaren und im nahen Infrarotbereich nimmt der Extinktionskoeffizient leicht zu. Langwelliges (rotes) Licht wird daher stärker absorbiert als kurzwelliges (blaues) Licht. Wasser erhält dadurch eine schwache bläuliche Färbung. Dies ist allerdings erst in dickeren Schichten ab einigen Metern mit dem bloßen Auge wahrnehmbar. UV-Licht wird erst bei einer Wellenlänge unterhalb von 240 nm in nennenswertem Maße absorbiert.[24]
Ein weiterer entscheidender Faktor, der die optischen Eigenschaften von Wasser beeinflusst, sind im Wasser gelöste Stoffe und im Wasser schwebende Teilchen. Im Wasser gelöste Stoffe können zu einer deutlichen Veränderung dieser Eigenschaften führen, was durch den spektralen Absorptionsgrad beschrieben wird. Kleine Teilchen mit einem Durchmesser im Bereich der Wellenlänge führen hingegen zur Streuung des Lichts, das Wasser wirkt dann leicht trüb (oder umgangssprachig milchig). Färbung und Trübung des Wassers in Abhängigkeit von den in ihm enthaltenen Substanzen spielen eine wichtige Rolle als Indikatoren für die Wasserqualität sowie auch als Untersuchungsmethode in der Wasseranalytik.
Elektromagnetische Anregung und Resonanz
Die niedrigste Resonanzfrequenz des freien Wassermoleküls liegt bei 22,23508 GHz. Die ganzzahligen Vielfachen dieser Frequenz ergeben wiederum Resonanz.
Hingegen nur rund ein Neuntel davon beträgt die übliche Frequenz von 2,455 GHz des Mikrowellenherds – im Haushalt wie auch im Chemielabor. Erst diese geringere Frequenz (in einem ISM-Band) erlaubt mehrere Zentimeter tiefes Eindringen in das wasserhaltige Medium und damit die Erhitzung „von innen“.
Spezifischer Widerstand und elektrische Leitfähigkeit

Chemisch reines Wasser ist bei einem pH-Wert von 7 nur in geringem Umfang in die elektrischen Ladungsträger H3O+ und OH− dissoziiert. Es besitzt daher einen hohen spezifischen Widerstand von 18,2 MΩ·cm (= 1,82·1011 Ω·mm²/m) bei 25 °C. Dieses entspricht einem spezifischen Leitwert von 54,9 nS·cm−1. Dieser Leitwert steigt mit der Temperatur um ungefähr 1,5 bis 2 % pro Kelvin. Gelöste Salze und Säuren (dazu gehört schon gelöstes Kohlenstoffdioxid aus der Atmosphäre) erhöhen die Ladungsträgerkonzentration. So erhöht sich die Leitfähigkeit von Reinstwasser schon bei Kontakt mit Luft. Bereits Leitungswasser erreicht je nach Mineralgehalt bis etwa die 10.000-fache Leitfähigkeit von durchschnittlich 500 μS·cm−1, Meerwasser erreicht Werte von 50 mS·cm−1.
Der Grotthuss-Mechanismus erhöht die Leitfähigkeit von Protonen und Hydroxid-Ionen in Wasser, welche durch Autodissoziation von Wasser entstehen.
Viskosität
Die dynamische Viskosität (Zähigkeit) des Wassers bei 20 °C beträgt 1,0 mPa s. Es hat damit eine höhere Viskosität als Petroleum (0,65 mPa s bei 20 °C), aber auch eine niedrigere als zum Beispiel Quecksilber (1,5 mPa·s bei 20 °C). Die Viskosität des Wassers nimmt durch die abnehmende Zahl von Wasserstoffbrückenbindungen mit zunehmender Temperatur ab und erreicht am Siedepunkt 0,283 mPa·s.
Die Viskosität wird durch gelöste Stoffe verändert. Neben der Konzentration ist die Art des gelösten Stoffes ausschlaggebend für die Viskosität der Lösung.
Diffusion
Die Diffusion der Wassermoleküle innerhalb des Wassers oder einer wässrigen Lösung wird als Selbstdiffusion bezeichnet und durch den Selbstdiffusionskoeffizienten D beschrieben; bei 25 °C beträgt dieser D = 2,299 · 10−9 m2·s−1.[25] Die Größe D beschreibt die translatorische Beweglichkeit der Wassermoleküle innerhalb der Flüssigkeit Wasser. Diese Beweglichkeit ist qualitativ bei Newtonschen Flüssigkeiten an das viskose Verhalten gekoppelt, also die mit steigender Temperatur abnehmende Viskosität des Wassers ist mit einem zunehmenden Selbstdiffusionskoeffizienten verbunden.
Die Temperaturabhängigkeit des Selbstdiffusionskoeffizienten ist sehr genau gemessen[25] und dient oft als Referenzwertesatz beim Studium der Diffusion in anderen Flüssigkeiten.
Neben der translatorischen Diffusion gibt es im Wasser – wie in anderen Flüssigkeiten auch – die Rotationsdiffusion, nämlich die regellose Orientierungsänderung der Symmetrieachsen der Wassermoleküle durch Zufallsbewegungen innerhalb der Flüssigkeit. Die diese Umorientierungsbewegung charakterisierende Korrelationszeit, d. h. ungefähr die Zeit, während der sich ein Wassermolekül in der Flüssigkeit, durch regellose Kleinschritte, einmal um sich selbst gedreht hat, liegt bei 25 °C im Bereich von wenigen Picosekunden, wie mittels kernmagnetischer Relaxation[26] und dielektrischer Relaxation gemessen wurde.[27] Es handelt sich also um extrem schnelle, regellose Umorientierungen der Wassermoleküle und damit auch um genauso schnelle Änderungen der Mikrostruktur des Wassers.
Wenn Wasser mit einer anderen isotopischen Zusammensetzung vorliegt, z. B. schweres Wasser D2O, dann tritt ein sogenannter dynamischer Isotopeneffekt auf, der sich sowohl auf die translatorische als auch die rotatorische Diffusion auswirkt. Da bei der geringen molaren Masse des Wassers die relative Änderung des Gewichts durch Isotopensubstitution vergleichsweise groß ist, treten beim Wasser, gegenüber anderen bekannten Flüssigkeiten, die größten Isotopeneffekte auf. So hat bei 25 °C D2O einen 23 % niedrigeren Diffusionskoeffizienten als H2O.[28]
Gelöste Stoffe, z. B. Salze, können den Selbstdiffusionskoeffizienten und die Rotationsdiffusion des Wassers sowohl erniedrigen („strukturbildende“ Salze mit kleinen Ionenradien, wie Lithiumchlorid) als auch erhöhen („strukturbrechende“ Salze mit großen Ionenradien, wie Caesiumiodid)[29]. Strukturbrechende Salze, bei denen das Anion die Wasser-Strukturbrechung verursacht, sind häufig auch chaotrope Salze. Löst man unpolare oder elektrisch ungeladene Spezies in Wasser, so tritt ein hydrophober Effekt auf, der, neben der Rotation, auch die Diffusionsbewegung der Wassermoleküle in der Nähe dieser „hydrophoben“ Spezies verlangsamt und damit den gemittelten Diffusionskoeffizienten des Wassers in der Lösung verringert.
Oberflächenspannung und Benetzbarkeit

Wasser weist eine vergleichsweise große Oberflächenspannung auf, da sich die Wassermoleküle gegenseitig relativ stark anziehen. Die Oberflächenspannung beträgt etwa 73 mN/m bei 20 °C und nimmt bei zunehmender Temperatur ab. Wegen der großen Oberflächenspannung können sich beispielsweise Wasserläufer auf dem Wasser bewegen. Bei Waschvorgängen ist Oberflächenspannung hinderlich, weshalb in Waschmitteln grenzflächenaktive Stoffe (Tenside) enthalten sind, die die Oberflächenspannung senken. Deren Vorkommen ist in natürlichen Gewässern jedoch gering.
Bei einer glatten Oberfläche können Kontaktwinkel von maximal 120° erreicht werden. Bei aufgerauten Oberflächen mit hydrophobem Charakter kann dieser Winkel jedoch auch bis zu 160° betragen, was man als Superhydrophobie bezeichnet. Dieses machen sich viele Pflanzen über den Lotuseffekt zunutze.
Kompressionsmodul und Schallgeschwindigkeit

Wasser hat unter Normaldruck bei einer Temperatur von 4 °C einen Kompressionsmodul von ungefähr K = 2,06 GPa. Bei 100 MPa (tausendfacher Normaldruck bzw. Wasserdruck in knapp 10 km Tiefe) verringert sich sein Volumen um etwa 5 Prozent.
Die Ausbreitungsgeschwindigkeit von Schall in Wasser ergibt sich entsprechend der Dichte von ρ = 1 kg/dm3 zu cS = 1435 m/s.
Isotopenfraktionierung
Wassermoleküle können aus verschiedenen Isotopen des Wasserstoffs (stabile Isotope: Protium 1H und Deuterium 2H) und des Sauerstoffs (stabile Isotope:16O, 17O und 18O) bestehen, die jeweils in unterschiedlichen Konzentrationen vorkommen. Es existieren neun stabile Isotopenzusammensetzungen des Wassermoleküls. Diese unterscheiden sich geringfügig in ihren physikalischen und chemischen Eigenschaften (Isotopeneffekt). Bei vielen Vorgängen wie der Niederschlagsbildung und deren Phasenübergängen kommt es dabei zur Isotopenfraktionierung, das heißt, das (transportierte) Wasser verändert hierbei seine Isotopenzusammensetzung. Je nach Umgebungsbedingungen und der ursprünglichen Zusammensetzung ergeben sich hieraus spezifische Isotopensignale, die als eine Art Fingerabdruck für unterschiedliche Prozesse und Herkunftsgebiete fungieren können. Anwendung findet die entsprechende Methodik vor allem in der Hydrogeologie und Paläoklimatologie.[30][31]
Auf der anderen Seite machte genau diese Eigenschaft massive Probleme bei der Definition der Temperaturskale über den Tripelpunkt von Wasser, da dieser von der genauen Isotopenzusammensetzung abhängig ist. Es sollte Vienna Standard Mean Ocean Water zum Einsatz kommen, das zwar definiert ist, das es aber so gar nicht natürlich gibt.
Wasser als Lösungsmittel
Wasser ist durch seinen Dipol ein gutes polares Lösungsmittel für die meisten Stoffe. Generell gilt, dass die Wasserlöslichkeit mit steigender Polarität des Stoffes zunimmt. Wasser besitzt eine vergleichsweise hohe Dielektrizitätszahl von 80,35 (bei 20 °C).[2]
Die Löslichkeit in Wasser ist oft stark von der Temperatur abhängig. Dabei verhalten sich Feststoffe und Gase unterschiedlich. Gase lösen sich proportional zum Partialdruck des Gases in Wasser ohne eine feste Begrenzung der lösbaren Menge (Henry-Gesetz). Die hierbei als „Löslichkeit“ bezeichnete Gleichgewichtskonzentration je Druckeinheit nimmt mit zunehmender Temperatur ab. Dagegen lösen sich Feststoffe bei zunehmender Temperatur meistens besser in Wasser, wovon es aber auch viele Ausnahmen gibt, wie bei Lithiumsulfat.
Manche Substanzen wie Aceton oder Ethanol sind in beliebigem Verhältnis mit Wasser mischbar, also ineinander löslich. In anderen Fällen gibt es wechselseitige Lösungen mit einer Mischungslücke, zum Beispiel mit Phenol oder Chloroform.
Normalerweise gilt, dass ein molekularer Stoff sich umso besser in Wasser löst, je mehr polare Gruppen in diesem Stoff vorhanden sind. Überkritisches Wasser zeigt jedoch ähnliche Löslichkeitseigenschaften wie unpolare organische Lösungsmittel.
Beim Auflösen von ionischen Stoffen im Wasser laufen der endotherme Gitterabbau und die exotherme Hydratation ab, was Wärmemischungen (Schwefelsäure in Wasser) und Kältemischungen (Salze in Wasser) ermöglicht. Dabei entscheidet die Differenz zwischen der exothermen Hydration und dem endothermen Gitterabbau, ob eine Erwärmung oder eine Abkühlung eintritt. Bei Salzen entscheidet das Verhältnis zwischen Gitterenergie und Hydratationsenergie der beteiligten Ionen über die Löslichkeit, die hier definiert ist als das Produkt der molaren Ionenkonzentrationen bei Gleichgewicht mit der kristallinen Substanz (Löslichkeitsprodukt). Als Faustregel für die Löslichkeit von Ionenverbindungen kann gelten: Je höher die Ladungszahl der beteiligten Ionen, desto schwerer löslich ist der Stoff in Wasser.
Im Unterschied zu einfachen Verbindungen wie Natriumchlorid werden die Ionenbindungen von Komplexen nicht gespalten. Dabei unterscheidet man zwischen zwei Gruppen. Auf der einen Seite den starken Komplexen, wie die Cyanid-Komplexe der Schwermetalle, und auf der anderen Seite die schwachen Komplexe (Aquakomplexe) der Metallionen mit Sulfat-, Hydroxy- oder Carbonationen. Die Art und das Vorkommen der verschiedenen Metallspezies sind wichtige Fragestellungen der chemischen Wasseranalytik und Wasseraufbereitung.
Bei Molekülen mit unterschiedlicher Polarität, wie bei vielen amphiphilen Lipiden, richtet sich die Wasserlöslichkeit oder Wasseraffinität nach dessen Ausrichtung. Diesen Effekt machen sich fast alle Lebewesen mit ihren Biomembranen zunutze. Man spricht in diesem Kontext auch von einer Hydrophilie oder Hydrophobie.
Chemische Eigenschaften
Wasser hat eine molare Masse von 18,01528 g·mol−1. Wasser ist bei vielen Reaktionen ein Katalysator, das heißt, ohne die Anwesenheit von Wasser würde eine Reaktion wesentlich langsamer und nur mit höherer Aktivierungsbarriere ablaufen. Viele Reaktionen werden sogar durch die normale Luftfeuchtigkeit ermöglicht oder beschleunigt. Das fällt durch die eigentlich immer vorhandenen Spuren von Feuchtigkeit in unserer Umwelt praktisch nicht auf, da es auf der Erde den Normalfall darstellt. Erst wenn durch spezielle Trocknungsverfahren auch geringste Reste von Feuchtigkeit entfernt und die chemischen Versuche in geschlossenen Systemen durchgeführt werden, ist das nachzuweisen. So brennt in dieser Umgebung zum Beispiel Kohlenstoffmonoxid nicht in Sauerstoff und Alkalimetalle reagieren nicht mit Schwefelsäure und Chlor.
Reaktivität
Wasser ist amphoter, ist also ein Stoff, der – je nach Milieu – sowohl als Säure als auch als Base wirken kann.
Wasser reagiert mit Anhydriden zu Säuren oder Basen. Beispiele:
- Phosphorpentoxid (Säureanhydrid) reagiert mit Wasser zu Phosphorsäure (Säure):
- Natriumoxid (Basenanhydrid) reagiert mit Wasser zu Natriumhydroxid (Base):
Wasser reagiert mit unedlen Metallen unter Wasserstoffbildung zu Metalloxiden, diese Metalloxide sind aber Basenanhydride und lösen sich meistens gleich wieder in Wasser zu Basen, wie eben beschrieben wurde. Ein Beispiel:
- Magnesium reagiert mit Wasserdampf zu Magnesiumoxid und Wasserstoff:
Nivellierender Effekt
In wässrigen Lösungen dissoziieren starke Säuren und starke Basen vollständig, wobei H3O+- bzw. OH−-Ionen entstehen. So lassen sich die unterschiedlichen Säurestärken von z. B. Chlorwasserstoff und Perchlorsäure in Wasser nicht mehr anhand des pH-Wertes unterscheiden. Hier spricht man vom nivellierenden Effekt (v. frz.: niveler = gleichmachen) des Wassers. Um auch sehr starke Säuren bezüglich der Säurestärke unterscheiden zu können, bestimmt man Gleichgewichtskonstanten in nichtwässrigen Lösungen und überträgt diese annäherungsweise auf das Lösungsmittel Wasser.
Neutralität, pH-Wert und fehlende Pufferwirkung
Wenn eine Lösung die Ionen H+ und OH− in derselben Konzentration enthält, so ist die Lösung neutral. Auch bei reinem Wasser ist ein kleiner Teil davon in die Ionen H+ bzw. H3O+ und OH− aufgetrennt, aber die Konzentrationen sind gleich und daher ist es neutral. In Wasser mit 22 °C ist die Konzentration 10−7 mol/l, so dass es einen pH-Wert von 7 hat.
Die Ionen H3O+ und OH− sind hydratisiert, wobei das H3O+ rasch ein Proton auf umgebende Wassermoleküle übertragen kann bzw. OH− eines aufnimmt. Infolge der Wärmebewegung und vor allem wegen der raschen Protonenaustausches nach dem Grotthuß-Mechanismus entsteht beim Zusammengießen von gleichen Mengen H2O und D2O nach kurzer Zeit daraus ein Gemisch mit statistischer Verteilung, also mit 50 % HDO.
Chemisch reines Wasser hat keine Pufferwirkung und reagiert somit auf geringste Mengen von sauren oder basischen Stoffen mit einer deutlichen pH-Wert-Änderung. So stellt sich in zuvor reinem Wasser bei Luftzutritt infolge Lösung von CO2 schnell ein pH-Wert zwischen 4,5 und 5 ein. Andererseits reagiert Wasser mit gelösten Salzen (z. B. Hydrogencarbonate) wesentlich unempfindlicher auf die Zugabe von sauren oder basischen Stoffen.
Ionenprodukt


Das Ionenprodukt des Wassers ist das Produkt der Konzentrationen der H3O+ und OH−-Ionen im Wasser. Im Jahr 1894 untersuchten Friedrich Wilhelm Georg Kohlrausch und Ernst Heydweiller durch Destillation von Wasser unter völligem Luftabschluss die Leitfähigkeit von destilliertem Wasser (siehe Dissoziation). Aus diesen Messungen und aus Kenntnis der Äquivalentleitfähigkeiten von Oxoniumionen und Hydroxidionen ließ sich das Ionenprodukt von Wasser berechnen.
Bei einer Leitfähigkeitsmessung von destilliertem Wasser tritt ein geringer Stromfluss auf. Dieses ist ein Hinweis auf Ionen im Wasser, die nur durch die Autoprotolyse des Wassers entstanden sein können, gemäß folgender Reaktion:
Auf das Protolysegleichgewicht lässt sich das Massenwirkungsgesetz anwenden:
Da die Konzentration der Wassermoleküle auch bei einer Verschiebung des Gleichgewichts fast konstant bleibt (55,5 mol/l), kann man den Wert in die Konstante mit einbeziehen.
und beides zu einer neuen Konstante vereinigen, dem Kw-Wert, der das Produkt aus den jeweiligen Konzentrationen der Oxonium- und der Hydroxidionen ist:
Bei 22 °C gilt Kw=10−14 (mol/l)². Damit liegt das Gleichgewicht sehr stark auf der Seite des Wassers. Die Konzentrationen von H3O+ und OH−-Ionen betragen jeweils 10−7 mol/l. Der pH-Wert ist also 7.
Wird die Konzentration einer der beiden Ionen erhöht, bleibt das Ionenprodukt von 10−14 erhalten, d. h., die Konzentration des anderen Ions sinkt. Die Summe von pH- und pOH-Wert muss deshalb immer 14 sein.
Der pKW des Wassers ändert sich in Abhängigkeit von der Temperatur.
| T in °C | 0 | 20 | 22 | 40 | 80 |
|---|---|---|---|---|---|
| pKW | 14,9 | 14,2 | 14,0 | 13,5 | 12,6 |
| c(H3O+) in mol/l | 10−7,45 | 10−7,1 | 10−7 | 10−6,75 | 10−6,3 |
(durch Leitfähigkeitsmessung experimentell bestimmte Werte)
Mit Kenntnis des Ionenproduktes von Wasser lassen sich die pH-Werte von gelösten Salzen, Säuren, Basen in Wasser (z. B. Natriumacetat, Natriumcarbonat, Calciumoxid, Salzsäure, Schwefelsäure, Natronlauge) berechnen.
Reaktionsordnung der Autoprotolyse des Wassers
Wird die Autoprotolyse des Wassers in folgender Form betrachtet:
ergibt sich für die Hinreaktion, also die Dissoziation, formal eine Reaktion 0. Ordnung. Für die Rückreaktion folgt so formal eine Reaktion 2. Ordnung.
Wasserhärte
Wasserhärte beschreibt die Äquivalentkonzentration der im Wasser gelösten Ionen der Erdalkalimetalle. Zu den „Härtebildnern“ zählen im Wesentlichen Calcium- und Magnesiumionen sowie in Spuren Strontium- und Bariumionen. Diese Kationen haben eine große, positive physiologische Bedeutung, stören jedoch bei einigen Verwendungen des Wassers.
Literatur
- Klaus Scheffler: Wasserdampftafeln: thermodynam. Eigenschaften von Wasser und Wasserdampf bis 800 °C u. 800 bar. Berlin 1981, ISBN 3-540-10930-7.
- Leopold Lukschanderl: Wasser: der Stoff, der zwar gewöhnlich aussieht, aber ganz außergewöhnliche Eigenschaften besitzt. Wien 1991, ISBN 3-85128-062-8.
- L. A. Guildner, D. P. Johnson, F. E. Jones: Vapor pressure of Water at Its Triple Point: Highly Accurate Value. In: Journal of Research of the National Bureau of Standard - A. Vol. 80A, Nr. 3, 1976, S. 505–521; doi:10.1126/science.191.4233.1261; PDF.
- Felix Franks (Hrsg.): Water, a Comprehensive Treatise Vol.I – Vol.VIII, Plenum Press, New York London, 1972–1982.
- Philip Ball: H2O – Biographie des Wassers Piper, 2001, ISBN 3-492-04156-6.
Weblinks
- hydroskript.de: Die physikalischen Eigenschaften des Wassers. ( vom 30. August 2016 im Internet Archive)
- Martin Chaplin: Water Structure and Science.
Einzelnachweise
- ↑ R. Panico, W.H. Powell, J.-C. Richer (Eds.): A Guide to IUPAC Nomenclature of Organic Compounds. Hrsg.: IUPAC Commission on the Nomenclature of Organic Chemistry. Blackwell Scientific Publications, Oxford 1993, ISBN 0-632-03488-2, S. 37.
- ↑ a b Lechner, Lühr, Zahnke (Hrsg.): Taschenbuch der Wasserwirtschaft. Gabler Wissenschaftsverlage, 2001, ISBN 3-8263-8493-8, S. 5 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Guideline on the Use of Fundamental Physical Constants and Basic Constants of Water. (PDF) IAPWS G5-01(2016). International Association for the Properties of Water and Steam, September 2016, abgerufen am 15. August 2017 (englisch): „The relative molar mass used in calculations (with the exception, mentioned above, of cases in which the isotopic composition is known to be different) should be that of VSMOW. This is computed by combining the isotopic composition of VSMOW with the accepted values of the masses of each isotope. Performing this calculation with the 2012 atomic mass evaluation yields a relative molar mass of 18.015 268, with an uncertainty of no greater than two in the last digit.“
- ↑ a b c M. Tanaka, G. Girard, R. Davis, A. Peuto, N. Bignell: Recommended table for the density of water between 0 °C and 40 °C based on recent experimental reports. In: Metrologia. Vol. 38, Nr. 4, 2001, S. 301–309, doi:10.1088/0026-1394/38/4/3 (englisch).
- ↑ a b c d Martin Chaplin: Water Structure and Science. Water Properties (including isotopologues). In: London South Bank University. 26. Februar 2016, abgerufen am 3. Mai 2016.
- ↑ a b Rainer Feistel, Wolfgang Wagner: A New Equation of State for H2O Ice Ih. In: Journal of Physical and Chemical Reference Data. Vol. 35, Nr. 2, 2006, S. 1021–1047, doi:10.1063/1.2183324 (englisch).
- ↑ a b c W. Wagner, A. Pruß: The IAPWS Formulation 1995 for the Thermodynamic Properties of Ordinary Water Substance for General and Scientific Use. In: Journal of Physical and Chemical Reference Data. Vol. 31, Nr. 2, 2002, S. 387–535, doi:10.1063/1.1461829 (englisch).
- ↑ Isobaric Properties for Water, auf webbook.nist.gov
- ↑ CRC-Handbook, S. 5–13 ( vom 26. April 2015 im Internet Archive).
- ↑ G. Audi, M. Wang, A.H. Wapstra, F.G. Kondev, M. MacCormick, X. Xu, B. Pfeiffer: The Ame2012 atomic mass evaluation. In: Chinese Physics C. Vol. 36, Nr. 12, 2012, S. 1287–1602, doi:10.1088/1674-1137/36/12/002 (englisch).
- ↑ Maurice L. Huggins: 50 Jahre Theorie der Wasserstoffbrückenbindung. In: Angewandte Chemie. Vol. 83, Nr. 5, 1971, S. 163–168, doi:10.1002/ange.19710830503.
- ↑ Internationales Büro für Maß und Gewicht (Hrsg.): Déclaration concernant la définition du litre (= Comptes rendus des séances de la … Conférence Générale des Poids et Mesures / Bureau International des Poids et Mesures. Band 3). Gauthier-Villars, Paris 16. Oktober 1901, DNB 010970436, LCCN sv91-007003, OCLC 476955218, Deuxième séance, S. 38 f. (französisch, 104 S., bipm.org [PDF; 12,1 MB; abgerufen am 15. August 2017]).
- ↑ Revised Release on Surface Tension of Ordinary Water Substance. (PDF) International Association for the Properties of Water and Steam, Juni 2014, S. 6, abgerufen am 16. August 2017 (englisch).
- ↑ Release on the IAPWS Formulation 2008 for the Viscosity of Ordinary Water Substance. (PDF) International Association for the Properties of Water and Steam, September 2008, S. 9, abgerufen am 16. August 2017 (englisch).
- ↑ Rana Fine, Frank J. Millero: Compressibility of water as a function of temperature and pressure. In: The Journal of Chemical Physics. Vol. 59, Nr. 10, 1973, S. 5529–5536, doi:10.1063/1.1679903 (englisch).
- ↑ Jan Oliver Löfken: Der wahre Gefrierpunkt von Wasser – minus 48 Grad Celsius. In: pro-physik.de. 24. November 2011, abgerufen am 21. Oktober 2019.
- ↑ Von wegen null Grad. Auf: wissenschaft.de vom 23. November 2011.
- ↑ Emily B. Moore, Valeria Molinero: Structural transformation in supercooled water controls the crystallization rate of ice. In: Nature. Band 479, Nr. 7374, 23. November 2011, S. 506–508, doi:10.1038/nature10586.
- ↑ P. H. Handle, M. Seidl, T. Loerting: Relaxation Time of High-Density Amorphous Ice. In: Physical Review Letters. Band 108, Nr. 22, 2012, S. 225901–225904, doi:10.1103/PhysRevLett.108.225901.
- ↑ Heißes Eis. In: pro-physik.de. 13. Januar 2006, ehemals im (nicht mehr online verfügbar); abgerufen am 3. Mai 2016. (Seite nicht mehr abrufbar. Suche in Webarchiven)
- ↑ H. Iglev, M. Schmeisser, K. Simeonidis, A. Thaller and A. Laubereau: Ultrafast superheating and melting of bulk ice. In: Nature. 439, 12. Januar 2006, S. 183–186, doi:10.1038/nature04415.
- ↑ Consultative Committee for Thermometry: Guide on Secondary Thermometry. Specialized Fixed Points above 0 °C. Hrsg.: Bureau International des Poids et Mesures. 24. Oktober 2018 (englisch, bipm.org [PDF; 839 kB; abgerufen am 17. März 2021]).
- ↑ Isobaric Properties for Water, auf webbook.nist.gov
- ↑ Die Fotolyse von Wasser schützte die Ursuppe und frühe Lebensformen. Prof. Blumes Bildungsserver für Chemie, 14. März 2001.
- ↑ a b M. Holz, S. R. Heil, A. Sacco: Temperature-dependent self-diffusion coefficients of water and six selected molecular liquids for calibration in accurate 1H NMR PFG Measurements. In: Phys. Chem. Chem. Phys. 2, 2000, S. 4740–4742; doi:10.1039/b005319h.
- ↑ H.G.Hertz: Microdynamic behaviour of liquids as studied by NMR relaxation times. In: Progress in Nuclear Magnetic Resonance Spectroscopy. Vol. 3, Pergamon Press, 1967, S. 159.
- ↑ Felix Franks: Water a matrix of life. Second Edition, RSC Paperbacks, Cambridge 2000, ISBN 0-85404-583-X, S. 28.
- ↑ Edme H. Hardy, Astrid Zygar, Manfred D. Zeidler, Manfred Holz, Frank D. Sacher: Isotope effect on the translational and rotational motion in liquid water and ammonia. In: J. Chem Phys. 114, 2001, S. 3174–3181; doi:10.1063/1.1340584.
- ↑ K. J. Müller und H. G. Hertz: A-Parameter as an Indicator for Water-Water Association in Solutions of Strong Electrolytes. In: J. Phys. Chem. 100, 1996, S. 1256–1265; doi:10.1021/jp951303w.
- ↑ Roberto Fernandez-Prini, A.H. Harvey, D.A. Palmer: Aqueous Systems at Elevated Temperatures and Pressures Physical Chemistry in Water, Steam and Hydrothermal Solutions. Academic Press, 2004, ISBN 0-08-047199-4, S. 290 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Bernward Hölting, Wilhelm G. Coldewey: Hydrogeologie Einführung in die Allgemeine und Angewandte Hydrogeologie. Springer-Verlag, 2013, ISBN 978-3-8274-2354-2, S. 114 (eingeschränkte Vorschau in der Google-Buchsuche).








