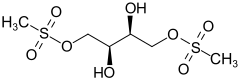
Treosulfan
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Treosulfan | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C6H14O8S2 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer, geruchloser, kristalliner Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Alkylans | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 278,30 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
≥100 mg/ml in Wasser (18,9 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Treosulfan ist ein Zytostatikum aus der Klasse der Alkylantien.[4]
Chemische und pharmazeutische Angaben
Treosulfan wurde bereits in den 1960er-Jahren synthetisiert.[5] Es handelt sich um ein Alkylsulfonat und Dihydroxyderivat des Busulfans. Die chemische Darstellung erfolgt beispielsweise durch Umsetzung von 1,4-Dibrombutan-2,3-diol[6] mit dem Silbersalz der Methansulfonsäure.[7] Aus Stabilitätsgründen werden Arzneimittel mit dem Wirkstoff in Pulverform und nicht in wässriger Lösung vertrieben. Pulver zur Zubereitung von Infusionslösungen lösen sich in Wasser nur langsam und neigen zur Bildung von Pulveragglomeraten. Treosulfan ist kompatibel mit isotonischer Kochsalzlösung oder 5 %iger Glucoselösung als Trägerlösung. Die applikationsfertige Lösung ist über einen in den Arzneimittelfachinformationen angegebenen Zeitraum chemisch-physikalisch stabil.[8]
Anwendungsgebiete
Es stehen verschiedene Präparate und Darreichungsformen zur Verfügung. Die Anwendungsgebiete unterscheiden sich zulassungsbedingt je nach Präparat:
- Ovastat 250 mg Hartkapseln zur oralen Einnahme wird angewandt als palliative Monotherapie bei fortgeschrittenem Ovarialkarzinom, wenn platinbasierte Therapien (z. B. mit Cisplatin) nicht angeschlagen haben.[8]
- Ovastat (1000 mg oder 5000 mg) Pulver zur Herstellung einer Infusionslösung wird kombiniert mit Cisplatin angewandt zur palliativen Therapie des Ovarialkarzinoms in den FIGO-Stadien 2 bis 4. Eine Monotherapie erfolgt bei bestehender Kontraindikation gegenüber Cisplatin.[8]
- Trecondi (1000 mg oder 5000 mg) Pulver zur Herstellung einer Infusionslösung wird zusammen mit Fludarabin zur Konditionierungstherapie zur Vorbereitung einer allogenen Stammzelltransplantation (allo-HSCT) angewandt, sowohl bei malignen als auch bei nicht-malignen Krankheiten.[8]
- Treosulfan Tillomed 5000 mg Pulver zur Herstellung einer Infusionslösung wird angewandt zur palliativen Therapie des fortgeschrittenen Ovarialkarzinoms nach Versagen von mindestens einer Standardtherapie (z. B. unter Cisplatin).[8]
Art der Anwendung
Treosulfan ist parenteral und oral anwendbar. Die patientenindividuelle Therapiedosis wird anhand der Körperoberfläche berechnet.[9]
Die orale Therapie bei Ovarialkarzinom erstreckt sich über 28 Tage, wobei 4 Einzeldosen in patientenindividueller Dosierung eingenommen werden. Eine Wiederholung ist nach 28-tägiger Therapiepause möglich.[9]
Die parenterale Anwendung bei Ovarialkarzinom erfolgt als intravenöse Kurzinfusion einmalig je Therapiezyklus von 28 Tagen. Mit Cisplatin kombiniert werden die Therapiezyklen alle 3 bis 4 Wochen wiederholt. Dabei sind in der Regel 6 Therapiezyklen vorgesehen. Ein dosis- und therapielimitierender Faktor kann das Auftreten einer Myelosuppression (Knochenmarksdepression) sein;[9] in Abhängigkeit der Wirkung auf die Zahl der Leukozyten und Thrombozyten kann eine Anpassung der Dosis erforderlich sein.[4]
Eine Prämedikation aus Ondansetron und Dexamethason soll durchgeführt werden um Nebenwirkungen abzumildern.[10]
Pharmakokinetik
Nach oraler Einnahme wird Treosulfan rasch und mit einer Bioverfügbarkeit von annähernd 100 Prozent[4] über die Darmschleimhaut in den Blutkreislauf aufgenommen. 50 bis 60 Prozent des Wirkstoffs werden unverändert über den Urin ausgeschieden, Treosulfan hat eine Plasmahalbwertszeit von 1,5 bis 1,8 Stunden.[8] Eine Plasmaeiweißbindung erfolgt nicht. Im Organismus erfolgt bei einem pH von circa 7,4 eine spontane (nicht-enzymatische) Umsetzung des Treosulfans in ein aktives, also pharmakologisch wirksames, Zwischenprodukt (ein Monoepoxid) und schließlich zum ebenfalls aktiven L-Diepoxybutan. Unter Laborbedingungen wurde für Diepoxybutan eine Halbwertszeit von 2,2 Stunden ermittelt.[4]
Wirkmechanismus
Treosulfan ist ein Prodrug, das zu einem Epoxid (o. g. Diepoxybutan) bioaktiviert wird.[9] Dieses fungiert als bifunktionelles Alkylans, es alkyliert Bestandteile der DNA und führt zu Quervernetzungen. Das zuerst entstehende Monoepoxid bindet am nukleophilen Zentrum der DNA, wodurch die Substanz bereits am Wirkort fixiert wird. Über den zweiten Epoxidring erfolgt eine weitere Bindung an die DNA. Durch diese Alkylierung der DNA werden dessen Funktion und damit der Zellstoffwechsel, der Zellzyklus und das Zell- und Tumorwachstum gehemmt.[4]
Nebenwirkungen
Häufige Nebenwirkungen von Treosulfan sind:
- Infektionsrisiko, sehr selten Sepsis[4]
- Myelosuppression mit Thrombozytopenie, Leukopenie und vermindertem Hämoglobin (in der Regel bildet sich diese wieder innerhalb von 28 Tagen zurück)[4]
- Malignomrisiko: aufgrund des Wirkmechanismus besteht das Risiko von genetischen Veränderungen durch Treosulfan bzw. seine aktiven Metaboliten, welche im weiteren Verlauf das Risiko von Leukämie, Myelom und myelodysplastischem Syndrom erhöhen. Bei 1,4 % (aus einer Population von 553 Patienten) kam es nach einer oralen Langzeittherapie zur Ausbildung einer akuten lymphatischen Leukämie. Das Risiko korreliert mit der kumulativen Dosis an Treosulfan.[4]
- Haarausfall, zumeist leicht, sowie eine bronzefarbene Pigmentierung der Haut treten bei über zehn Prozent der mit Treosulfan behandelten Patienten auf.[4]
Das emetogene Potential von Treosulfan wird als moderat im Falle der intravenösen Applikation bewertet. Das heißt, ohne adäquate Prophylaxe (z. B. Prämedikation mit Dexamethason und Ondansetron) tritt bei 30 bis 90 Prozent der Patienten Erbrechen auf. Im Falle der oralen Therapie mit Treosulfan ist die Wahrscheinlichkeit erheblich geringer.[11]
Weitere seltene oder sehr seltene Nebenwirkungen sind beispielsweise Panzytopenie, Morbus Addison, Hypoglykämie, Kardiomyopathie, Lungenfibrose, Alveolitis, Pneumonie, Sklerodermie, Aktivierung einer Psoriasis, Erytheme, Urtikaria und hämorrhagische Zystitis (Blasenentzündung).[4]
Gegenanzeigen
Es sind folgende Kontraindikationen bekannt, bei welchen die Anwendung von Treosulfan nicht erfolgen soll:
- Überempfindlichkeit gegenüber den Wirkstoff oder sonstige Bestandteile der Infusion[4]
- Niereninsuffizienz: leichte bis moderate Niereninsuffizienz ist keine Kontraindikation und auch eine Dosisanpassung ist nicht zwangsläufig erforderlich. Bei schwerer Niereninsuffizienz hingegen soll Treosulfan nicht verabreicht werden.[12]
- Myelosuppression, wenn sie schwer und andauernd ist[4]
- Schwangerschaft und Stillen: das Stillen muss unter der Therapie mit Treosulfan unterbrochen werden. Eine Schwangerschaft stellt eine Kontraindikation für den Einsatz von Treosulfan dar, sofern nicht der klinische Zustand der Patientin den Einsatz rechtfertigt.[4]
Ein Therapieabbruch ist dauerhaft erforderlich, wenn es zum Auftreten einer allergischen Alveolitis oder Lungenfibrose unter der Behandlung mit Treosulfan kommt.[4]
Patientinnen im gebärfähigen Alter müssen während sowie sechs Monate nach Beendigung der Behandlung auf eine effektive Schwangerschaftsverhütung achten.[4]
Toxikologie
Im Tierversuch zeigen sich negative Effekte auf Keimzellen. Bei Ratten wurden eine verzögerte Spermiogenese sowie ausbleibende Ausbildung der Gelbkörper und Follikel beobachtet. Aus klinischen Beobachtungen ergibt sich das bereits erwähnte karzinogene (tumor- bzw. malignomprovozierende) Potential des Wirkstoffs. Exposition von Ratten über sieben Monate führten zu verminderter Spermiogenese bei Männchen und einen gestörten Fortpflanzungszyklus bei weiblichen Tieren. An anderen Organen wurden keine Veränderungen festgestellt. Effekte akuter Überdosierungen bei Affen waren Störungen des blutbildenden Systems (Myelosuppression und die daraus resultierenden Effekte; vergleiche: Nebenwirkungen), Diarrhoe, Appetitlosigkeit und Gewichtsverlust.[4]
Sicherheitshinweise
Aufgrund des Gefahrstoffpotentials als mutagene Substanz sind entsprechende Schutzmaßnahmen beim Umgang mit dem Wirkstoff zu treffen, etwa die Zubereitung von Infusionslösungen durch qualifiziertes pharmazeutisches Personal und das Tragen geeigneter persönlicher Schutzausrüstung.[4] Im Falle einer Oberflächen- oder Umgebungskontamination mit Treosulfan sollte kein Reinigungsschritt mit einer Lauge erfolgen, wie es bei Zytostatikakontaminationen oftmals üblich ist. Hintergrund ist die pH-abhängige Aktivierung der Substanz zu den toxischen Epoxidverbindungen.[5]
Einzelnachweise
- ↑ a b c d e f Sigma Aldrich, Sicherheitsdatenblatt Treosulfan, Version 8.4; Überarbeitet am: 15.11.2022.
- ↑ a b PubChem/ NCBI: Treosulfan, aufgerufen am: 17.01.2024.
- ↑ Cameo Chemicals: Treosulfan, aufgerufen am: 17.01.2024.
- ↑ a b c d e f g h i j k l m n o p q r Tillomed Pharma: Zusammenfassung der Merkmale des Arzneimittels: Treosulfan Tillomed. Stand der Information: Oktober 2020. (PDF, www.zentiva.de, abgerufen am: 17. Januar 2024.)
- ↑ a b Hartley et al.: DNA alkylation and interstrand cross-linking by treosulfan in: British Journal of Cancer (1999) 79(2), 264–266.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu (2S,3S)-1,4-Dibrom-2,3-butandiol: CAS-Nr.: 14396-65-7, EG-Nr.: 627-179-3, ECHA-InfoCard: 100.155.563, PubChem: 98512, ChemSpider: 88957, Wikidata: Q72464003.
- ↑ Patentanmeldung WO2020064815A1: Crystalline form of Treosulfan. Angemeldet am 25. September 2019, veröffentlicht am 2. April 2020, Anmelder: Medac Gesellschaft für klinische Spezialpräparate mbH, Erfinder: Sebastian Bialleck et al.
- ↑ a b c d e f Arzneimittelfachinformation (Ovastat, Trecondi, Tillomed), Zugriff über Datenbank MMI Pharmindex Plus 2023.4
- ↑ a b c d Mutschler et al. (2016): Pharmakologie kompakt – Allgemeine und Klinische Pharmakologie, Toxikologie. Wissenschaftliche Verlagsgesellschaft, 1. Auflage.
- ↑ Engelhardt et al. (2019): Das Blaue Buch – Chemotherapie-Manual Hämatologie und Onkologie, Springer Verl., 7. Auflage.
- ↑ Jordan et al. (2021): Antiemese bei medikamentöser Tumortherapie, Onkopedia-Leitlinien, aufgerufen am 18. Januar 2024.
- ↑ UpToDate/ Lexicomp – Treosulfan, Version 39.0 (siehe auch: UpToDate-Monographie auf medilib.ir, Version ggfs. abweichend; aufgerufen am: 19. Januar 2024).
