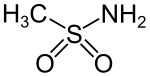
Methansulfonamid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Methansulfonamid | ||||||||||||||||||
| Andere Namen |
Methansulfonsäureamid | ||||||||||||||||||
| Summenformel | CH5NO2S | ||||||||||||||||||
| Kurzbeschreibung |
weißer kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 95,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Schmelzpunkt |
91–92 °C[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Methansulfonamid ist eine chemische Verbindung und der einfachste Vertreter aus der Stoffgruppe der Sulfonsäureamide.
Darstellung und Synthese
Die Darstellung von Methansulfonamid erfolgt durch Umsetzung von Methansulfonylchlorid mit Ammoniak.[1][3] Alternativ erhält man die Verbindung durch Umsetzung des Magnesiumsalzes der Methansulfonsäure[4] mit Hydroxylamin-O-sulfonsäure[5] bzw. durch die Reduktion (hier: Staudinger-Reaktion) von Methansulfonylazid mit Triphenylphosphin in Methanol.[6]
Eigenschaften
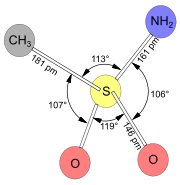
Aus einer Lösung von Methansulfonamid in Heptan erhält man Einkristalle der Verbindung als halbtransparente, weiße Täfelchen. Die Röntgenstrukturanalyse ergibt einen O-S-O-Valenzwinkel von 119°, der deutlich von dem Tetraederwinkel von 109,47° abweicht. Die Länge der Schwefel-Stickstoff-Bindung ist mit 161 Picometer deutlich kürzer als bei einer typischen Einfachbindung (173 Picometer) und entspricht der verkürzten Bindungslänge bei anderen Sulfonamiden. Ursache ist vermutlich die Donor-Akzeptor-Wechselwirkung des freien Elektronenpaars der Aminogruppe mit den 3d-Orbitalen des Schwefelatoms.[7]
Verwendung
Ausgehend von Methansulfonamid können verschiedene Reagentien für chemische Synthesen hergestellt werden. Beispielsweise erhält man aus Methansulfonamid 1, p-Toluolsulfonsäure[8] 2 und 1,1-Dimethoxy-2-(methylthio)ethan[9] 3 das N-(2-Methylthio-1-p-toluolsufonylethyl)methansulfonamid 4, eine Schlüsselverbindung bei der Synthese von symmetrisch substituierten Porphyrinen.[1][10]
Bei der Sharpless-Dihydroxylierung, der Oxidation von Olefinen mit Kaliumhexacyanidoferrat(III) und Osmium(VIII)-oxid zu cis-vicinalen Diolen, wirkt Methansulfonamid im abschließenden Hydrolyseschritt bei der Protonierung der Osmium-Zwischenstufe als Katalysator.[11]
Einzelnachweise
- ↑ a b c d Nachimuthu Soundararajan, Danielle Jacobs: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, Chichester, UK 2007, ISBN 978-0-471-93623-7, Methanesulfonamide, doi:10.1002/9780470842898.rm074.pub2.
- ↑ a b c Datenblatt Methansulfonamid bei Sigma-Aldrich, abgerufen am 1. Juli 2023 (PDF).
- ↑ Patent US3574740A: Method of Preparing Methane Sulfonamide and its Derivatives. Angemeldet am 11. Juni 1968, veröffentlicht am 13. April 1971, Anmelder: Pennwalt Corp., Erfinder: Martin Le Roy.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Methansulfonsäure: CAS-Nr.: 17696-73-0, EG-Nr.: 859-138-2, ECHA-InfoCard: 100.310.453, PubChem: 87251, ChemSpider: 78708, Wikidata: Q83040122.
- ↑ Horng-Chih Huang, Emily J. Reinhard, David B. Reitz: A novel one-pot conversion of methyl sulfones to sulfonamides. In: Tetrahedron Letters. Band 35, Nr. 39, 1994, S. 7201–7204, doi:10.1016/0040-4039(94)85360-6.
- ↑ Bikash Pal, Parasuraman Jaisankar, Venkatachalam S. Giri: Versatile Reagent for Reduction of Azides to Amines. In: Synthetic Communications. Band 34, Nr. 7, 2004, S. 1317–1323, doi:10.1081/SCC-120030322.
- ↑ L. G. Vorontsova: Crystal and molecular structure of methanesulfonamide. In: Journal of Structural Chemistry. Band 7, Nr. 2, 1967, S. 275–277, doi:10.1007/BF00744308.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu p-Toluolsulfonsäure: CAS-Nr.: 536-57-2, EG-Nr.: 208-638-3, ECHA-InfoCard: 100.007.855, PubChem: 10818, ChemSpider: 10361, Wikidata: Q2823311.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 1,1-Dimethoxy-2-(methylthio)ethan: CAS-Nr.: 40015-15-4, EG-Nr.: 628-705-4, ECHA-InfoCard: 100.156.953, PubChem: 638113, ChemSpider: 553674, Wikidata: Q72468096.
- ↑ Hideki Kinoshita, Shingo Tanaka, Katsuhiko Inomata: An Improved Method for the Preparation of Symmetrically Substituted Porphyrins via 2-Methoxymethyl-3,4-disubstituted Pyrrole Derivatives. In: Chemistry Letters. Band 18, Nr. 7, 1989, S. 1107–1108, doi:10.1246/cl.1989.1107.
- ↑ Mikko H. Junttila, Osmo O. E. Hormi: Methanesulfonamide: a Cosolvent and a General Acid Catalyst in Sharpless Asymmetric Dihydroxylations. In: The Journal of Organic Chemistry. Band 74, Nr. 8, 2009, S. 3038–3047, doi:10.1021/jo8026998.