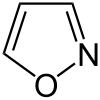
Isoxazol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Isoxazol | ||||||||||||||||||
| Andere Namen |
1,2-Oxazol (IUPAC) | ||||||||||||||||||
| Summenformel | C3H3NO | ||||||||||||||||||
| Kurzbeschreibung |
hellbraune Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 69,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,078 g·cm−3 (25 °C)[1] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
42,1 kJ/mol[2] | ||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Isoxazol ist ein von Furan und Pyrrol abgeleiteter stickstoffhaltiger Heterocyclus. Im Unterschied zum isomeren Oxazol befindet sich das Sauerstoffatom neben dem Stickstoff.
Darstellung
Die Darstellung des unsubstituierten Isoxazol durch Umsetzung von Propinal mit Hydroxylamin wurde erstmals 1903 von Ludwig Claisen beschrieben.[3] Als Ausgangsverbindung kann auch 2-Chloracrolein[S 1] eingesetzt werden, das beim Erhitzen mit wässrigem Hydroxylaminhydrochlorid Isoxazol ergibt.[4]
Die Cycloaddition von Norbornadien (3) mit Knallsäure – in situ mit Triethylamin aus Formohydroximoyljodid (2) freigesetzt – ergibt ein Isoxazol-Derivat (4), das durch eine thermische Retro-Diels-Alder-Reaktion Cyclopentadien (5) und Isoxazol (6) ergibt. Formohydroximoyljodid wird durch Umsetzung von Knallquecksilber (1) mit Iodwasserstoff und Kaliumiodid erhalten.[5]
Vorkommen und Verwendung
Isoxazolringe finden sich als Strukturelement in einigen Naturstoffen wie z. B. Ibotensäure und Muscimol, die aus dem Fliegenpilz (Amanita muscaria) und dem Pantherpilz (Amanita pantherina) isoliert wurden.[6] Isoxazole bilden auch die Grundlage für eine Reihe von Medikamenten, z. B. der COX-2-Inhibitor Valdecoxib (Bextra).
Eigenschaften
Das UV-Spektrum von Isoxazol hat sowohl in wässrigen als auch in ethanolischen Lösungen ein smaximum bei 211 nm. Die Verbindung gehorcht nicht dem Lambert-Beerschen Gesetz und weist mit zunehmender Konzentration Hypochromie (Abnahme der Bandenintensität) auf. Dieser Effekt ist eine Folge des Dipolmoments (2,76 Debye in Benzol, 3,01 Debye in Dioxan)[7] und der antiparallelen Sandwich-Selbstassoziation über Dipol-Dipol-Wechselwirkungen.[8]
Molekülorbital-Berechnungen zeigen, dass die 4-Position des Moleküls die größte Reaktivität bezüglich einer elektrophilen Substitution aufweist. Die Aromatizität der Verbindung ist moderat und geringer als die von Oxazol.[9]
Isoxazol ist eine sehr schwache Base (pKa=−2,03) und schwächer als andere heterocyclische Verbindungen wie Pyridin, Thiazol oder Oxazol. Dies deutet auf die dominierende induktive Wirkung des stark elektronegativen Ringsauerstoffs.[10]
Einzelnachweise
- ↑ a b c d e f Datenblatt Isoxazol bei Sigma-Aldrich, abgerufen am 16. November 2024 (PDF).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
- ↑ L. Claisen: Zur Kenntniss des Propargylaldehyds und des Phenylpropargylaldehyds. In: Berichte der deutschen chemischen Gesellschaft. Band 36, Nr. 3, 1903, S. 3664–3673, doi:10.1002/cber.190303603168.
- ↑ Paolo Grünanger, Paola Vita-Finzi: Isoxazoles. Part One. In: The Chemistry of Heterocyclic Compounds. John Wiley & Sons, New York 1990, ISBN 0-471-02233-0, S. 159 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Rolf Huisgen, Manfred Christl: 1,3-Dipolare Cycloadditionen, 72. Reaktionen der Knallsäure mit ungesättigten Verbindungen. In: Chemische Berichte. Band 106, Nr. 10, 1973, S. 3291–3311, doi:10.1002/cber.19731061017.
- ↑ Paolo Grünanger, Paola Vita-Finzi: Isoxazoles. Part One. In: The Chemistry of Heterocyclic Compounds. John Wiley & Sons, New York 1990, ISBN 0-471-02233-0, S. 2 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Paolo Grünanger, Paola Vita-Finzi: Isoxazoles. Part One. In: The Chemistry of Heterocyclic Compounds. John Wiley & Sons, New York 1990, ISBN 0-471-02233-0, S. 118 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Paolo Grünanger, Paola Vita-Finzi: Isoxazoles. Part One. In: The Chemistry of Heterocyclic Compounds. John Wiley & Sons, New York 1990, ISBN 0-471-02233-0, S. 8 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Paolo Grünanger, Paola Vita-Finzi: Isoxazoles. Part One. In: The Chemistry of Heterocyclic Compounds. John Wiley & Sons, New York 1990, ISBN 0-471-02233-0, S. 103 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Paolo Grünanger, Paola Vita-Finzi: Isoxazoles. Part One. In: The Chemistry of Heterocyclic Compounds. John Wiley & Sons, New York 1990, ISBN 0-471-02233-0, S. 114 (eingeschränkte Vorschau in der Google-Buchsuche).


