Immunantwort
| Übergeordnet |
|---|
| Reizantwort Prozess des Immunsystems |
| Untergeordnet |
| Angeborene I. Adaptive I. Humorale I. Gewebespezifische I. Typ-2-Immunantwort |
| Gene Ontology |
| QuickGO |
Die Immunantwort (auch Immunreaktion) bezeichnet in der Immunologie die Reaktion des Immunsystems auf potenziell schädliche Organismen oder Substanzen.[1] Unterschieden wird dabei zwischen der angeborenen und der erworbenen (oder auch adaptiven) Immunantwort. Die angeborene Immunantwort erkennt fremde Reize über vererbte Mechanismen, die von Geburt an funktionieren, während die erworbene Immunantwort dazu Rezeptoren verwendet, die erst nach Kontakt mit einem schädlichen (pathogenen) Organismus oder Substanz an diesen angepasst und in sehr großer Bandbreite in jedem Individuum gebildet werden. Die erworbene Immunantwort kann auf einen fremden pathogenen Organismus oder auf eine Substanz flexibel reagieren: Wird er als ungefährlich eingestuft, wird in Zukunft keine Reaktion mehr ausgelöst (Immuntoleranz).[2] Wird er als gefährlich eingestuft, wird eine Immunantwort ausgelöst, die eine Beseitigung des Organismus oder der Substanz zum Ziel hat.
Eigenschaften
Auslöser einer Immunantwort können in den Körper eingedrungene Erreger (z. B. Bakterien, Viren, Pilze, Parasiten), pathogene Moleküle (z. B. Prionen) oder krankhaft veränderte Zellen des eigenen Körpers sein (Krebszellen). Eine Immunantwort gegen normale Körperzellen kann auftreten, wenn körpereigene Stoffe fälschlich als fremd erkannt werden (Autoimmunität).[3] Auch an sich harmlose Substanzen aus der Umwelt können als gefährlich eingestuft werden und eine Reaktion hervorrufen, wie es bei Allergien vorkommt.[4] Wenn es dagegen Krankheitserregern gelingt, einer Immunantwort zu entkommen, wird dies als Immunflucht bezeichnet.[5]
Die Mechanismen, die im Verlauf einer Immunantwort die Beseitigung von eingedrungenen Erregern bewirken, sind vielfältig. Das Komplementsystem besteht aus Proteinkomplexen, die Erreger markieren oder direkt abtöten können. Antimikrobielle Substanzen werden auch von Zellen außerhalb des Immunsystems freigesetzt, z. B. antimikrobielle Peptide. Unterschiedlichste Fress- und Killerzellen können aktiviert werden. Antikörper binden hochspezifisch an fremdartige Strukturen. In der Regel sind mehrere dieser Effektormechanismen gleichzeitig aktiv, um eine vollständige Beseitigung der Erreger zu gewährleisten. Eine Überreaktion des Immunsystems muss jedoch verhindert werden, da sie starke Gewebeschäden oder sogar den Tod verursachen kann (Immunpathogenese,[6] wie z. B. ein anaphylaktischer oder septischer Schock). Weiterhin muss eine Reaktion gegen den eigenen Körper weitgehend ausgeschlossen werden, um Autoimmunerkrankungen zu vermeiden.[3] Daher bestehen innerhalb des Immunsystems vielfältige Regulationsmechanismen, um Selbstschädigung durch fehlerhafte oder übertriebene Immunantwort zu vermeiden.
Mit bestimmten Medikamenten kann die Immunantwort verändert werden, was als Immunmodulation bezeichnet wird. Typische Medikamente zur Abschwächung einer Immunantwort sind die Cortison-Verwandten (Glucocorticoide) und andere Immunsuppressiva, beispielsweise bei Allergien,[7] Organtransplantaten,[8] Immunpathogenese oder Autoimmunerkrankungen.[9] Bei manchen Impfstoffen werden dagegen manche Stoffe als Zusatz verwendet, die eine Immunantwort verstärken, wie manche Adjuvantien,[10] während bei Krebs Abwehr-verstärkende Medikamente wie Immuncheckpoint-Inhibitoren verwendet werden.
Angeborene Immunantwort
An der angeborenen Immunantwort ist eine Vielzahl von Zelltypen und löslichen Faktoren beteiligt, die zusammen ein eng verzahntes und gut abgestimmtes Abwehrsystem bilden. Dazu gehören das Komplementsystem, aber auch die PAMP-Rezeptoren.[11] Ausgelöst wird sie durch charakteristische Merkmale von Erregern (PAMP, englisch pathogen-associated molecular patterns ‚Pathogen-assoziierte molekulare Muster‘), die durch angeborene Rezeptoren erkannt werden. Sie erfolgt vergleichsweise schnell. Nur Minuten nach dem Eindringen werden die meisten Erreger erkannt und angegriffen, und oftmals sind sie bereits nach wenigen Stunden vollständig beseitigt.[12] Daneben können unabhängig von Erreger-basierten Signalen auch Schaden-assoziierte Signale (DAMP, englisch damage-associated molecular patterns ‚Schaden-assoziierte molekulare Muster‘) eine angeborene Immunantwort auslösen.
Erworbene Immunantwort

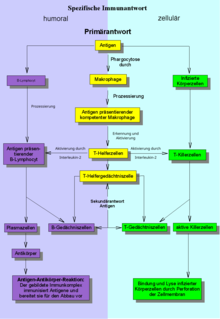
Eine antigenpräsentierende Zelle, zum Beispiel ein Makrophage („Fresszelle“) nimmt Erreger oder Teile davon per Phagozytose auf, zerlegt ihn und präsentiert anschließend Teile von Erregern (Antigene) auf der Zelloberfläche und leitet somit die erworbene Immunantwort ein. Dabei werden in Folge Rezeptoren auf B- und T-Zellen für die Bindung an die Antigene optimiert.[14] Die erworbene Immunantwort wird erst nach einem Erstkontakt ausgebildet, woher die Bezeichnung erworben stammt. Sie wird auch als adaptive Immunantwort bezeichnet, weil die Rezeptoren an das Antigen angepasst werden. Die Vorgänge der Anpassung sind bei B- und T-Zellen die VDJ-Rekombination und bei B-Zellen noch die somatische Hypermutation. Die erworbene Immunantwort unterteilt sich in zwei Bereiche: die humorale und zelluläre Immunantwort.[15] Bei einem Erstkontakt mit einem Erreger dauert dieser Vorgang mehrere Tage,[12] führt aber zu einer flexiblen und passgenauen Erkennung.
Humorale Immunantwort
Abwehrstoffe gegen Krankheitserreger, die in den Körperflüssigkeiten Blut und Lymphe vorkommen und im zellfreien Blutplasma oder Serum nachgewiesen werden können, bezeichnet man als humoral, von lateinisch [h]umor ‚Feuchtigkeit, Saft, Flüssigkeit‘. Antikörper, auch Immunglobuline genannt, sind Proteine und kommen sowohl im Blut, als auch in der Lymphe vor und werden durch Plasmazellen hergestellt und freigesetzt. Im Menschen gibt es verschiedene Typen von Immunglobulinen mit unterschiedlichen Funktionen.[16]
Die Aktivierung einer B-Zelle wird nach Präsentation durch Bindung eines Antigens an einen passenden B-Zell-Rezeptor eingeleitet. Diese sind spezielle Immunglobuline, die in der Zellmembran der B-Zelle verankert sind. Wurde der Antigen-Antikörper-Komplex erst einmal in die Zelle aufgenommen, so wird in deren Lysosomen das Antigen durch proteinabbauende Enzyme auf eine Länge von 12 bis 16 Aminosäuren gekürzt, von MHC2-Proteinen gebunden und auf der Oberfläche der Zelle präsentiert. Diese Proteinfragmente werden von T-Zell-Rezeptoren auf T-Helferzellen vom Typ 2 gebunden. Durch die Erkennung sowie durch Bindung mindestens eines weiteren Signals (Kostimulator) wird die T-Helfer-Zelle aktiviert und gibt daraufhin Zytokine ab, die von den B-Zellen gebunden werden und zur zusätzlichen Aktivierung der B-Zelle und letztlich auch zur Reifung neuer Plasmazellen führen.
Einige dieser B-Zellen differenzieren zu B-Gedächtniszellen und sind in der Lage, bei erneuter Infektion durch denselben Erreger viel schneller Antikörper abzugeben, die dann spezifisch an die jeweiligen Antigene binden und eine erneute Immunreaktion auslösen können.[17] Andere B-Zellen differenzieren zu B-Plasmazellen.
Zelluläre Immunantwort
Die zelluläre Immunantwort wird durch eine Präsentation auf antigenpräsentierenden Zellen gegenüber zytotoxischen T-Zellen ausgelöst und durch T-Helfer-Zellen vom Typ 1 verstärkt.[18] Die cytotoxische T-Zelle muss von einem spezifischen Antigen und durch ein kostimulatorisches Signal aktiviert werden, bevor sie ihre Funktion erfüllt: das Abtöten infizierter oder entarteter Zellen. Bei der Aktivierung wird die cytotoxische T-Zelle zunächst von einer antigenpräsentierenden Zelle aktiviert, häufig von reifen dendritischen Zellen.
Das spezifische Antigen wird in antigenpräsentierenden Zellen durch deren Proteasom in kurze Fragmente von acht bis elf Aminosäuren zerlegt. Diese Fragmente werden von den sogenannten MHC I-Proteinen gebunden und den zytotoxischen T-Zellen an der Zelloberfläche präsentiert. Die zytotoxischen T-Zellen können die Antigenfragmente mit Hilfe ihrer T-Zell-Rezeptoren erkennen und werden dadurch erstmals aktiviert. Erst durch die von den antigenpräsentierenden Zellen gebildeten Kostimulatoren und von T-Helferzellen des Typs 1 abgegebenen Zytokinen, die zu den zytotoxischen T-Zellen diffundieren und dort von Zytokin-Rezeptoren gebunden werden, werden die cytotoxischen T-Zellen dazu veranlasst, sich zu vollständig aktivierten zytotoxischen T-Zellen auszudifferenzieren. Wenn die nun aktivierte zytotoxische T-Zelle spezifisch mit ihrem Rezeptor an eine erkrankte Zelle bindet, leitet die aktivierte T-Killerzelle in dieser die Apoptose ein. Dazu geben sie Perforin ab, das die erkrankte Zelle perforiert. Ist die Zellmembran erst einmal durchlöchert, dringen sogenannte Granzyme ein und aktivieren dort mehrere Enzyme, die die Zelle verdauen. Einige zytotoxische T-Zellen differenzieren sich zudem zu T-Gedächtniszellen und stehen künftig für die erneute Zerstörung von erkrankten Körperzellen mit demselben Antigen zur Verfügung.[17]
Organe und Gewebe der Immunantwort

Die Zellen des Blutes und darunter auch die Immunzellen werden im Zuge der Hämatopoese im roten Knochenmark gebildet.[19] Über das Blutsystem und das Lymphsystem verteilen sie sich im Organismus. B-Zellen reifen im roten Knochenmark, während T-Zellen den Thymus zur Reifung benötigen. Die finale Aktivierung von B- und T-Zellen und die weitere Vermehrung findet in den sekundären lymphatischen Organen wie Lymphknoten, Milz und den Mucosa-assoziierten lymphatischen Geweben (darunter die Mandeln im Hals, der Wurmfortsatz des Blinddarms und die Peyerschen Plaques des Ileums) statt.
Überempfindlichkeiten und Allergien
Auch die Überempfindlichkeiten (antikörpervermittelte und zellvermittelte Allergien) sind erworbene Immunreaktionen mit Erinnerung aufgrund von Gedächtniszellen.[20] Auch gegen Substanzen kann nach einmaligem oder vielfach wiederholten Kontakt eine solche Immunreaktion als eine Kontaktallergie auftreten. Die Abstoßung körperfremder Organtransplantate kann ebenfalls eine zellvermittelte Immunreaktion sein.
Evolution
In Bakterien werden verschiedene Resistenzmechanismen ausgebildet, wie z. B. Restriktionsenzyme, die zellfremde Molekülstrukturen erkennen und zerstören. Darüber hinaus besitzen verschiedene Bakterienarten eine Form adaptiver Immunität durch das CRISPR. Kieferlose besitzen noch keine getrennten B- und T-Zellen und entsprechende B- oder T-Zell-Rezeptoren für eine adaptive Immunantwort, sondern einen Variable lymphocyte receptor. Bei Vögeln reifen antikörperproduzierende B-Zellen in der Bursa Fabricii, und sie besitzen nur einen Typ Antikörper, Immunglobulin Y.
Literatur
- Kenneth Murphy, Casey Weaver: Janeway’s Immunobiology. 9. Auflage. ISBN 978-0-8153-4505-3. Die 5. englische Ausgabe ist auf den Seiten des NCBI-Bookshelf verfügbar: ncbi.nlm.nih.gov.
- Abdul K. Abbas, Andrew Lichtman, Shiv Pillai: Cellular and Molecular Immunology. 9. Auflage. Elsevier, 2018, ISBN 978-0-323-52324-0.
Weblinks
- Lukas Brausch: Artikel zum Thema Immunreaktion. ( vom 15. Juli 2010 im Internet Archive) Science-2Day.
Einzelnachweise
- ↑ Nima Rezaei: Encyclopedia of Infection and Immunity. Elsevier, 2022, ISBN 978-0-12-818731-9, S. 1.
- ↑ Nima Rezaei: Encyclopedia of Infection and Immunity. Elsevier, 2022, ISBN 978-0-12-818731-9, S. 206 ff.
- ↑ a b A. Marson, W. J. Housley, D. A. Hafler: Genetic basis of autoimmunity. In: The Journal of clinical investigation, Band 125, Nummer 6, Juni 2015, S. 2234–2241; doi:10.1172/JCI78086, PMID 26030227, PMC 4497748 (freier Volltext).
- ↑ D. Simon: Recent Advances in Clinical Allergy and Immunology 2019. In: International archives of allergy and immunology. Band 180, Nummer 4, 2019, S. 291–305; doi:10.1159/000504364, PMID 31694018.
- ↑ S. S. Naz, A. Aslam, T. Malik: An Overview of Immune Evasion Strategies of DNA and RNA Viruses. In: Infectious disorders drug targets, Band 21, Nummer 7, 2021, S. e300821192322; doi:10.2174/1871526521666210317161329, PMID 33739247.
- ↑ B. Yang, K. D. Yang: Immunopathogenesis of Different Emerging Viral Infections: Evasion, Fatal Mechanism, and Prevention. In: Frontiers in immunology, Band 12, 2021, S. 690976; doi:10.3389/fimmu.2021.690976, PMID 34335596, PMC 8320726 (freier Volltext).
- ↑ Ruby Pawankar, Stephen T. Holgate, Lanny J. Rosenwasser: Allergy Frontiers:Therapy and Prevention. Springer, 2010. ISBN 978-4-431-99362-9.
- ↑ Diana Boraschi, Giselle Penton-Rol: Immune Rebalancing: The Future of Immunosuppression. Academic Press, 2016, ISBN 978-0-12-803336-4, S. 1.
- ↑ S. Stratman, R. S. Golpanian, R. Fayne, R. S. Kirsner, A. D. Maderal: Malignancy Risk of Non-Biologic Immunosuppressive Therapies: A Review of the Literature with Evidence-Based Treatment Recommendations. In: Experimental Dermatology; doi:10.1111/exd.14647.
- ↑ F. Z. Firdaus, M. Skwarczynski, I. Toth: Developments in Vaccine Adjuvants. In: Methods in molecular biology, Band 2412, 2022, S. 145–178; doi:10.1007/978-1-0716-1892-9_8, PMID 34918245.
- ↑ C. Hennessy, D. P. McKernan: Anti-Viral Pattern Recognition Receptors as Therapeutic Targets. In: Cells, Band 10, Nummer 9, 08 2021; doi:10.3390/cells10092258, PMID 34571909, PMC 8466445 (freier Volltext).
- ↑ a b Kenneth M. Murphy, Casey Weaver: Janeway’s immunobiology. 9. Auflage. Garland Science_Taylor & Francis Group, 2017, ISBN 978-0-8153-4505-3, Kapitel 1.3, Abbildung 1.7, S. 6.
- ↑ Spektrum: Immunantwort
- ↑ Nima Rezaei: Encyclopedia of Infection and Immunity, Elsevier, 2022, ISBN 978-0-12-818731-9, S. 76 ff.
- ↑ Nima Rezaei: Encyclopedia of Infection and Immunity. Elsevier, 2022, ISBN 978-0-12-818731-9, S. 39 ff.
- ↑ Abdul K. Abbas, Andrew Lichtman, Shiv Pillai: Overview of Humoral Immune Responses. In: Cellular and Molecular Immunology. 9. Auflage. Elsevier 2018, ISBN 978-0-323-52324-0.
- ↑ a b Nima Rezaei: Encyclopedia of Infection and Immunity. Elsevier, 2022, ISBN 978-0-12-818731-9, S. 221 ff.
- ↑ Nima Rezaei: Encyclopedia of Infection and Immunity. Elsevier, 2022, ISBN 978-0-12-818731-9, S. 56 ff.
- ↑ Nima Rezaei: Encyclopedia of Infection and Immunity. Elsevier, 2022, ISBN 978-0-12-818731-9, S. 14 ff.
- ↑ Abdul K. Abbas, Andrew Lichtman, Shiv Pillai: Hypersensitivity Disorders. In: Cellular and Molecular Immunology. 9. Auflage. Elsevier, 2018, ISBN 978-0-323-52324-0.
