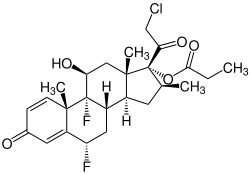
Halobetasolpropionat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Ulobetasolpropionat (INNm)[1] | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C25H31ClF2O5 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 484,96 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Halobetasolpropionat ist eine chemische Verbindung aus der Gruppe der Corticosteroide.[3] Die Verbindung ist ein Carbonsäureester der Propionsäure mit Halobetasol[S 1] und unterscheidet sich von Clobetasolpropionat durch ein zusätzliches einzelnes Fluoratom an der sechsten Position.[4]
Eigenschaften
Halobetasolpropionat ist ein weißer kristaller Feststoff.[2] Es ist in organischen Lösungsmitteln löslich, aber praktisch unlöslich in Wasser.[5]
Verwendung
Halobetasolpropionat wird zur Behandlung von Psoriasis verwendet. Halobetasolpropionat ist die in den Vereinigten Staaten gebräuchliche Bezeichnung (USAN) für das Propionat des Cortikosteroids Halobetasol, das 1976 von Ciba-Geigy synthetisiert wurde. Die Markennamen lauten Ultravate in den Vereinigten Staaten und Miracorten in anderen Teilen der Welt.[4][6]
Regulierung
Über den Safe Drinking Water and Toxic Enforcement Act of 1986 besteht in Kalifornien seit 20. August 1999 eine Kennzeichnungspflicht für Produkte, die Halobetasolpropionat enthalten.[7]
Einzelnachweise
- ↑ INN Recommended List 26. In: who.int. 9. Juni 1986, abgerufen am 13. März 2024 (englisch).
- ↑ a b c d e f g Eintrag zu Halobetasol Propionate, >98,0% bei TCI Europe, abgerufen am 12. März 2024.
- ↑ C. Robin Ganellin: Analogue-based Drug Discovery. Wiley, ISBN 978-3-527-60749-5, S. 432 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b John S. Loder, John R. Gibson, Shantaram J. Yawalkar, Richard J. White: Halobetasol Propionate. 1991, doi:10.1159/000419883 (karger.com).
- ↑ Patent US8361997B2: Process for preparing a crystalline form of halobetasol propionate. Angemeldet am 7. Dezember 2009, veröffentlicht am 29. Januar 2013, Anmelder: Taro Phamaceutical North America Inc, Erfinder: Daniella Gutman, Shimon Chernyak.
- ↑ Allison M. Rivera, Sylvia Hsu: Topical Halobetasol Propionate in the Treatment of Plaque Psoriasis. In: American Journal of Clinical Dermatology. Band 6, Nr. 5, 2005, S. 311–316, doi:10.2165/00128071-200506050-00004.
- ↑ Halobetasol Propionate. OEHHA, 20. August 1999, abgerufen am 16. März 2024 (englisch).
