Guajacol
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Guajacol | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C7H8O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche ölige Flüssigkeit bzw. Feststoff mit charakteristischem Geruch[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 124,13 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,12 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Dampfdruck |
30 Pa (30 °C)[2]; 13.73 Pa (20 °C) | |||||||||||||||||||||
| pKS-Wert |
9,98[4] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,5429 (20 °C)[6] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Guajacol ist ein in Guajak-Bäumen vorkommender sekundärer Pflanzenstoff, der sich strukturell vom Anisol und vom Phenol ableitet. Es ist eine Untereinheit im Capsaicin-Molekül sowie in den übrigen Capsaicinoiden.
Geschichte
Guajacol wurde 1826 von Otto Unverdorben erstmals durch Destillation von Guajakharz hergestellt.[8][9]
Vorkommen

Guajacol kommt in Gewürzvanille,[10] Gemüsekohl (Brassica oleracea var. capitata l.),[10] Echtem Süßholz,[11] Holzteerkreosot und in Holzteeren vor. Den größten Gehalt besitzt Buchenholz sowie Guajakharz. Guajacol wird neben anderen Phenolen durch thermischen oder mikrobiellen Abbau von Lignin oder phenolischen Säuren (z. B. Ferulasäure) gebildet und kommt daher in vielen Lebensmitteln, vor allem auch in geräucherten Produkten vor.[12][13] Guajacol ist einer der Aromastoffe von Whisky,[14] auch kann es für den Korkton im Wein verantwortlich sein.[15]
Eigenschaften
Guajacol riecht rauchig-medizinisch und schmeckt süß. Die Aromaschwelle in Wasser liegt bei 3 ppb. Mit seiner kräftigen Rauchnote trägt Guajacol wesentlich zum Kaffeearoma und zum Aroma geräucherter Lebensmittel bei.[12] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend ln(P) = A−(B/(T+C)) (P in kPa, T in K) mit A = 13,6745, B = 3378,850 und C = −104,630 im Temperaturbereich von 373 bis 463 K.[16] Die Verdampfungsenthalpie beträgt am Siedepunkt 52,7 kJ·mol−1.[17]
Mit Eisen(III)-ionen (Eisen(III)-chlorid) ist eine Grünfärbung festzustellen.
Die Methoxygruppe hat nur geringen Einfluss auf die Acidität der phenolischen OH-Gruppe, der pKs-Wert weist einen nur sehr geringen Unterschied zum Phenol (9,99[18]) auf.
Darstellung
Guajacol 2 wird durch Methylierung von Brenzcatechin (Catechol) 1, mittels Dimethylsulfat hergestellt.[19] Als Nebenprodukt entsteht auch das dimethylierte Produkt, das Veratrol:

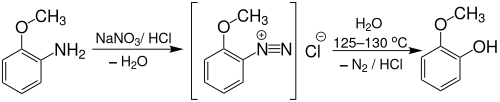
Gujacol kann ebenfalls aus o-Anisidin durch Verkochen (ca. 125 bis 130 °C) seines Diazoniumsalzes hergestellt werden:[19]
Verwendung
Guajacol dient in der Riechstoffindustrie zur Herstellung von Vanillin und Eugenol.[20] In der pharmazeutischen Branche wird es beispielsweise in Arzneimitteln als Expektorans bei Erkrankungen des Bronchialsystems (Guaifenesin) verwendet. In der Beschichtungstechnologie wird es als Antihautmittel für Tinten und Lacke verwendet.[21]
Weblinks
Einzelnachweise
- ↑ Eintrag zu GUAIACOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 30. Juni 2020.
- ↑ a b c d e f g h i Eintrag zu Guajacol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 5. November 2012. (JavaScript erforderlich)
- ↑ Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 340, ISBN 3-342-00280-8.
- ↑ Zvi Rappoport (Hrsg.): CRC Handbook of Tables for Organic Compound Identification. 3. Auflage. CRC Press, Boca Raton (Florida) 1984, ISBN 0-8493-0303-6, Tabelle 28: Acid Dissociation Constants of Phenols in Aqueous Solution (Listed in order of increasing pKa), S. 434.
- ↑ Kazunori Miyamoto: Guaiacol. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 27. Mai 2014, John Wiley & Sons, Ltd. doi:10.1002/047084289X.rn01705
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-332.
- ↑ Eintrag zu Guaiacol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Otto Unverdorben: Ueber das Guajakharz. In: Annalen der Physik und Chemie. Band 92, Nr. 6, 1829, S. 369–376, doi:10.1002/andp.18290920620.
- ↑ Horst Thielemann: Reinheitsprüfung von Guajacol (1-Hydroxy-2-methoxybenzen) an einfachen und silbernitratimprägnierten Sorptionsschichten für die Dünnschicht-Chromatographie. In: Fresenius’ Zeitschrift für Analytische Chemie. Band 330, Nr. 6, 1988, S. 530–530, doi:10.1007/BF00490765.
- ↑ a b 2-METHOXY-PHENOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 4. August 2024.
- ↑ O-METHOXY-PHENOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 24. April 2022.
- ↑ a b Eintrag zu Guajacol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. November 2014.
- ↑ George A. Burdock: Fenaroli's Handbook of Flavor Ingredients. Sixth Edition. CRC Press, Boca Raton 2010, ISBN 978-1-4200-9086-4, S. 774–775.
- ↑ Aromastoffe Whisky auf eyeforspirits.com, abgerufen am 30. Juli 2016.
- ↑ A. Reynolds: Managing Wine Quality: Oenology and Wine Quality. Woodhead Publishing, 2010, ISBN 978-1-84569-998-7, S. 393.
- ↑ Ming-Jer Lee, Chang-Ching Su, Ho-mu Lin: Vapor Pressures of Morpholine, Diethyl Methylmalonate, and Five Glycol Ethers at Temperatures up to 473.15 K. In: Journal of Chemical & Engineering Data. 50, 2005, S. 1535–1538, doi:10.1021/je049627d.
- ↑ R. M. Stephenson, S. Malanowski: Handbook of the Thermodynamics of Organic Compounds. Springer 1987, ISBN 978-94-010-7923-5, doi:10.1007/978-94-009-3173-2.
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b Heinz Georg Osmar Becker, Werner Berger, Günter Domschke u. a.: Organikum. 19. Auflage. Johann Ambrosius Barth Verlag, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 209, 564.
- ↑ C. F. H. Allen and J. W. Gates, Jr.: o-Eugenol In: Organic Syntheses. 25, 1945, S. 49, doi:10.15227/orgsyn.025.0049; Coll. Vol. 3, 1955, S. 418 (PDF).
- ↑ NIIR Board: The Complete Technology Book on Printing Inks. Asia Pacific Business Press Inc., 2003, ISBN 978-81-7833-048-8, S. 490.

