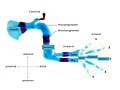
Extremitätenentwicklung

Die Extremitätenentwicklung ist ein Bereich der Embryogenese und bildet eine Grundlage für Erkenntnisse über die molekularen und zellularen Mechanismen zur Formfindung in der Organogenese von Wirbeltieren. Die Extremitätenentwicklung will die progressive Formbildung der skelettären Muster der Gliedmaßen bei den Tetrapoden (Landwirbeltiere mit vier Extremitäten) erklären.
Übersicht über den Gesamtprozess


Die beginnende Ausbildung der Extremität erfolgt im Extremitätenfeld. Das Extremitätenfeld ist eine Region in der rechten und linken Flanke des Embryos. Die Extremitätenentwicklung beginnt dadurch, dass noch nicht differenziertes, uniformes mesenchymes Zellgewebe des lateralen Mesoderm aus den Somiten auswächst und sich das oberhalb liegende Ektoderm zu einer paddelförmigen Extremitätenknospe ausstülpt. Es kommt zur Ausbildung eines Organisators, der apikalen ektodermalen Randleiste (AER), das ist eine lange, wulstartige Struktur an der abgeflachten Spitze der Knospe, die das weitere Wachstum der Knospe in Richtung vom Körper weg steuert (Abb. 4, 8b). Zellen in der Knospe kondensieren zunächst, differenzieren dann in vielen Schritten in Knorpelgewebe, die Chondrogenese und formen in deren frühen Phase genetisch und epigenetisch Muster, die später die Knochen von Oberarm/Oberschenkel (Stylopodium), Unterarm/Unterschenkel (Zeugopodium) und Hand/Fuß (Autopodium) bilden. Die exakte Ortsbestimmung und Formfindung dieser diskreten, skelettären Elemente innerhalb der wachsenden Knospe sind der eigentliche Gegenstand der Forschung zur Extremitätenentwicklung. Bei Towers und Tickle heißt es dazu 2009: „Unser Wissen über diesen Prozess ist noch ziemlich fragmentarisch und viele der vorgeschlagenen Modelle bleiben kontrovers“.[1]
Im Folgenden werden Modelle skizziert, die seit dem Ende der 1960er Jahre entstanden sind und molekulare Einblicke zunächst in die Entwicklung des Hühnchenflügels (Abb. 2) und später auch in die vordere Extremität der Maus (Abb. 1a, 1b, 3) lieferten. Es werden auch Modelle aufgeführt (u. a. das Morphogen-Gradienten-Modell), die als überholt gelten können, jedoch nach wie vor in neueren Lehrbüchern erscheinen.[2] Nach mehr als 50 Jahren der Forschung ist nicht geklärt, in welcher Form Zellen in der Knospe Positionsinformationen erhalten können, die ihnen erlauben, an exakt zu bestimmenden Stellen in Knorpelgewebe zu differenzieren und damit die Musterbildung der Wirbeltierextremität zu ermöglichen. Es ist anzunehmen, dass es solche Positionsinformationen nicht gibt. Neuere Computersimulationsmodelle, die auf Zellebene und nicht auf genetischer Ebene operieren, arbeiten ohne Positionsinformationen und stattdessen auf Turing- bzw. Gierer-Meinhardt-basierten Musterbildungsprozessen. Die Herausforderungen liegen demnach heute in der Integration molekularer Modelle mit epigenetischer (zellularer) Musterbildung mit Hilfe von Computersimulationen.[3]
- Abb. 2 Entwicklungsphasen des Flügels beim Hühnchen. rosa: Mesechymes Gewebe, hellblau: Knorpelgewebe: blau: Knochen: Hamburger Hamilton Stages 23 (4. Tag) bis 30 (7. Tag)
- Abb. 3 Komponenten und Achsen in der Extremität der Maus
- Abb. 4 AER - Apikale ektodermale Randleiste. Organisatorregion (Signalzentrum) für die Steuerung des proximo-distalen und antero-posterioren Auswuches der Knospe
- Abb. 5 ZPA. Zone polarisierender Aktivität. Organisatorregion maßgebend für die Musterbildung der Finger bzw. Zehen
Begriffe (Phänotyp)
Wichtige phänotypische Begriffe zum Verständnis der Extremität und ihrer Entwicklung am Beispiel der vorderen Gliedmaßen des Menschen sind:
- Oberarm (Stylopodium) (Abb. 3)
- Elle (Ulna) und Speiche (Radius) = (Zeugopodium) (Abb. 3)
- Hand (Carpals und Metacarpals) mit Fingern (digits) = (Autopodium) (Abb. 3). Der Autopod ist die eigentliche Wirbeltierinnovation in der Extremität.
- AER Apikale Ektoderm Randleiste (Abb. 4, 8b): Organisatorregion (Signalzentrum) für proximo-distale Ausbildung der Extremitätenknospe
- ZPA Zone polarisierender Aktivität (Abb. 5): Organisatorregion am posterioren Ende der Extremität; verantwortlich für die antero-posteriore Achsenbildung. Beeinflusst maßgeblich Anzahl und Identität von Fingern.
- Morphogen: diffusibles Molekül, das eine Organisatorregion bestimmt. Es bildet einen Konzentrationsgradienten aus und erwirkt direkt oder indirekt eindeutige Zellantworten bei unterschiedlichen Konzentrationen. Beispiele sind Retinsäure (RA) oder Sonic hedgehog (SHH).
Zeitpunkte und Dauer der Extremitäten-Skelettbildung
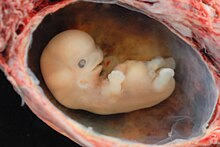
Die Entwicklung der Extremitäten beim Hühnchen, seiner späteren Flügel und Beine, dauert etwa vom dritten bis sechsten Tag, bei einer Gesamtentwicklungszeit von 21 Tagen. Bei der Maus beginnt die Ausstülpung der Extremitätenknospe nach ca. 9,5 Tagen; die Knochenbildung der Extremitäten ist vier Tage später etwa Mitte des 13. Entwicklungstages abgeschlossen (Abb. 1b), bei einer Gesamtentwicklungszeit von ebenfalls ca. 21 Tagen. Beim Menschen (Abb. 6) beginnt die Gliedmaßenentwicklung ab der fünften Schwangerschaftswoche (Embryo: 6–8 mm). Die Handentwicklung geht der Fußentwicklung um etwa zwei Tage voraus. In der achten Woche sind sowohl Arme und Hände wie auch Beine und Füße weitgehend ausgebildet (Embryo: ca. 3 cm); anschließend erfolgt die Apoptose, der Untergang von Zellen, mit dem jeweils die Finger und die Zehen als einzelne voneinander abgesetzt werden.
Axiale Muster und Periodizität
Folgende Hauptachsen werden in der Extremität am Beispiel der menschlichen Hand unterschieden:
- Proximo-distale Achse: von Schulter zur Fingerspitze
- Anterior-posteriore Achse: vom fünften Finger zum Daumen
- Dorso-ventrale Achse: von Handinnen- zur Außenseite
Die Entwicklung der Extremität erfolgt primär entlang der proximo-distalen, der antero-posterioren sowie der dorso-ventralen Achse. Die Prozesse entlang dieser drei Achsen sind teilweise, aber keineswegs unabhängig voneinander. Die Ausbildung der Achsen geschieht durch koordinierte Interaktionen zwischen Signalzentren. Das sind die AER (apical ectodermal ridge), die das proximo-distale Wachstum kontrolliert, die ZPA (Zone polarisierender Aktivität) für die antero-posteriore Achse sowie das Ektoderm der Knospe, das die dorso-ventrale Achse steuert.[4] Das Wachstum der Knospe in proximo-distaler Richtung ist deutlich stärker ausgeprägt als in anterio-posteriorer Richtung. Modelle behandeln entweder primär den proximo-distalen Entwicklungsprozess, etwa das Progressionszonen-Modell oder den antero-posterioren Prozess wie das Morphogen-Gradienten-Modell. Die Integration beider Achsen in Modellen ist noch nicht weit fortgeschritten.
Die Extremität wird proximal nach distal in drei Regionen gegliedert: Oberarm (engl. Stylopod, lat. humerus), Unterarm (engl. Zeugopod, lat. antebrachium) sowie Hand/Fuß, Autopod (lat. autopodium). In distaler Richtung erfolgt eine Verdoppelung und anschließend eine Vervielfachung der Knochen. Der Stylopod besteht aus einem, der Zeugopod aus zwei Knochen (Ulna und Radius). Der Autopod hat drei (Hühnchen-Flügel) bis fünf Elemente (Maus) entlang der antero-posterioren Achse. Finger und Zehen zeigen ebenfalls quasi-periodische Muster in Form der tandemartig angelegten Glieder entlang der proximo-distalen Achse. Die Elemente auf gleicher Höhe der proximo-distalen Achse haben unterschiedliche Identitäten, so Ulna und Radius, aber auch die einzelnen Finger bzw. Zehen.
Die Rolle der Hox-Gene
1989 und 1991 wurde von Denis Duboule u. a. erstmals berichtet, dass dasselbe homeotische System, dessen Relevanz für die Wirbeltiere erst kurz zuvor herausgearbeitet wurde, bei der Organisation von Strukturen entlang verschiedener Achsen mehrfach verwendet wird, speziell bei der Wirbeltierextremität[5] und im Urogenitalsystem.[6] Die Erweiterung dieser Arbeit auf Vögel zusammen mit Cheryll Tickle und Lewis Wolpert belegte sowohl das hohe Ausmaß an zwischenartlicher Konservierung als auch die wesentlich Funktion der Hox-Gene bei der Extremitätenentwicklung.[7] 1991 veröffentlichte Duboule sein „Konzept der posterioren Prävalenz“. Es steht für die funktionale Organisation der Hox-Gene.[8][9] 1993 konnte belegt werden, dass Hox-Gene in multiple axiale Strukturen involviert sind. Das zu zeigen war möglich über eine Mutation eines einzigen Hox-Gens, die in massiven Veränderungen der Extremitäten, des axialen Skeletts.[10]
Es kam zu Konzepten von „Regulations-Landschaften“[11] oder „Archipelen“.[12] Eine große Allelserie erlaubte es, den Mechanismus aufzudecken, der der Colinearität in der Entwicklung der Wirbeltierextremität zugrunde liegt.[12][13][14] Tatsächlich entspricht die axiale Organisation unsere Beine und Arme der linearen Organisation regulatorischer Chromatin-Domänen. Der Übergang zwischen diesen chromosomalen Domänen entspricht dem Handgelenk, das heißt dem Übergang zwischen dem evolutionär alten (Arme und Beine) und dem im Vergleich zur Fischflosse neuen Teil (Hände und Füße) unserer Gliedmaßen.[14]
Deterministische Modelle
Die klassischen Modelle der Extremitätenentwicklung und ihre Nachfolgersysteme gehen bei der Lösung des Problems der Musterbildung von Genen und Genregulation und damit von deterministischen Prozessen aus. Die Formbildung soll von der untersten, der molekularen biologischen Organisationsebene als eine hierarchische Prozesskette erklärt werden. Man will heute verstärkt die Interaktionen der verschiedenen Signalwege analysieren sowie deren Downstreameffekte verstehen. Einen Überblick über den aktuellen Forschungsstand zur Integration der Transkriptions-Netzwerke in der Wirbeltierextremität geben Rabinowitz und Vokes (2012).[15] Die wichtigsten genregulatorisch basierten Modelle stellen Towers und Tickle (2009) zusammen.[1]
Die beiden notwendigen Eigenschaften, die die Modelle dieser Gruppe besitzen, sind das Vorhandensein eines Gradienten und Zellinformation. Die Zelle kann die unterschiedlich starken bzw. zeitdauerunterschiedlichen chemischen Signale des Gradienten interpretieren und spezifisch darauf reagieren. Sie erhält eine spezifisch erkennbare Zellinformation durch den Gradienten. Auf der Grundlage dieser Fähigkeit kann sie sich in unterschiedliche Gewebe ausdifferenzieren, wie etwa in Knochen-, Knorpel-, Muskel- oder Bindegewebe.
Morphogen-Gradienten-Modell (French flag model) nach Wolpert 1969

Das Morphogen-Gradienten-Modell wurde von Lewis Wolpert 1969 als Modell für die Extremitätenentwicklung beim Hühnchen vorgeschlagen.[16] Wolpert postuliert, dass die vom ZPA-Ursprungsort segregierte, in fortschreitender Expressionsrichtung entlang der AP-Achse räumlich abnehmende Konzentration eines damals noch nicht bekannten Morphogens für das Schicksal der Zellen in Reichweite dieses Morphogens (cellfate) und damit für die Fingerausbildung verantwortlich ist.
Das Morphogen bildet einen Verlaufsgradienten aus und liefert auf diesem Weg die Koordinaten bzw. Positionsinformationen für die Zellen, damit diese an exakt bestimmten Stellen in Knorpelgewebe differenzieren können und damit die Musterbildung der Finger bzw. Zehen erfolgt. Später wurde das diffusionsfähige Protein Sonic hedgehog (SHH) als das wahrscheinliche Morphogen identifiziert. Wolpert nahm an, dass die abnehmende Morphogen-Konzentration mit Schwellenwerteffekten, also als diskrete Abstufungen, interpretiert wird. Solche Schwellenwertlevels hat er blau-weiß-rot gekennzeichnet, was dem Modell auch den Namen French flag model einbrachte (Abb. 7). Die Erklärung der Wirkungsweise des Morphogens erfolgte durch Wolpert zunächst über die räumliche Konzentration, wurde aber später auch über die zeitliche Konzentration von SHH in Richtung der antero-posterioren Achse erweitert,[17] wodurch allerdings das Ursprungsmodell von Wolpert abgeändert wurde.[18] Der Verlaufsgradient wirkt in einer Weise, die bis heute nicht geklärt ist, auf die Zellen ein. Sie können, so die Theorie, dessen Konzentration und Dauer als Positionswerte interpretieren, molekular enkodieren und schließlich in die erforderliche Finger-Anatomie übersetzen.[19]
Das Grundproblem in Wolperts Modell kann darin gesehen werden, dass ein Problem (Positionsinformation) durch ein anderes Problem (Morphogen) erklärt wird, für das keine Erklärung geliefert wird. Das Modell erklärt zweitens nicht, wie eine lokale, sich selbst verstärkende Quelle für das Morphogen erzeugt werden kann. Diese Erklärung wird erst durch Gierer-Meinhardt 1972 geliefert.[20] Die Finger müssten drittens in diesem Morphogen-Gradientenmodell eigentlich kreisförmig um die ZPA angeordnet sein, die ja selbst ein dreidimensionales, ovales Gebilde ist. Die Finger sind aber in einer Ebene aufgereiht. Das kann das Modell nicht darstellen. Viertens ist die im Morphogen-Gradienten-Modell ursprünglich propagierte direkte Wirkungsweise eines Morphogens zur Erzeugung exakter Positionsinformationen als alleinige Erklärung neuerdings in Frage gestellt worden, und zwar nicht nur von Wolpert selbst: Ein Morphogen kann in dessen neueren Sicht nicht ausreichend zuverlässig die Präzision und Robustheit erzeugen, die beide für die Musterbildung erforderlich sind. Die Abstimmungsprozesse müssen viel feiner sein.[21][22][23] Fünftens sind Signale für Positionsinformationen, wie sie sich Wolpert in seinem Modell vorstellte, bis heute nicht gefunden worden. Dieses Modell kann aus den genannten Gründen aus heutiger Sicht als überholt gelten.
Progressionszonen-Modell nach Summerbell und Wolpert 1976
Das klassische Progressionszonen-Modell, wurde 1976 als Erweiterung zum Morphogen-Gradienten-Modell eingeführt[24] (Abb. 8). Einfach ausgedrückt entstehen nach diesem Model nacheinander die Strukturen des Stylopeds, dann des Zeugopods und zuletzt der Finger bzw. Zehen. Die spezifische Zell- und Gewebebildung soll damit erklärt werden, dass mit fortschreitender Proliferation der Knospe entlang der proximo-distalen Achse durch die AER Zellen in der angrenzenden Wachstumszone zunächst „neutral“ gehalten werden, also nicht oder noch nicht differenzieren. Je nachdem, ob Zellen kürzer oder länger in der Wachstumszone verbleiben, bis sie diese verlassen, wird über ihr Schicksal unterschiedlich entschieden: Je später Zellen die Wachstumsphase verlassen, desto distalere Strukturen entstehen aus ihnen. Den Zellen wird also eine „interne Uhr“ unterstellt, mit der sie ihren Verbleib in der Progressionszone messen können. Das Progressionszonen-Modell ist somit das erste Modell, das den Faktor Zeit in Verbindung mit Morphogensignalen bringt. Bestätigt wird dieses Modell durch Entfernen der AER in einer frühen Phase, was zum Wegbleiben weiter Teile des Stylopods und Zeugopods führt, also nur einen Stumpf des Arms formt, während bei ihrem Entfernen in einer späten Phase der Entwicklung die genannten Teile ausgebildet werden, jedoch nicht der Autopod und damit nicht die Finger. Den Wirkungsmechanismus zur Erzeugung der proximo-distalen Strukturen will das Progessionszonen-Modell mit der Autonomie der noch undifferenzierten Zellen in der Progessionszone erklären.
Das Progressionszonen-Modell ist nicht in der Lage, z. B. die Regeneration eines Salamander-Beines zu erklären. Da müsste nach dem Abschneiden des Beines die Uhr wieder neu gestellt werden. Das Modell wurde ferner jüngst durch zwei Studien in Frage gestellt, die den Zellen besagte Autonomie absprechen, jedenfalls die Autonomie zur Erzeugung der proximo-distalen Struktur anhand der unterstellten „inneren Uhr“.[25][26] Die Autoren, die unabhängig zu vergleichbaren empirischen Ergebnissen kamen, erklären das Fortschreiten der proximo-distalen Struktur nicht mit Zellautonomie, sondern mit gegenläufigen Zellsignalen, der proximalen Retinsäure (RA), die in der Knospe in distaler Richtung sendet, sowie distaler FGF-Aktivität, die ausgehend von der AER in umgekehrter Richtung wirkt. Es entsteht nach den Autoren ein dynamisches Gleichgewicht zwischen diesen Signalen. Dieses steuert unter Mitwirkung entsprechender Hoxgene die proximo-distale Ausbildung des Zeugopods und des Stylopods. Dabei gelang es den Forschern z. B., angestrebte distale Strukturen in vivo zu erzeugen, indem sie proximales Gewebe an Orte rekombinant transplantierten, die keiner RA-Expression ausgesetzt waren. Umgekehrt konnte eine vollständige proximo-distale Achse mit distalem Gewebe in vitro erzeugt werden, indem die kultivierten Zellen exogenem RA-Einfluss ausgesetzt wurden, der die distalen Signale übersteuerte.
Mehrstufige Genaktivierung nach Meinhardt 1983/2009 und proximo-distales Differentiation front model nach Tabin und Wolpert 2007

Bereits 1982/83 verwies Hans Meinhardt darauf, dass Zellen nicht auf einmal, sondern schrittweise, irreversibel zu mehr proximaler bzw. mehr distaler Spezifikation befördert werden können. Damit bereits wurde Genaktivierung als raumabhängiger Prozess gesehen.[27] Danach gibt es eine Rückkopplung von dem erreichten proximo-distalen Zustand der Mesenchym-Zellen auf die Stärke eines posteriorisierenden Signals, das in der ektodermalen AER gebildet wird. Es wurde angenommen, dass zunächst ein rudimentäres Muster gebildet wird (z. B. 1112, wenn die Sequenz der vollständigen proximo-distalen Strukturen mit 1–6 bezeichnet wird). Wenn durch Proliferation der Typ-2 Zellen genügend Zellen dieses Typs gebildet sind, dann steigt das im AER produzierte Signal soweit an, dass Zellen vom Typ 3 gebildet werden. Erst wenn dann auch genügend Typ-3 Zellen gebildet sind, werden Typ-4 Zellen gebildet (Abb. 10).
Dieses Modell ist mit dem Progressionszonen-Modell verträglich. Es ist eine Eigenschaft des Modells dass nach einer Amputation an einer beliebigen Stelle die fehlenden Strukturen wieder gebildet werden können, daher der Name Bootstrap Modell. Ferner lässt das Modell zu, dass distale Strukturen zu früh gebildet werden können, z. B., wenn die Ausbreitung der Moleküle durch abgestorbene Zellen gestört wird. Ein solches Muster entspricht der Contergan-Missbildung. Meinhardt hat seine Theorie 2009 verfeinert: „Ein höherer Organismus ist viel zu komplex, als dass er durch einen einzelnen Morphogen-Gradienten generiert werden könnte. Erst Genaktivierungen, die nacheinander switchartig verlaufen, bilden unter der Mitwirkung eines Gradienten schrittweise immer schärfere Grenzen und Positionen für die skelettäre Form: Die Konsequenz der zeitlich abgestuften Genexpressionssätze sind immer feinere Pattern- und Positionsgrenzen. Die Grenzen zwischen Regionen, in denen unterschiedliche Gene aktiv sind, können zu neuen Organisatorregionen werden, um die Muster von Extremitätenabschnitten zu bilden“,[28] im Fall hier hieße das: um Regionen von Extremitätenabschnitten wie Oberarm, Unterarm oder Finger bzw. Zehen festzulegen.
Solche Grenzen könnten z. B. die unterschiedlichen Reaktionsweisen auf SHH sein (Konzentration, Dauer oder beide zusammen), die sich zwischen den Zehen der Maus herausbilden, so wie sie Harfe u. a. 2004 beschrieben haben.[29] Positionsinformationen, die im klassischen Sinne Wolperts durch die Konzentration und/oder zeitliche Wirkung eines einzigen Morphogens als eindeutige Koordinaten an die Zellen übermittelt werden, gibt es hier nicht mehr. Vielmehr aktiviert das Morphogen nacheinander mehrere gestufte Expressionsprozesse, im Verlauf derer es erst zu klaren Positionen und phänotypischen Verläufen kommt.
Für Tabin und Wolpert wird das Progressionszonen-Modell nicht dem hohen Umfang molekularer Genexpressionsdaten gerecht, die in den zurückliegenden Jahren generiert wurden. Ein Beispiel dafür ist der Einfluss von Hoxgenen, der in den bisherigen Modellen keinen Zugang findet. Die Autoren stellten daher unter Berücksichtigung der vorhandenen Daten einen alternativen Rahmen für das proximo-distale Patterning vor.[30] Danach existieren mehrere unterschiedliche Genexpressionsdomänen mit jeweils spezifischen Gruppen von interagierenden Genen in aufeinanderfolgenden Phasen des Knospenwachstums. An der proximalen Grenze, ab der AER-FGF-Signale nicht mehr empfangen werden können, wird eine Differentiationsfront gebildet. Diese Grenze präfiguriert die proximo-distale Sequenz, durch die die einzelnen Elemente bei der Chondrogenese nach und nach erscheinen. Das Ergebnis ist also eine Ausbildung mehrerer Progenitor-Pools für jedes Segment (Zeugopod, Stylopod und Autopod). Das Differenziationsfront-Modell beschreibt somit sehr ähnlich, was Meinhardt früher schon darstellte.
Selbstregulierendes System interdependenter Zellsignal-Feedback-Loops nach Bénazet, Zeller u. a. 2009
Bénazet, Zeller et al.[31][32] Universität Basel, beanspruchen, das erste integrierte Modell vorzulegen, das bekannte und neue Signalwege in positiven und negativen Epithel-Mesenchym-Feedback-Loops verlinkt und damit eine Integration bestehender Modelle aufweist. Dies gilt jedoch für frühere Modelle, z. B. das von Tabin und Wolpert 2007, auch schon.[30] Das Team um Zeller zeigt ein dreifaches System, bestehend aus einer Initiationsphase, einer Ausbreitungsphase und einer Terminationsphase. Gremlin1, dessen Antagonist BMP, FGF und SHH sind die Säulen der drei Subsysteme. Das Modell setzt in der Initiationsphase vor den früheren Modellen auf und erklärt zunächst die Voraussetzungen dafür, dass AER und ZPA ihre Funktion aufnehmen und aufrechterhalten können. Die Autoren sprechen von einem Prepatterning in dieser Phase, wobei zu dem frühen Zeitpunkt Positionsinformationen „gecheckt“ und im Wachstumsverlauf kontinuierlich upgedatet werden. Ihre genaue Fixierung erfolgt erst in späteren Entwicklungsphasen, jedoch vor der Differenzierung der Zellen. Schwellenwerte wie im Morphogen-Gradienten-Modell sind hierfür nicht erforderlich.
Das Modell wird als ein systemischer Ansatz verstanden. Der räumliche Aspekt wird aber wenig adressiert. Ein generelles Problem für das Verständnis, wie Beinstrukturen gebildet werden, ist, dass es nur wenig ortsspezifisch aktivierte Gene gibt. Aus dem Modell geht aus diesem Grund überhaupt nicht hervor, wie etwa die Finger raumzeitlich gebildet werden. Eine Simulation ist bislang nicht erfolgt und auch nicht möglich. Hier geht das 2012 an der ETH Zürich entstandene BMP-Rezeptor-Modell[33] deutlich weiter. Bemerkenswert ist aber, dass beide Modelle, die sogar in Kooperation der beiden Teams entstanden sind, und die beide die Frühphase der Strukturbildung der Extremität erklären wollen, für denselben Sachverhalt unterschiedliche Regelkreise anführen. Der Shh-Signalweg etwa, der im Team Zeller einen hohen Stellenwert in mehr als einer Phase hat, wird vom anderen Team mit Bezug auf Litingtung u. a. 2002[34] als entbehrlich gesehen.
Autoregulatorische Modelle
Die evolutionäre Entwicklungsbiologie sieht Musterbildungsprozesse nicht primär auf der genetischen bzw. Genregulationsebene, sondern im interaktiven Zusammenspiel der genetischen mit höheren Organisationseben (Zellen, Gewebe).[35] Grundlegend für alle im Folgenden aufgeführten Modelle sind die Arbeiten von Alan Turing (1952).[36] sowie von Gierer und Meinhardt (1972).[20] Turing-Mechanismen können unregelmäßige Muster erzeugen; aber erst die von Gierer und Meinhardt beschriebenen dynamischen Prozesse mit Selbstorganisation und Skalierung sind der epigenetische Mechanismus für die regelhafte morphologische Formfindung, unter anderem auch der Extremität. Schon früh wurde parallel zu den genzentrierten Ansätzen auf epigenetische Möglichkeiten der Extremitätenentwicklung hingewiesen.[37][38] Jüngere Modelle gehen dabei nicht mehr von chemischen Diffusionsprozessen, sondern von Zell-Zell-Reaktionen aus und können auf dieser Basis biologische Aktivator-Inhibitor-Prozesse realistischer abbilden.[39] Ungeachtet dessen bestehen heute noch erhebliche Schwierigkeiten, die Aktivator-Inhibitor-Prozesse molekular-empirisch adäquat wiederzugeben. Im Folgenden wird eine Reihe solcher Modelle vorgestellt. Die ersten drei sind Weiterentwicklungen des mathematisch umfassenden LALI-Modells von Hentschel u. a. 2005.[40] LALI steht hierbei für den erweiterten Turing-Modelltyp Local auto-activation, lateral inhibition. im Sinne von Gierer Meinhardt.
Selbstorganisierende Eigenschaften des mesenchymen Präknorpelgewebes - Modell von Newman und Müller 2005
Newman und Müller[41] haben den klassischen Modellen eine neue Sichtweise des Entstehens der Hand (Origination und Innovation) gegenübergestellt, die neben den genetischen epigenetische Prozesse sowie die Interaktion beider ins Blickfeld rückt (Abb. 11). Eine Handvoll zellularer und molekularer Kernprozesse des mesenchymen Gewebes bildet die Basis für die Vorgänge. Existenz und Übertragung von Positionsinformationen in einzelnen Zellen werden nicht benötigt. Damit liefert dieser Denkansatz erstmals eine systematische Herangehensweise, indem das interdependente Zusammenspiel der Systemkomponenten Gene, Genprodukte, Zellen und Gewebe behandelt wird. Epigenetische Prozesse sind nach dieser Anschauung nicht nur für die Erklärung des evolutionären Entstehens der Hand (Origination.), sondern auch für die Erklärung ihrer Entwicklung bei rezenten Lebewesen grundlegend und unverzichtbar.[41]

Drei zentrale Eigenschaften der Epigenese des Systems Entwicklung werden formuliert:[42]
- die Autonomie-Eigenschaften ihrer Komponenten (Zellverhalten, Gewebegeometrie etc.),
- die Fähigkeit des mesenchymen Gewebes bei der Kondensation zu Selbstorganisation und der Ausbildung raum-zeitlicher Muster,
- die nicht-lineare Reaktionsfähigkeit von Zellen und Gewebe auf geringfügige Veränderungen wie genetische Mutation, Veränderung epigetischer Parameter oder Umwelteinflüsse. Das Überschreiten von Schwellenwerten kann verantwortlich für diskrete phänotypische Variation oder Innovation sein.
Das Modell von Chaturvedi, Hentschel, Alber, Newman 2005
Dieses Modell[43] verwendet Computersimulationen, die die Organogenese der Hand ausgehend von Zell- und Zellkommunikationsprozessen mit Reaktions-Diffusionsgleichungen abbilden können und erstmals auch dreidimensional das Entstehen von Fingern erfassen (Abb. 12). Das Modell basiert auf dem ursprünglichen, jedoch modifizierten Reaktions-Diffusionsgleichungssatz von Hentschel et al.[40]

Folgende Modellgrößen und -methoden werden für die raumzeitlich regulierte Kondensation im Modell von Hentschel u. a. verwendet:[41]
- 1. 3D-Zellenanordnung
- 2. Cellular Potts Model (CPM), der eigentliche Kern des Modells; ein Simulationsprotokoll, das die raumzeitliche Ordnung beschreibt, in der die Komponenten (Zellen etc.) interagieren bzw. adhäsieren. Das CPM simuliert das kollektive Verhalten von Zellstrukturen. Im Fall hier lässt es Verhaltensweisen von Zellen zu. Das CPM ist ein generalisiertes Ising-Modell. Das Ising-Modell entstammt der theoretischen Physik und erklärt den spontanen Phasenübergang von nichtmagnetischen in magnetischen Zustand von Festkörpern. Es ist in viele andere Wissenschaftsbereiche übernommen worden. Im Fall hier stellt es den physikalischen Formalismus zur Untersuchung der Implikationen dar, dass Zellen je nach Zelltyp untereinander unterschiedlich starke Adhäsion eingehen. Es beschreibt die Modellierung der Zelldynamik unter Berücksichtigung von minimaler, fluktuierender Energiezufuhr. (Das CPM findet hier Anwendung in dem Open Source Computerprogramm CompuCell3D, einem Simulationsprogramm für komplexe biologische Probleme.)
- 3. Musterinitiierende Turing-Instabilitäten erregbarer Media auf den Ebenen Gewebe, Organe, Organismus.
- 4. Morphogene Felder als nichtmolekulare Kontinua.
- 5. Interaktion verschiedener biologischer Organisationsebenen (Skalen) durch weitere modulare Standard-Computerprogramme mit definierten Schnittstellen; Informationsfluss von feineren zu gröberen Strukturen bzw. innerhalb jeweils Paaren von Modulen. Die expliziten Ebenen sind:
- Molekularebene (Zellkern),
- Subzellularebene (Mitochondrien),
- Zellebene,
- Zell- und Gewebeebene,
- Gewebeebene,
- Organebene
- 6. Die entsprechenden mathematisch formulierten Mechanismen, die das Modell auf diesen Ebenen verwendet, sind (beginnend wieder von der molekularen Ebene):
- Produktion von Morphogenen TGF-ß, FGF-2 und FGF-8; TGF-ß erzeugt Schwellenwerteffekte;
- Erzeugung eines Fibronektinfelds,
- Diffusion extra- und intrazellularer chemischer Stoffe durch Reaktions-Diffusionsgleichungen,
- Genregulation,
- Regulation der Zelladhäsion,
- Zelldynamik und Antwort auf morphogene Felder,
- Zellmembranfluktuation,
- Zellwachstum,
- Mitose (Zellkernteilung),
- Apoptose (programmierter Zelltod),
- Zelldifferenzierung,
- zellspezifische Beweglichkeit zwischen Zellen sowie zwischen Zellen und der extrazellulären Matrix,
- Haptotaxis (keine Chemotaxis),
- extrazelluläre Matrix, durch die Morphogene diffundieren (Zellflüssigkeit),
- sowie auf der obersten Ebene: Thermodynamik und Mechanik von kondensiertem Gewebe.
Das Chaturvedi-Modell beruht auf relativ wenigen molekularen Prozessen, verwendet aber eine Vielzahl zellularer und supra-zellularer Mechanismen. Es kann mit diesem Vorgehen grobe skelettäre, räumliche Strukturen darstellen. An der Einbindung der Wirkungsweise von Gli3, Wnt-7 und Shh, die die Extremitätengeometrie und Zonen kontrollieren, wird gearbeitet,[43] was zu weiterer Realitätsnähe der Modelle führen wird. Organisatorregionen in der Knospe, wie AER und ZPA, aber auch die Wachstumszone sind apriorisch unterlegt. Ihr Entstehen wird also nicht wiedergegeben. Ihre spezifische Lokation in der Knospe spielt keine Rolle im Modell. Dieses Modell setzt aus Rechenkapazitätsgründen nicht primär auf molekularen Prozessen auf.[43] Sein innerer Kern ist mit der CPM-Software-Anwendung die Zelle.
Das Modell von Zhu, Zhang, Alber, Newman 2010
2010 wurde ein Simulationsmodell publiziert, das erweiterte Erkenntnisse zur Extremitätenentwicklung liefert und auch evolutionäre Unterschiede aufzeigen kann.[39]
Das Modell setzt wie das vorige auf dem Modell von Hentschel u. a. (2005)[40] auf, basiert damit ebenfalls auf Aktivator-Inhibitorgleichungen und somit auf Selbstorganisationsfähigkeit, die sich außerhalb genetischer Informationen im Mesenchym einstellt. Es erfordert keine Positionsinformationen a priori. Aktivatoren und Inhibitoren sind vergleichbar zu dem Modell von Newman und Müller(2005).[41] Auf die Problematik, dass bis heute kein einzelnes Morphogen empirisch als Inhibitor ausgemacht werden kann und dass noch wenig zuvor die molekulare Identität eines lang-weitreichenden Inhibitors als schwer fassbar bezeichnet wird, gehen Zhu u. a. nicht näher ein. Ein Inhibitor muss vorausgesetzt werden, anders ist das Modell nicht darstellbar. Im Mittelpunkt dieses Modells steht ein Fibroblast Growth Factor (FGF), ein Gradient als wichtiger proximo-distaler Player ausgehend von der AER. Ferner wird BMP-Aktivität von unterliegenden molekularen „Prepattern“ diktiert, durch die erst das zellulare Pattern konfiguriert wird. Erst durch einen solchen mehrstufigen, auf der molekularen Ebene heute noch nicht transparenten Prozess wird der grundlegende Diffusionsverlauf für das Patterning bestimmt.
Im Simulationsmodell (s. Video Abb. 13) folgen Wachstum und Kondensation dem Progressionzonenmodell. Deutlich sind die AER (rechts außen), eine schmale Progressionszone (Mitte) und die Wachstumszone auszumachen.
Das Modell erzeugt zweidimensionale Muster und ist im Vergleich zu den Modellen von Hentschel, Newman-Müller und Chaturvedi von der Zahl der Gleichungen weiter vereinfacht und auf zwei Reaktions-Diffusionsgleichungen reduziert. Fortschritte werden in der Hinsicht erreicht, dass die unterschiedlichen Zonen der Knospe wie AER, Frozen Zone, Wachstumszone unterschieden werden. Unterschiedliche Zellprozesse, die empirisch ablaufen, sind eingearbeitet bzw. werden im Modell konstant gehalten. Eine Ausweitung der AER im Verlauf des Wachstums der Knospe ist enthalten. Man geht von einer gekrümmten apikalen Kontur aus. Allgemein ausgedrückt berücksichtigt das Modell die Formveränderung (reshaping) des Knospengewebes.
Im Vergleich zu den Vorgängermodellen können Asymmetrien im Autopod dargestellt werden, d. h. Unterschiede in den skelettären Elementen hinsichtlich der Anzahl der Zehen oder deren Länge, wie sie empirisch bei unterschiedlichen Spezies tatsächlich vorkommen. Shh und Hoxaktivitäten sind berücksichtigt. Evolutionäre Übergänge können erzeugt werden. Die Musterergebnisse dieses Modells entstehen nicht auf der unteren, genetischen Organisationsebene. Vielmehr spiegeln die Turinggleichungen die Selbstorganisation des Zellgewebes der Knospe wider, also autonome Eigenschaften, die erst auf dieser Ebene zustande kommen. Hoxgene, Genregulierungen, vor allem Transkriptionsfaktoren sind mitbestimmend für die Parameter der Gleichungen. Sie lenken und verfeinern so die räumliche Ausrichtung der Knochen, sind aber nicht die eigentlich formgebenden Faktoren. Diese sind epigenetisch. Die evolutionär oder artenspezifisch unterschiedliche Länge, Dicke und Ausrichtung der Knochen wird mittels Änderungen sogenannter kinetischer Reaktionsparameter erzielt, die die Produktionsraten des Aktivator-Morphogens darstellen bzw. die für die Assoziationsgeschwindigkeits-Konstante von Aktivator und Inhibitor stehen.
Zhu u. a. simulieren sowohl den proximo-distalen Auswuchs der Knospe als auch die antero-posteriore Musterbildung des Autopods, d. h. die Anzahl der Zehen. Diese korrelieren positiv mit zunehmender Breite des Autopods. Für die Verbreiterung des Autopods wird ein Parameter verwendet, der als Simulation der Shh-Expression der ZPA verstanden werden kann. Die Simulation, basierend auf kontinuierlichen Änderungen auf Gen- und Zellebene, bildet also diskrete Elemente aus.
Kritisch kann man an dem Modell die Schärfe der Knochenausbildung bewerten, die in der Simulation (Abb. 13) unmittelbar aus der Progressionszone hervorgeht, nicht sehr realistisch ist im Vergleich zu der älteren Abb. 2, die ebenfalls von Newman stammt. Der Spezifikationsprozess der Knochen (Knorpelbildung) verläuft also eher graduell.[44] Die Zehen werden nicht gleichzeitig ausgebildet (Abb. 2). Positiv hervorzuheben ist, dass das Zhu-Modell sowohl ein proximo-distales als auch ein antero-posteriores Wachstum enthält und letzteres im Rahmen der Verbreiterung der Knospe auch Polydaktylieformen zulässt.
BMP-Rezeptor-Interaktion–Modell von Badugu, Iber u. a. 2012
Ein neues Modell stammt vom Department of Biosystems Science and Engineering der ETH Zürich.[33] Erstmals werden hier folgende Ansätze integriert: (A) Ein Turing-Modell (eher LALI-Modell) mit molekularen, BMP-Rezeptor-basierten Interaktionen sowie FGFs, (B) eine wachsende Domäne, (C) eine realistische 2D-Knospen-Geometrie der Maus. Das Modell setzt mit dem BMP-Signalweg an der frühest erkennbaren Schnittstelle für die beginnende Kondensation an. Shh, Gli und Gremlin werden im Modell überhaupt nicht benötigt. Die Simulation ist verträglich mit einer Vielzahl empirischer Experimente an der Knospe sowie mit mehreren prä- und postaxialen Polydaktyliemutanten. Bemerkenswert ist, dass die Aussagen in diesem Modell nicht erkennbar vergleichbar sind mit dem Modell von Bénazet, Zeller u. a., das 2009 an der Universität Basel entstand. Ferner gleicht das im Modell erzeugte Musterbild nicht dem empirischen Bild der Prächondrogeniesierung der Wirbeltierhand wie in Abb. 2.
Hox-Gene regulieren Fingerabstände und -anzahl in einem Turing-Modell 2012
Ein weiteres neues Modell stellt Turing-Prozesse auf die bisher nicht verwendete Grundlage der Hox-Gene.[45] Bisher sind in Turing-Modellen ausschließlich Gradienten gesehen worden, also diffundierende Stoffe, die als Aktivator oder Inhibitor wirken. Es ist daher eine neue Sicht, dass nicht diffundierende Transkriptionsfaktoren wie die Hoxa- und Hoxd-Gruppe eine maßgebliche Rolle bei der Musterbildung einnehmen. Genau dies haben Sheth u. a. 2012 empirisch nachgewiesen. Danach verhält sich die Expression dieser in der Entwicklung der Hand spät distal exprimierten Gene umgekehrt proportional zur Anzahl der Finger: Ihre Reduktion vergrößert die Anzahl der Finger. Geschieht die Reduktion parallel mit der Reduktion von Gli3R, ist Polydaktylie noch stärker ausgeprägt. Die genannten Hox-Gene werden verantwortlich gesehen für die Wellenlänge der Fingerabstände. Unter den genannten Bedingungen können bei der Maus empirisch und im Modell bis zu 14 Finger an einer Hand generiert werden.
Das BSW-Turing-Modell von Raspopovic, Marcon, Russo, Sharpe 2014
Das jüngste Turing-Modell für die Wirbeltier-Handentwicklung stammt von einem Team der Universität Barcelona (Lehrstuhl Multicellular Systems Biology: James Sharpe). Es wurde im August 2014 im Science Magazin veröffentlicht.[46] Das Modell propagiert die Interaktion von Bmp, Sox9 und Wnt (BSW-Modell). Es handelt sich dabei um einen Ansatz, der hinsichtlich der genannten genetischen Akteure in großem Umfang empirisch überprüft wurde. Jeder einzelne Faktor wurde durch Knock-out-Verfahren einzeln auf seine Wirkweise im Modell überprüft. Die Turing-Modelltauglichkeit der Einflussgrößen wurde zudem umfassend mathematisch ermittelt und die Robustheit des Modells daraufhin abgesichert, dass stets die gewünschte Zahl von fünf Streifen (stellvertretend für Zehen) entsteht. Das Modell ist zweidimensional. Es beschränkt sich auf die Musterbildung im Autopod (Finger und Zehen), da hier wegen der Wiederholungen der Zehen im Gegensatz zum Zeugopod (Bsp. Oberarm) und Stylopod (Bsp. Unterarm) die bessere Plausibilität für einen Turingmechanismus gesehen wird.

Das BSW-Modell verwendet drei Hauptakteure im Gegensatz zu jeweils zwei Faktoren in früheren Turing- oder LALI-Modellen (Aktivator/Inhibitor): Bmp, Wnt und Sox9 (Abb. 14A). Hierbei sind Bmp und Wnt Morphogene, Sox9 ein Transkriptionsfaktor. Die Wirkung dieser Gene in der Extremitätenentwicklung ist schon zuvor beschrieben worden. Erstmals wird jedoch ein Gesamtzusammenhang hergestellt, dass Bmp selbstverstärkend (auokatalytisch) wirkt, Bmp die Expression von Sox9 aktiviert, Sox9 Bmp inhibitiert und ebenso Wnt und Sox9 sich gegenseitig inhibitieren (Abb. 14A). Sox9 wird während des gesamten Kondensationsprozesses in den Zehen exprimiert. Es wird daher schon länger als idealer Genmarker verwendet, um empirisch die schrittweise Chondrogenese der Extremität verfolgen zu können. Die Expression dieses Gen wird im Modell in regelmäßigen Wellen dargestellt (Abb. 14C). Diese Wellen stellen im zweidimensionalen Turing-Modell Streifen dar; diese repräsentieren die Zehen (Abb. 14B, d2-d4). Die Wellenbewegung von Streifen und deren Zwischenräumen begründet sich aber erst damit, dass immer wenn Sox9 aktiv ist, Bmp und Wnt unterdrückt sind (Fingerzwischenräume) und umgekehrt, sich also zum Sox9-Expressionsmuster gegenläufige Wellen aufbauen (Ab. 14C). Diese beiden Wellenmuster im Modell, Sox9 versus Bmp/Wnt repräsentieren empirisch die Abwechslung der Zehen und ihren Zwischenräumen.
Ohne weitere Parameter erzeugt das Modell nur randomisierte Streifen, die zwar grob in proximo-distaler Richtung verlaufen, jedoch keine stabile Zahl und Ausrichtung zeigen. Die Streifen sollten zudem radiär auftreten, wie es bei der Maus empirisch beobachtet werden kann (Abb. 1a, 14B). Hierzu argumentieren Raspopovic u. a. mit Hoxd13 und Fgf's als stabilisierende Parameter. Beide Gene werden distal in der Knospe exprimiert. Da die Knospe eine rundliche, distale Form hat, wirken in der AER exprimierte Fgf's in Wachstumsrichtung der Zehen. Dagegen sorgt die distale Expression von Hoxd13 – zunächst posterior in der Nähe der ZPA und zunehmend auf ganzer antero-posterior Breite exprimiert – im Wachstumsverlauf wie schon früher gezeigt[45] für immer breiter werdende Abstände zwischen den Streifen. Beide Prozesse zusammen, Fgf's und Hoxd13, stabilisieren nach Raspopovic u. a. das Turing-Modell, und die Anordnung der Streifen nimmt so im Modell die gewünschte radiäre Form an. Zusammenfassend erzeugen die genannten Faktoren Bmp, Sox9, Wnt mit den Steuerungsparametern Hoxd13 und Fgf's ein interessantes, empirisch untermauertes Szenario der Wirbeltier-Extremitätenentwicklung.
Kritisch gesehen werden muss, dass zwar empirisch bestätigt ist, dass Hoxgene erst spät in der Knospe exprimiert werden, aber nicht zwingend ein Expressionsmuster aufweisen, mit dem sie die Rolle wahrnehmen können, die ihnen das BSW-Modell zuspricht. Auch kann das Modell, wie auch alle vorigen, keine Zellverdichtung simulieren. Alle Modelle arbeiten, wenn auch mit Wachstum der Knospe, so doch mit einer konstanten Anzahl Zellen je Flächeneinheit. Zellkondensation ist aber ein elementarer, gut beobachtbarer und bestätigter phänotypischer Vorgang in der entstehenden Extremität.
Kritische Würdigung der Modelle aus Gegenwartssicht und zukünftige Forschungsschwerpunkte
Lange Zeit haben mit den beiden klassischen Modellen, dem Morphogen-Gradienten-Modell und dem Progressionszonen-Modell, getrennte Betrachtungen zur Strukturbildung der Hand existiert, einmal die Erklärung durch die Prozesse entlang der proximo-distalen Achse, zum anderen durch die davon zuerst unabhängige Erklärung der ZPA-Prozesse entlang der antero-posterioren Achse. Keines der Modelle kann jedoch für sich allein die räumliche Ausbildung der Identitäten in der Knospe, und vor allem des Autopods, hinreichend erklären. Jedes der Modelle wird zwar durch empirische Cut-and-pace-Versuche bestätigt. Letztlich werden aber – folgt man der Logik der genannten Modelle – die Koordinaten erst dann exakt bestimmbar, wenn den betreffenden Zellen sowohl ihr Ort auf der proximo-distalen Achse als auch der auf der antero-posterioren Achse und genau genommen auch der auf der dorso-ventralen Achse mitgeteilt werden kann. Es muss demnach aus dieser Sicht in der Embryogenese der Hand Prozesse geben, die es möglich machen, dass Zellen Positionspunkte auf allen drei Achsen interpretieren können.
Die anhaltenden Schwierigkeiten, Positionssignale empirisch aufzudecken, führte andere Wissenschaftler zu der mehr holistischen, systemischen Erklärung der Strukturbildung, zumindest in Richtung der beiden Hauptachsen. Die Weiterentwicklungen auf diesem Gebiet sind geprägt durch den Fokus auf disziplinübergreifende, computergestützte (in silico) Forschungsarbeiten.[47] Die Herausforderungen liegen dabei in folgenden Gebieten:
1. Verbesserte Synthese molekularer mit systemischen Modellen.[21][47]
2. Simulation des Verhaltens der Knospe im dynamischen Wachstumsprozess. Sowohl Morphogene als auch Reaktions-Diffusionssysteme verhalten sich in wachsenden Domänen anders als in statischen.[48][49][50][51]
3. Übergang zu stochastischen im Vergleich zu den bisher vielfach deterministischen Modellen bezüglich Genexpression, Zellprozessen etc.[52][53]
4. Nachweis der Robustheit der verwendeten Zellprozesse, also ihrer Unanfälligkeit gegenüber stochastischem Rauschen (noise).[23][48]
5. Analyse des Skalierungsproblems, d. h., dass durch unterschiedliche Knospengrößen (Domänen) unterschiedliche Patterns entstehen. Weder skalieren die Streifen im French flag model gleichmäßig, noch resultiert die gleiche Anzahl von Streifen in Aktivator-Inhibitor-Systemen mit vergrößerter Domäne.[47]
6. Empirische Bestimmung des Aktivators und insbesondere eines langweitreichenden Inhibitors für die skelettäre Formfindung. Beide Größen sind in Aktivator-Inhibitorsystemen unabdingbar.
7. Empirische Bestimmung der molekularen Basis für mögliche Positionsinformationen, falls tatsächlich vorhanden (Rezeptoren).[21]
8. Bestimmung geeigneter Methoden, um die Distribution von SHH und anderer Morphogene in der sich entwickelnden Knospe realtime quantitativ sichtbar zu machen.[21][49]
9. Integration der dorso-ventralen Achse und ihrer molekularen-zellularen Basis als Voraussetzung für empirisch basierte dreidimensionale Modelle, bei denen alle Handglieder in einer Ebene liegen.
10. Wann bilden sich Gelenke (joints) aus, wenn das nicht allein an den Stellen der Fall ist, an denen es zu Periodizität kommt (Ellbogen, Knie, Hand-/Fußgelenk)? Finger- und Zehenphalangen sind ebenfalls durch Gelenke verbunden.
Methoden der empirischen Forschung
Die externe Lokation der Extremitäten erlaubt eine Vielzahl von Manipulationen am Embryo, deren Ergebnisse leicht sichtbar sind. Genetische Veränderungen führen in den meisten Fällen nicht zum Tod des Versuchstieres. Aus diesen Gründen zeichnet sich die Extremität des Wirbeltiers als ein hervorragendes Modellsystem aus.[15] Die ersten Jahrzehnte standen vorrangig in experimentellen Transplantationsversuchen an Embryonen. Zunächst wurden Grafts aus der entstehenden Knospe entfernt und an anderen Stellen wieder eingepflanzt. Als die ZPA und AER und ihre Positionen bekannt waren, hat man diese Organisatorregionen von anderen Tieren entnommen und z. B. die ZPA anterior zusätzlich zu der posterioren wieder eingepflanzt. Ferner wurden diese Komponenten zu früheren/späteren Zeitpunkten oder in größeren/kleineren Dosen entnommen und/oder eingepflanzt. Dadurch erhoffte man sich Erkenntnisse über Veränderungen der Skelettbildung. In jüngerer Zeit wird molekularbiologisch mit In-situ-Hybridisierung und vor allem mit Gen-Knockout operiert. Durch das Abschalten von Genen kann man auf deren Funktion bei der Entwicklung der Extremität schließen. Man spricht auch von gain of function bzw. loss of function Experimenten. So hat das Experiment von Litingtung u. a. 2002[34] zu der überraschenden Erkenntnis geführt, dass ein Doppel-Knock-Out von Sonic hedgehog und Gli3 (Shh-/-, Gli3-/-) eine polydaktyle Hand erzeugt, womit man nicht rechnen konnte. Beide Gene sind demnach für die Fingerbildung entbehrlich, wenn sie gemeinsam ausgeschaltet werden. Die genannten Experimente führen nicht oder nur eingeschränkt zu Informationen darüber, wie wichtige Signalwege interagieren und welche Downstream Effekte sie erzeugen.[15] Es wird kontrovers diskutiert, ob die Faktoren der phänotypischen Musterbildung (z. B. Finger) auf diesem Weg überhaupt erkannt werden kann.
Sonic hedgehog - Schlüsselgen für die Extremitätenentwicklung?

Über kein anderes Gen bzw. Protein wurden mehr wissenschaftliche Arbeiten im Zusammenhang mit der Entwicklung der Wirbeltierextremität verfasst als über Sonic hedgehog. Hedgehog ist ein hoch konservierter Signalweg in der Evolution und spielt eine zentrale Rolle bei einer Reihe von Musterbildungen, sowohl bei Wirbeltieren als auch Insekten.[21] Zahllose Experimente wurden mit der ZPA unternommen, um deren Wirkungsweise zu bestimmen, bevor bekannt war, welches das Morphogen in der ZPA ist. Als Tabin 1993 entdeckte, dass Sonic hedgehog das Morphogen darstellt, das in den Zellen der ZPA exprimiert wird und in die extrazelluläre Matrix des Autopod von posterior nach anterior diffundiert, wurde die Konzentration auf die Erforschung der Wirkungsweise von Sonic hedgehog noch höher. Die Proliferation von Zellen im Zuge der Shh-Expression und damit das anterio-posteriore Wachstum der Knospe als Konsequenz der ZPA wurde deutlich (Abb. 15). Nach Tickle ist SHH heute als wichtiges Morphogen für die Patternbildung im Autopod bestätigt. Seine weitreichende Wirkung ist sowohl abhängig von der Dosis als auch von der Dauer der Diffusion. Die ZPA kontrolliert danach sowohl die Anzahl als auch Identität der Finger.[49] Die meisten daumenseitigen Fehlbildungen der Hand (präaxiale Polydaktylie) hängen mit Expressionsänderungen von Shh zusammen.
Heute geht man nicht mehr davon aus, dass die diffundierende Wirkungsweise von SHH ausreichend exakt sein kann, um die Positionsbestimmung der Zellen (Knorpelbildung und angrenzendes Gewebe bzw. exakte Skelettform) alleine leisten zu können.[22][28] Es ist nicht auszuschließen, dass SHH selbst nicht in abgestufter Wirkung wirkt, sondern dass von ihm die Produktion eines anderen Stoffes induziert wird, der die entsprechende Gradientenwirkung aufweist und weitergibt.[54] Oder es kommt zu mehreren aufeinanderfolgenden Patterningsprozessen, die Strukturen bzw. Positionen verfeinern.[28] Das Modell von Badugu u. a. (2012) zur Erklärung des Digit Patternings arbeitet ohne Shh,[33] ebenso das BSW-Modell von Raspopovic et al.
Sonic hedgehog war auch eines der ersten Gene, für das ein bei Säugern und Fischen gleichermaßen hoch konserviertes, nicht codierendes cis-Regulatorelement (ZRS) gefunden wurde, das die Shh-Expression im Detail steuert. Mutationen in der ZRS führen zu präaxialer Polydaktylie.[55] Schließlich war das Sonic Hedgehog Signalsystem eines der ersten, von denen beschrieben wurde, dass es einen stochastischen, genetischen Switch und damit Schwellenwerteffekte in der Extremitätenentwicklung bei der Regulation von Gli erzeugt.[52]
Neben seiner antero-posterioren Wirkung im Autopod interagiert Shh über die ZPA mit der AER und hält deren Funktion während des Wachstums der Knospe dauerhaft aufrecht. Umgekehrt wird Shh nicht mehr exprimiert, wenn die AER beseitigt wird. FGF4 agiert zur Aufrechterhaltung von Shh und Shh zur Aufrechterhaltung von FGF4. Ohne diese Interaktion werden Finger entweder bis auf den ersten Finger reduziert oder sie fehlen vollständig. Dennoch bedeutet dieser Zusammenhang nicht, dass Shh unmittelbar für Anzahl und Identitäten der distalen Elemente verantwortlich ist, wie das von Tabin und McMahon 2008[56] gesehen wird. Es ist nicht einmal unmissverständlich klar, ob eine Korrelation existiert zwischen der Dauer der SHH-Signalwirkung, die erforderlich ist, um einen Finger zu spezifizieren und der Reihenfolge, in der die Knorpelkondensation erfolgt.[1] SHH hat aus heutiger Sicht primär zwei Hauptfunktionen: Es kontrolliert die antero-posteriore Identität der Finger und die Zellenzahl und damit das Wachstum der Knospe. Erst auf indirektem Weg kommt es über SHH zu Schwellenwerteffekten der Fingerbildung. An der Wirkungsweise und Rolle von SHH für das Digit Patterning wird nach wie vor intensiv geforscht.
Robustheit versus Plastizität der Zehenzahl und -länge
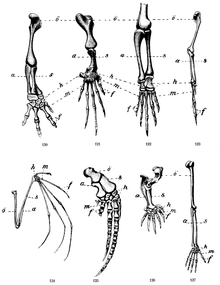

Die Wirbeltierextremität ist eine sehr robuste anatomische Form. So kommt das fünffingrige System etwa bei Mäusen wie Elefanten vor. Da nicht angenommen werden kann, dass die Embryonen solch unterschiedlicher Arten zum Zeitpunkt der Extremitätenentwicklung gleich groß sind, müssen die für die Fortbildung relevanten Entwicklungsmechanismen größenunabhängig sein. Gleichzeitig zeichnet sich die Extremität evolutionär durch eine extreme Anpassungsfähigkeit aus, wie man an ihren unterschiedlichen Formen bei Wirbeltierarten erkennt (Abb. 16 u. 17). Beide Eigenschaften erscheinen intuitiv widersprüchlich. Andreas Wagner konnte jedoch zeigen, dass robuste Formen mit ausgeprägten Gennetzwerken bessere Voraussetzungen für Variation und Innovation besitzen als weniger robuste Formen.[57]
Die pentadaktyle Obergrenze der Hand (fünf Finger) ist dennoch nicht abschließend geklärt. Frühe Saurierarten (z. B. Acanthostega) werden heute wegen der Ähnlichkeit der Zehen eher als polydaktyl, denn als sieben- oder achtzehig interpretiert. Es gibt keine Wirbeltierart, die im Standard mehr als fünf Finger oder Zehen an einer Extremität hat. Pandabär und Maulwurf besitzen verformte Mittelhandknochen mit Fingercharakter. Ausnahmen mit selektiver Einflussnahme des Menschen sind bestimmte Populationen der Katze (Maine-Coon-Katze) und der Norwegische Lundehund (Polydaktylie). Galis führt Entwicklungsconstraints als Grund dafür an, dass eine größere Fingerzahl unterbunden wird.[58]
Neuere Forschungsergebnisse existieren zur extremen Länge der Fledermausflügel. Deren Zehen der Vorderextremität sind in einem frühen embryonalen Entwicklungsstadium (Tag 16 nach Befruchtung) und damit nach der erfolgten Kondensations- und Segmentationsphase in der Extremitätenknospe etwa relativ gleich lang wie die der Maus am Tag 12,5 (vgl. Abb. 1b). Die erst ab dem 20. Tag folgende Verlängerung insbesondere der Zehen 3, 4 und 5 der Fledermaus (Abb. 16) konnte mit erhöhter Expression des Bone morphogenetic protein Bmb2 in Verbindung gebracht werden. Bmp2 stimuliert die Knorpelbildung und -differenzierung und vergrößert die Zehenlänge in der Embryonalentwicklung.[59] Die Evolution der Fledermaus wird somit mit Entwicklungsveränderungen im Längenwachstum und in der Längendifferenzierung von Knorpelgewebe in der vorderen Extremität begründet.
Wichtige Proteine und ihre Funktion in der Extremitätenentwicklung
| Name | Funktion | Beschreibung |
|---|---|---|
| BMP | Morphogen | Familie der Bone Morphogenetic Proteine, gehören zum TGF-ß Signalweg. Der BMP-Signal-Transduktionsweg ist beteiligt an Entwicklung von Fingern und Hand bzw. zahlreichen Fehlbildungen. BMP ist notwendig für die frühe Induzierung von Form und Funktion der AER.[31][60] Bei Zhu u. a. (2010)[39] bestimmt die BMP-Umgebung den lateralen Inhibitor. Bei Badugu u. a. 2012 steht eine BMP-Rezeptor Interaktion für die beginnende Kondensation.[33] Im BSW-Modell spielt BMP die zentrale Aktivatorrolle. Es wird zusammen mit Wnt in den Fingerzwischenräumen exprimiert und aktiviert die Expression von Sox9.[46] |
| β-CAT | Protein | Komponente des WNt3/β-Catenin-Signalwegs. β-CAT Wird durch Wnt3 aktiviert. Fehlen von β-CAT führt zu schweren Defekten in der Entwicklung der Extremität: Dorso-ventrales Patterning in der Frühphase der AER-Ausbildung kommt nicht zustande. Abbruch der vorderen und völliges Fehlen der hinteren Extremität (s. auch WNT). |
| DKK1 | Protein | Dikkopf-1, wichtiger Wnt3-Antagonist in der frühen Entwicklung der Knospe. Überexpression führt zu Abbruch des Wachstums der Extremität. Knockout von Dkk1 führt zu Missbildungen der Finger (postaxiale Polysyndaktylie)[61] |
| dHAND | Transkriptionsfaktor | (auch Hand2), aktiviert Shh. |
| FGF | Signalweg, Wachstumsproteine | Familie der Fibroblast-Growth-Factor-Proteine. FGFs induzieren die AER und sind maßgeblich verantwortlich für die Ausbildung der an die AER proximal anschließenden Progressionszone, d. h. für die Zellproliferation und -differenzierung in der wachsenden Knospe. Fgf8 wird in der AER ab einem sehr frühen Zeitpunkt und dann während der gesamten Extremitätenentwicklung ununterbrochen exprimiert.[1] Es kontrolliert die Shh-Expression und umgekehrt.[62] Fgf4 ist ein weiterer wichtiger Shh-Inducer.[22] |
| GLI3 | Transkriptionsfaktor | Mitglied der GLI-Proteinfamilie. Komponente des Shh-Signalwegs. Gli3 wird bei der Maus mit Fingerspezifikation und Polydaktylie assoziiert.[34] Polydaktylien durch assoziierte Gli3-Punktmutationen.[63] Gli3R verhindert die Expression der Aktivatorform Gli3 und wirkt so wirkt repressiv auf Shh;[1] kombiniertes Aussetzen von Gli3 und Shh bei der Maus wird mit Polydaktylie verbunden, ebenso das Knock out von GLi3 allein[34] Gli3 ist maßgeblich verantwortlich für die antero-posteriore-Limb-Asymmetrie wegen der posterioren Shh-Downregulierung. GLI3R ist der wichtigste Antagonist von SHH. Er wird als Morphogen entgegengesetzt zu SHH exprimiert, anterior stark und nach posterior abnehmend. |
| GREM | Protein | Antagonist von BMP. Wichtige Komponente der SHH-GREM-BMP-FGF-Feedback-Loop zur Verstärkung der AER-FGF-Signalgenbung im Modell Bénazet-Zeller 2009.[32] |
| HOX | Transkriptionsfaktoren | Familie der Hox-Gene bzw. -Moleküle; viele davon beteiligt an grundlegender Struktur- u. Symmetrieentwicklung des Embryos, unter anderem auch der Extremität. Die Hoxgene sind angeordnet in 4 Clustern (A–D) mit je bis zu 13 Hoxgenen. Sie werden entlang der proximo-distalen Achse in einem verschachtelten Muster exprimiert.[2] Hoxd11 und Hoxd13 sind an der Fingerbildung beteiligt; ferner Hoxa11 und Hoxa13.[64][65] Knockout des spezifisch im Autopod exprimierten Hoxa13 führt zur Deformationen des Autopod,[2] ebenso das Doppel-Knock-out von Hoxa13/Hoxd13. Tabin bespricht die strenge Abfolge von Hoxd8 bis Hoxd4 Expression sowie Hoxa10 bis Hoxa7-Expression als entscheidend für die Fingerzahl.[66] Nach jüngsten Forschungen werden Hoxgene als Regulatoren für einen Turing-Mechanismus gesehen. Abschalten von Hoxgenen erhöht die Fingerzahl bis auf 14 per Mausextremität.[45] Das geschieht dadurch, dass primär nicht die Knospe verbreitert wird, sondern der Fingerzwischenraum schmäler wird. Für ein Turing-Modell würde das die Wellenlänge sein, die sich verändert. Da Hoxgene Transkriptionsfaktoren zum Anschalten anderer Gene und keine Gradienten sind, müssen sie andere Stoffe regulieren, die die diffundierende Eigenschaft haben. Es ist nicht klar, welche das sein könnten.[67] |
| RA | Morphogen, Signalweg | Retinoid Acid (Retinsäure), Vitamin A. Als Morphogen nicht allein ausreichend für Fingerbildung bzw. -identität wie ursprünglich angenommen.[68] Die Expression erfolgt von proximal nach distal mit abnehmender Konzentration. Im Bereich der geringsten Konzentration liegt der Autopod. Dessen korrekte Ausbildung ist abhängig von der ausbalanciert schwachen, distalen RA-Expression. RA kann Fingerduplizierung ektopisch bewirken und eine ektopische ZPA imitieren.[69] RA reguliert SHH positiv und interagiert mit FGFs für proximo-distales Längenwachstum der Knospe. |
| SHH | Morphogen, Signalweg | Eines von 3 Proteinen im Hedgehog-Signal-Transduktionsweg, verantwortlich für Zellzahl im Autopod und Identifikation der Finger, nur indirekt für die Anzahl der Finger, sowie ursächlich für präaxiale Polydaktylie,[55][70] Shh-Interaktion mit Gli3 ist grundlegend für Fingerinitiation und -identifikation (Wagner & Larsson in Hall 2007, 55). SHH kontrolliert außerdem die Produktion von FGFs.[56] Eine der Hauptfunktionen von SHH ist es, das im Autopod von anterior nach posterior gegenläufige Morphogen GLI3R in Schach zu halten.[32] FGF´s, TBX2, HAND2 und andere Proteine steuern die Expression von Shh.[62] SHH und FGFs interagieren und halten so die Funktionsweise der beiden Organisatorregionen gegenseitig aufrecht. |
| SOX9 | Transkriptionsfaktor (Protein) | SOX9 wird während des gesamten Kondensationsprozesses der Extremitätenentwicklung exprimiert. Es dient als Genmarker für die Knorpelbildung.[71] Wichtiger Player im BSW-Modell[46] |
| TGF | Wachstumsfaktor (Protein), Signalweg | Transforming Growth Factor Familie. TGF-ß kontrolliert Zellproliferation und -differenzierung. In den Modellen Newman & Müller (2005),[41] Newman & Bhat (2007),[72] Zhu u. a. (2010)[39] ist TGF-ß die Aktivatorumgebung. |
| WNT | Morphogenfamilie, Wnt/β-Catenin-Signalweg[73] | WNT bildet eine Autoregulator-Komponente. WNT5 wird durch FGFs angeregt für gerichtetes Wachstum der proximo-distalen Achse in distaler Richtung.[74] Fehlen von Wnt3 führt zu Abbruch der vorderen bzw. zum völligen Fehlen der hinteren Extremität (s. auch β-CAT). WNT ist einer der Hauptfaktopren im BSW-Modell. Es wird in den Fingerzwischenräumen exprimiert und inhibitiert dort die SOX9-Expression, die auf die Fingerbereiche beschränkt bleibt.[46] |
Meilensteine in der Erforschung der Extremitätenentwicklung
| Jahr | Forscher | Entdeckung |
|---|---|---|
| 1808 | Louis Sébastian Marie de Tredern de Lézérec[75] | Dissertation über die Entwicklungsstadien des Hühnchens im Ei, darunter erste genaue Beschreibung der Entwicklungsstadien des Hühnchenfußes. |
| 1948 | John W. Saunders und Marry T. Gasseling[76] | Identifikation der AER im Hühnchen-Flügel. Entfernung der AER führt zu vollständigem Abbruch des Knospenwachstums und dem Ausbleiben der Skelettbildung |
| 1952 | Alan Turing[36] | Oszillierende chemische Reaktionen als Entwicklungsmechanismen, beschrieben in partiellen Differenzialgleichungen (Turing-Mechanismus). Noch keine Aktivator-Inhibitor-Unterscheidung, Selbstorganisation und Skalierung (vgl. 1972). |
| 1968 | John W. Saunders und Marry T. Gasseling[77] | Identifikation der ZPA; Anteriore Transplantation der ZPA; Verdoppelung von Fingern beim Hühnchen (Abb. 16).
 |
| 1969 | Lewis Wolpert[16] | Morphogen-Gradienten-Modell (French flag model). Räumliche Morphogenwirkung. |
| 1972 | Alfred Gierer und Hans Meinhardt[20] | Einführung von Aktivator-Inhibitor-Systemen (lokaler Aktivator, lateraler, weitreichender Inhibitor) mit jetzt regelmäßigen Mustern. Selbstorganisationsfähigkeit. Skalierung. Erst diese Systeme, die Turings Ansatz in zentralen Punkten erweitern, erlauben eine Vielzahl realistischer Raum-Zeitmodelle in der Entwicklungsbiologie. |
| 1976 | Dennis Summerbell (mit Lewis Wolpert)[24] | Progressionszonen-Modell. Zeitliche Morphogenwirkung. |
| 1975/81 | Cheryll Tickle[78] | ZPA-Transplantationen an unterschiedliche anteriore Positionen; Experimente zur Unterstützung des Morphogen-Gradienten-Modell; Polarisierende Signale sind Dosis-abhängig. |
| 1982 | C. Tickle, B. Alberts, L. Wolpert, J. Lee;[79] parallel auch D. Summerbell[80] | Retinsäure als erstes Morphogen identifiziert, das eine neue polarisierende Region induzieren kann. |
| 1982/83 | Hans Meinhardt[27][81] | Mathematische Modelle biologischer Patternformation. Die ersten konkreten biologischen Beispiele auf Basis von Turings theoretischer Arbeit. Proximo-distales Limb patterning Modell (Bootstrap model), vergleichbar mit Tabin und Wolpert 2007. |
| 1989 | P. Dolle, J. C. Izpisua-Belmonte, H. Falkenstein, A. Renucci, D. Duboule[5] | Mehrfachverwendung homeotischer Strukturen beim Wirbeltier u. a. in der Extremität. |
| 1991 | J. C. Izpisua-Belmonte, D. Duboule, C. Tickle, L. Wolpert[7] | Duboule/Tickle/Wolpert homeotische Strukturen bei der Flügelbildung von Vögeln. |
| 1993 | R. D: Riddle, R. L. Johnson, E. Laufer, Clifford J. Tabin[82] | Sonic Hedgehog wird als das Morphogen der ZPA identifiziert. |
| 1993 | Lee Niswander, C. Tickle, A. Vogel, I. Booth, G. R. Martin[83] | Die AER ist die kritische Signalquelle, die das proximo-distale Wachstum über die Produktion von Fibroblasten Wachstumsfaktoren (FGFs) kontrolliert. |
| 1997 | J. Yang et al.[84] | Untersuchungen zu SHH in Dosis-, Zeit- und Distanz-Wirkung. |
| 2001 | Zeng et al.[85] | Direkter Nachweis, dass SHH langreichend durch die antero-posteriore Knospe diffundieren kann. |
| 2001 | Gritli-Linde et al.[86] | Direkter Nachweis, dass SHH kurzreichend und graduell weitreichend wirken kann. |
| 2002 | Ying Litingtung et al.[34] | Shh und Gli3 sind entbehrlich, aber regulieren Zehenzahl und -identität (Abb. 17); Autopod ohne Shh- und Gli3-Expression ist polydaktyl ohne Identitäten der Zehen.
 |
| 2002 | A. T. Dudley, M. A. Ros, C.J. Tabin[87] | Early specification model als Gegenmodell zum Progresszonen-Modell. |
| 2003/08 | Laura A. Lettice, Robert Hill et al.[55][70] | ZRS als cis-Regulatorelement für Shh; Entdeckung mehrerer Punktmutationen in der ZRS, die präaxiale Polydaktylie bei Mensch, Maus und Katze induzieren. |
| 2004 | B. D. Harfe, P. J. Scherz, S. Nissim, A. P. McMahon, C. J. Tabin[29] | Temporale Wirkung von SHH in Ergänzung zur bisherigen Dosis-Abhängigkeit. Sowohl Dosis als auch Zeit werden als Wirkungsmechanesmen für Shh angenommen. Im Einzelnen ergeben sich für die unterschiedlichen Identitäten der Mausfinger: Der 5. und 4. Finger sind abhängig von der Shh-Expressiondauer; der 3. Finger ist abhängig von Shh-Expressionsdauer und der Shh-Konzentration; der 2. Finger ist nur abhängig von der Shh-Konzentration und der 1. Finger ist Shh-unabhängig (Abb. 15). Diese Ergebnisse stehen in Einklang mit dem Modell gestufter Genaktivierung unter einem morphogenetischen Gradienteneinfluss von Meinhardt.[28] |
| 2005 | Stuart A. Newman und Gerd B. Müller[41] | Ein Kernsatz zellularer und molekularer Prozesse ist verantwortlich für Selbstorganisation beim Limb Patterning. Positionsinformationen sind für Zellen nicht erforderlich. |
| 2005 | H. G. Hentschel, T. Glimm, J. A. Glazier, S. A. Newman[40] | Das Turing-basierte Simulationsmodell von Hentschel u. a. wird zur epigenetisch-mathematischen Vorlage für eine Reihe von Modellen in den Folgejahren um Stuart A. Newman |
| 2006 | S. Nissim, P. Allard, B. D. Harfe, C. J. Tabin[62] | Bestimmung einer neuen Tbx-Organisatorregion in der Knospe; sie unterdrückt die anteriore Shh-Expression. |
| 2006 | Takashi Miura et al.[50] | Mixed-Mode-Pattern im Double-foot Mutant; Turing Simulation einer wachsenden Knospe zeigt unterschiedlichen Bifurkationspunkte und Fingerbreite. |
| 2006 | Cheryll Tickle[19] | Zell-Zell-Signale in mesenchymen Zehen-Zwischenräumen sind verantwortlich für die Identität der Zehen vor Eintreten der Apoptose. |
| 2007 | Clifford J. Tabin, Lewis Wolpert[30] | Revision des Progressionszonen- und Early Specification Modells. Neue Sicht auf die Ausbildung der proximo-distalen Achse (Differentiation front model) mit Regulations-Interaktionen, die die temporär-dynamische Expression von AP2, Meis1, Hoxa11, and Hoxa13 kontrollieren. |
| 2008/09 | Johannes F. Knabe u. a.[88] und Joachimczak/Wróbel.[89] | French Flag Simulationen: Computer basierte Morphogen-Gradientenverläufe mit individueller Zelldifferenzierung in 2D und 3D. |
| 2009 | Matthew Towers, Ruth Mahood, Yili Yin Cheryll Tickle[90] | Integration von Wachstum und Digit-Spezifikation beim Patterning des Hühnchen Flügels. |
| 2009 | Hans Meinhardt[28] | Erst mehrstufiges Pattern führt zu exakteren Grenzen und Positionen bei der Musterbildung. |
| 2009 | Jean-Dénis Bénazet, Rolf Zeller et al.[31] | Selbstregulierendes System interagierender Feedback-Loops kontrolliert die Musterbildung der Maus-Extremität. |
| 2010 | J. Zhu, Y. T. Zhang, M. S. Alber, S. A. Newman[39] | Turing basiertes, Computer-Regulationsnetzwerk reproduziert wichtige Eigenschaften der Wirbeltier-Extremitätenentwicklung und -evolution. |
| 2011 | K. L. Cooper, M. A. Ros, C. J. Tabin[25] | Proximo-distales Patterning: Zellen können nicht Zeit interpretieren. Stattdessen existiert eine dynamische Balance zwischen der proximalen Retinsäure und den distalen FGFs, wodurch die proximo-distalen Segmente beim Hühnchen gesteuert werden. Gegenthese zum Progressionszonen-Modell. |
| 2011 | A. Roselló-Diez, M. A. Ros, M. Torres[26] | Diffundierende Signale, nicht autonome Mechanismen bestimmen die Hauptunterteilung der proximo-distalen Achse. |
| 2012 | A. Badugu, D. Iber et al.[33] | BMP-Rezeptor Interaktion in einem integrierten, systemischen Modell mit erstmals realistischer 2D-Knospen-Geometrie |
| 2012 | Sheth et al.[45] | Hox-Gene regulieren Fingerabstände und -anzahl, nachgewiesen empirisch und simuliert in Turing-Modell. |
| 2011/06/13 | T. Montavon u. a.,[12] B. Tarchini u. a.,[13] G. Aundry et al.[14] | Aufdeckung der Mechanismen der Colinearität in der Entwicklung der Wirbeltierextremität bei der Maus. Tatsächlich entspricht die axiale Organisation unsere Beine und Arme der linearen Organisation regulatorischer Chromatin-Domänen. Der Übergang zwischen diesen chromosomalen Domänen entspricht dem Handgelenk, das heißt dem Übergang zwischen dem alten (Arme und Beine) und dem neuen Teil (Hände und Füße) unserer Gliedmaßen.[14] |
| 2014/08/1 | Raspopovic et al.[46] | BSW-Turing-Modell des Autopod auf der Grundlage der gegenläufigen, wellenartigen Interaktion von BMP und WNT in den Zehenzwischenräumen sowie SOX9 in den kondensierenden Zehenelementen. |
Weitere Weblinks
- Limb Development (UNSW Embryology) Limb Development (UNSW Embryology)
- EMAP Mausatlas EMAP Mausatlas
- Caltech Mouseatlas Caltech Mouseatlas
- How do patterns develop in nature? How do digits develop on a limb? ~ Hox genes are the answer. How do patterns develop in nature? How do digits develop on a limb? ~ Hox genes are the answer.
Siehe auch
Einzelnachweise
- ↑ a b c d e Matthew Towers, Cheryll Tickle: Growing models of vertebrate limb development. In: Development. 136, 2009, S. 179–190.
- ↑ a b c Michael Kühl, Susanne Gessert: Entwicklungsbiologie. UTB basics, 2009.
- ↑ Lee Niswander: Pattern Information: Old Models out of a Limb. In: Nature Reviews Genetics. 4, Februar 2003, S. 133–143.
- ↑ N. Soshnikova, D. Zechner, J. Huelsken, Y. Mishina, R. R. Behringer, M. M. Taketo, E. B. Crenshaw, W. Birchmeier: Genetic interaction between Wnt/beta-catenin and BMP receptor signaling during formation of the AER and the dorsal-ventral axis in the limb. In: Genes Dev. 17(16), 15. Aug 2003, S. 1963–1968.
- ↑ a b P. Dolle, J. C. Izpisua-Belmonte, H. Falkenstein, A. Renucci, D. Duboule: Coordinate expression of the murine Hox-5 complex homoeobox-containing genes during limb pattern formation. In: Nature. 342, 14. Dez 1989, S. 767.
- ↑ P. Dolle, J. C. Izpisua-Belmonte, J. M. Brown, C. Tickle, D. Duboule: HOX-4 genes and the morphogenesis of mammalian genitalia. In: Genes Dev. 5, Okt 1991, S. 1767.
- ↑ a b J. C. Izpisua-Belmonte, C. Tickle, P. Dolle, L. Wolpert, D. Duboule: Expression of the homeobox Hox-4 genes and the specification of position in chick wing development. In: Nature. 350, 18. Apr 1991, S. 585.
- ↑ D. Duboule: Temporal colinearity and the phylotypic progression: a basis for the stability of a vertebrate Bauplan and the evolution of morphologies through heterochrony. In: Dev Suppl. 135, 1994.
- ↑ D. Duboule: The vertebrate limb: a model system to study the Hox/HOM gene network during development and evolution. In: Bioessays. 14, Jun, 1992, S. 375.
- ↑ P. Dolle u. a.: Disruption of the Hoxd-13 gene induces localized heterochrony leading to mice with neotenic limbs. In: Cell. 75, 5. Nov 1993, S. 431.
- ↑ F. Spitz, F. Gonzalez, D. Duboule: A global control region defines a chromosomal regulatory landscape containing the HoxD cluster. In: Cell. 113, 2. Mai 2003, S. 405.
- ↑ a b c T. Montavon u. a.: A regulatory archipelago controls Hox genes transcription in digits. In: Cell. 147, 23. Nov 2011, S. 1132.
- ↑ a b B. Tarchini, D. Duboule: Control of Hoxd genes' collinearity during early limb development. In: Dev Cell. 10, Jan 2006, S. 93.
- ↑ a b c d G. Andrey u. a.: A switch between topological domains underlies HoxD genes collinearity in mouse limbs. In: Science. 340, 7. Jun 2013, S. 1234167.
- ↑ a b c Adam H. Rabinowitz, Steven A. Vokes: Interaction of the transcriptional networks regulating limb morphogenesis. In: Developmental Biology. 268, 2012, S. 165–180.
- ↑ a b L. Wolpert: Positional information and the spatial pattern of cellular differentiation. In: Journal of Theoretical Biology. Vol. 25, Issue 1, Okt. 1969, S. 1–47.
- ↑ M. Varjosalo, J. Taipale: Hedgehog: functions and mechanisms. In: Genes and Development. 2008, S. 2462.
- ↑ Aimée Zuniga, Antonella Galli: Limb Pattern Formation. Upstream and Downstream of Shh Signalling. In: Carolyn E. Fisher, Sarah E. M. Howie (Hrsg.): Shh and Gli Signalling and Development. Landes Bioscience and Springer Science und Business Media, New York 2006, ISBN 1-4419-2294-6.
- ↑ a b C. Tickle: Making digit patterns in the vertebrate limb. In: Nature Reviews Molecular Cell Biology. 7, Januar 2006, S. 45–53.
- ↑ a b c Alfred Gierer, Hans Meinhardt: A Theory of Biological Pattern Formation. In: Kybernetik. 12, 1972, S. 30–39.
- ↑ a b c d e L. Wolpert: Positional Information and patterning revisited. In: Journal of Theoretical Biology. 269, 2011, S. 359–365.
- ↑ a b c Michael K. Richardson: Diffusible gradients are out - an interview with Lewis Wolpert. Interview. In: Journal of Developmental Biology. 53(5-6), 2009, S. 659–662.
- ↑ a b M. Kerszberg, L. Wolpert: Specifying Positional Information in the Embryo: Looking Beyond Morphogens. In: Cell. 130, 27. Juli 2007, S. 205–209.
- ↑ a b D. Summerbell: A descriptive study of the rate of elongation and differentiation of the skeleton of the developing chick wing. In: Journal of embryology and experimental morphology. 35, 1976, S. 241–260.
- ↑ a b Kimberly L. Cooper, Jimmy Kuang-Hsien Hu, Derk ten Berge, Marian Fernandez-Teran, Maria A. Ros, Clifford J. Tabin: Initiation of Proximal-Distal Patterning in the Vertebrate Limb by Signals and Growth. In: Science Magazine. 332, 6033, 27. Mai 2011, S. 1083–1086.
- ↑ a b A. Roselló-Díez, M. A. Ros, M. Torres: Diffusible Signals, Not Auto-nomous Mechanisms, Determine the Main Proximo-distal Limb Subdivision. In: Science. Vol. 332, no. 6033, 27. Mai 2011, S. 1086–1088.
- ↑ a b Hans Meinhardt: A bootstrap model for the proximodistal pattern formation in vertebrate limbs. In: Journal of Embryological Experimental Morphology. 76, 1983, S. 139–146.
- ↑ a b c d e Hans Meinhardt: Models for the Generation and Interpretation of Gradients. In: Cold Springs Harbor Perspectives in Biology. 1(4), Okt 2009, S. a001362.
- ↑ a b B. D. Harfe, P. J. Scherz, S. Nissim, H. Tian, A. P. McMahon, C. J. Tabin: Evidence for an Expansion-Based Temporal Shh Gradient in Specifying Vertebrate Digit Identities. In: Cell. Volume 118, Issue 4, 20. August 2004, S. 517–528.
- ↑ a b c C. Tabin, L. Wolpert: Rethinking the proximo-distal axis of the vertebrate limb in the molecular era. In: Genes & Dev. 21, 2007, S. 1433–1442.
- ↑ a b c Jean-Denis Bénazet, Mirko Bischofberger, Eva Tiecke, Alexandre Gonçalves, James F. Martin, Aimée Zuniga, Felix Naef, Rolf Zeller: A self-regulatory system of interlinked signaling feedback loops controls mouse limb patterning. In: Science. 323, 5917, 2009, S. 1050–1053.
- ↑ a b c J. D. Bénazet, R. Zeller: Vertebrate Limb Development Moving from Classical Morphogen Gradient to an Integrated 4-Dimensional Pattern System. 2009.
- ↑ a b c d e Amarendra Badugu, Conradin Kraemer, Philipp Germann, Denis Menshykau, Dagmar Iber: Digit patterning during limb development as a result of the BMP-receptor interaction. In: Scientific Reports. 2, 991, 2012. doi:10.1038/srep00991
- ↑ a b c d e Y. Litingtung, R. D. Dahn, Y. Li, J. F. Fallon, C. Chiang: Shh and Gli3 are dispensable for limb skeleton formation but regulate digit number and identity. In: Nature. Band 418, 2002, S. 979–983.
- ↑ Stuart A. Newman: Form and function remixed: developmental physiology in the evolution of vertebrate body plans. In: The Journal of Physiology. 592, 2014, S. 2403–2412, doi:10.1113/jphysiol.2014.271437.
- ↑ a b A. M. Turing: The chemical basis of morphogenesis. In: Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. Vol. 237, No. 641, 14. Aug 1952, S. 37–72.
- ↑ S. A. Newman, H. L. Frisch: Dynamics of Skeletal Pattern Formation in Developing Chick Limb. 1979.
- ↑ G. B. Müller, G. P. Wagner: Novelty in Evolution: Restructuring the Concept. In: Annual Revue of Ecology, Evolution and Systematics. 22, 1991, S. 229–256.
- ↑ a b c d e J. Zhu, Y.-T. Zhang, M. S. Alber, S. A. Newman: Bare Bones Patterning Formation: A Core Regulatory Network in Varying Geometrics Reproduces Major Feastures of Vertebrate Limb Development and Evolution. Online 2010.
- ↑ a b c d e H. G. Hentschel, T. Glimm, J. A. Glazier, S. A. Newman: Dynamical mechanisms for skeletal pattern formation in the vertebrate limb. In: Proceedings of the Royal Society B Biological Sciences. Band 271, 2005, S. 1713–1722.
- ↑ a b c d e f S. A. Newman, G. B. Müller: Origination and Innovation in the Vertebrate Limb Skeleton: An Epigenetic Perspective. In: Journal of Experimental Zoology Part B: Molecular and Developmental Evolution. 2005, S. 593–609.
- ↑ G. B. Müller: Epigenetic Innovation. In: M. Pigliucci, G. B. Müller (Hrsg.): Evolution - The Extended Synthesis. MIT Press, 2010, S. 307–332.
- ↑ a b c R. Chaturvedi, C. Huang, B. Kazmierczak, R. Schneider, T. Schneider, J. A. Izaguirre, T. Glimm, H. G. E. Hentschel, S. A. Newman, J. A. Glazier, M. Alber: On Multiscale Approaches to Three-Dimensional Modeling of Morphogenesis. In: J R Soc Interface. 22. Juni 2005, S. 237–253.
- ↑ K. Tamura, S. Yonei-Tamura, T. Yano, H. Yokoyama, H. Ide: The autopod: Its formation during limb development. In: Development, Growth & Differentiation. 50, 2008, S. 177–187.
- ↑ a b c d Rushikesh Sheth, Luciano Marcon, M. Félix Bastida, Marisa Junco, Laura Quintana, Randall Dahn, Marie Kmita, James Sharpe, Maria A. Ros: Hox Genes Regulate Digit Patterning by Controlling the Wavelength of a Turing-Type Mechanism. In: Science. Vol. 338 no. 6113, 14. Dezember 2012, S. 1476–1480.
- ↑ a b c d e J. Raspopovic, L. Marcon, L. Russo, J. Sharpe: Digit patterning is controlled by a BMP-Sox9-Wnt Turing network modulated by morphogen gradients. In: Science. Vol. 345, Iss. 6196, August 2014, S. 566–570.
- ↑ a b c D. Iber, R. Zeller: Making sense—data-based simulations of vertebrate limb development. In: Current Opinion in Genetics & Development. 22, 2012, S. 1–8.
- ↑ a b P. K. Maini, T. E. Woolley, R. E. Baker, E. A. Gaffney, S. S. Lee: Turing's model for biological pattern formation and the robustness problem. In: Interface focus. Band 2, Nummer 4, August 2012, S. 487–496, doi:10.1098/rsfs.2011.0113. PMID 23919129, PMC 3363041 (freier Volltext).
- ↑ a b c C. Tickle, H. Barker: The Sonic hedgehog gradient in the developing limb. In: Wiley interdisciplinary reviews. Developmental biology. Band 2, Nummer 2, 2013 Mar-Apr, S. 275–290, doi:10.1002/wdev.70. PMID 24009037.
- ↑ a b T. Miura, K. Shiota, G. Morriss-Kay, P. K. Maini: Mixed-mode pattern in Doublefoot mutant mouse limb–Turing reaction-diffusion model on a growing domain during limb development. In: Journal of theoretical biology. Band 240, Nummer 4, Juni 2006, S. 562–573, doi:10.1016/j.jtbi.2005.10.016. PMID 16364368.
- ↑ A. Dekanty, M. Milán: The interplay between morphogens and tissue growth. In: EMBO reports. Band 12, Nummer 10, September 2011, S. 1003–1010, doi:10.1038/embor.2011.172. PMID 21886183, PMC 3185346 (freier Volltext) (Review).
- ↑ a b K. Lai, M. J. Robertson, D. V. Schaffer: The sonic hedgehog signaling system as a bistable genetic switch. In: Biophysical Journal. Band 86, Nummer 5, Mai 2004, S. 2748–2757, doi:10.1016/S0006-3495(04)74328-3. PMID 15111393, PMC 1304145 (freier Volltext).
- ↑ Hannah H. Chang, Martin Hemberg, Mauricio Barahona, Donald E. Ingber, Sui Huang: Transcriptome-wide noise controls lineage choice in mammalian progenitor cells. In: Nature. Band 453, Nummer 7194, Mai 2008, S. 544–547, doi:10.1038/nature06965. PMID 18497826.
- ↑ N. A. Campbell, J. B. Reece: Biologie. 6., überarbeitete Auflage. Pearson Studium, 2006.
- ↑ a b c L. A. Lettice, A. E. Hill, P. S. Devenney, R. E. Hill: Point mutations in a distant sonic hedgehog cis-regulator generate a variable regulatory output responsible for preaxial polydactyly. In: Human Molecular Genetics. Band 17, Nummer 7, April 2008, S. 978–985, doi:10.1093/hmg/ddm370. PMID 18156157.
- ↑ a b C. J. Tabin, A. P. McMahon: Developmental biology. Grasping limb patterning. In: Science. Band 321, Nummer 5887, Juli 2008, S. 350–352, doi:10.1126/science.1162474. PMID 18635784.
- ↑ A. Wagner: The Origins of Evolutionary Innovations: A Theory of Transformative Change in Living Systems. 2011.
- ↑ Frietson Galis, Jacques J.M. van Alphen, Johan A.J. Metz: Why five fingers? Evolutionary constraints on digit numbers. In: Trends in Ecology & Evolution. 16, 2001, S. 637, doi:10.1016/S0169-5347(01)02289-3.
- ↑ K. E. Sears, R. R. Behringer, J. J. Rasweiler, L. A. Niswander: Development of bat flight: morphologic and molecular evolution of bat wing digits. In: Proceedings of the National Academy of Sciences. Band 103, Nummer 17, April 2006, S. 6581–6586, doi:10.1073/pnas.0509716103. PMID 16618938, PMC 1458926 (freier Volltext).
- ↑ K. Dahte: Molekulare Ursachen isolierter Handfehlbildungen am Beispiel des BMP-Signalwegs und von SHH. Habilitationsschrift. 2009.
- ↑ Cristina-Maria Crucial, Christof Niehrs: Secreted and Transmembrane Wnt Inhibitors and Activators. In: Cold Spring Harbors Perspective in Biology. 2012.
- ↑ a b c S. Nissim, P. Allard, A. Bandyopadhyay, B. D. Harfe, C. J. Tabin: Characterization of a novel ectodermal signaling center regulating Tbx2 and Shh in the vertebrate limb. In: Developmental biology. Band 304, Nummer 1, April 2007, S. 9–21, doi:10.1016/j.ydbio.2006.12.010. PMID 17300775, PMC 1868507 (freier Volltext).
- ↑ S. J. Driess: Punktmutationsanalysen bei GLI3-assoziierten Krankheitsbildern: Greig Cephalopolysyndaktylie-Syndrom, Pallister-Hall-Syndrom und isolierte Polydaktylien. Dissertation. 2005.
- ↑ G. P. Wagner, H. C. E. Larsson: Fins and Limbs in the Study of Evolutionary Novelties. In: Brian K Hall: Fins into Limbs, Evolution, Development and Transformation. University of Chicago Press, Chicago/London 2007.
- ↑ C. Fromental-Ramain, X. Warot, N. Messadecq, M. LeMeur, P. Dollé, P. Chambon: Hoxa-13 and Hoxd-13 play a crucial role in the patterning of the limb autopod. In: Development. Band 122, Nummer 10, Oktober 1996, S. 2997–3011. PMID 8898214.
- ↑ C. J. Tabin: Why we have (only) five fingers per hand: hox genes and the evolution of paired limbs. In: Development. Band 116, Nummer 2, Oktober 1992, S. 289–296. PMID 1363084 (Review).
- ↑ G. Vogel: Developmental biology. Turing pattern fingered for digit formation. In: Science. Band 338, Nummer 6113, Dezember 2012, S. 1406, doi:10.1126/science.338.6113.1406. PMID 23239707.
- ↑ C. Tickle: The Early History of the Polarizing Region: from Classical Embryology to Molecular Biology. In: International Journal of Development Biology. Band 46, 2002, S. 847–252.
- ↑ J. L. Galloway, C. J. Tabin: Classic limb patterning models and the work of Dennis Summerbell. In: Development. 135(16), Aug 2008, S. 2683–2687.
- ↑ a b L. A. Lettice, S. J. H. Heaney, L. A. Purdie, L. Li, P. de Beer, B. A. Oostra, D. Goode, G. Elgar, R. H. Hill, E. de Graaff: A long-range Shh enhancer regulates expression in the developing limb and fin and is associated with preaxial polydactyly. In: Human Molecular Genetics. Vol. 12, No. 14, 2003, S. 1725–1735.
- ↑ B. Boehm, M. Rautschka, L. Quintana, J. Raspopovic, J. Ziga, J. Sharpe: A landmark-free mrphogenetic staging system for the mouse limb bud. In: Development. 138, 2011, S. 1227–1234.
- ↑ S. A. Newman, R. Bhat: Activator-Inhibitor Dynamics of Vertebrate Limb. In: Birth Defects Research (Part C). 81, 2007, S. 305–319.
- ↑ Vicki L. Church, Philippa Francis-West: Wnt signalling during limb development. In: International Journal of Developmental Biology. 46, 2002, S. 927–936.
- ↑ K. E. Kmetzsch: Molecular and Cellular Mechanisms whereby the apicalectordermal Ridge (AER), via WNT5A, mediates directional Migration of the adjacent Mesenchyme during vertebrate Limb Development. Masterarbeit. 2009.
- ↑ Jean-Claude Beetschen: Louis Sébastian Marie de Tredern de Lézérec (1780-18?), a forgotten pioneer of chick embryology. In: Int. J. Dev. Biol. 39, 1995, S. 299–308.
- ↑ W. Saunders, M. T. Gasseling: The proximo-distal sequence of origin of the parts of the chick wing and the role of the ectoderm. In: Journal of Experimental Zoology. 108(3), Aug 1948, S. 363–403.
- ↑ W. Saunders, M. T. Gasseling: Ectodermal-mesenchymal interactions in the origin of limb symmetry. 1968. In: Wilhelm Roux's archives of developmental biology. Volume 182, Issue 3, 1977, S. 213–225.
- ↑ C. Tickle: Positional signalling and specification of digits in chick limb morphogenesis. In: Nature. 254, 1975, S. 199–202.
- ↑ C. Tickle, B. Alberts, L. Wolpert, J. Lee: Local application of retinoic acid to the limb bond mimics the action of the polarizing region. In: Nature. 1982.
- ↑ D. Summerbell: The effect of local application of retinoic acid to the anterior margin of the developing chick limb. In: Journal of Embryological Experimental Morphology. 78, 1983, S. 269–289.
- ↑ H. Meinhardt: Models of Biological pattern formation. Academic Press, London 1982.
- ↑ R. D. Riddle, R. L. Johnson, E. Laufer, Clifford J. Tabin: Sonic hedgehog mediates the polarizing activity of the ZPA. In: Cell. Vol. 75, Issue 7, 31. Dezember 1993, S. 1401–1416.
- ↑ L. Niswander, C. Tickle, A. Vogel, I. Booth, G. R. Martin: FGF-4 replaces the apical ectodermal ridge and directs outgrowth and patterning of the limb. In: Cell. 75, 1993, S. 579–587.
- ↑ J. Yang, G. Drossopoulou, P. T. Chuang, D. Duprez, E. Marti, D. Bumcrot, N. Vargesson, J. Clarke, L. Niswander, A. McMahon, C. Tickle: Relationship between dose, distance and time in Sonic Hedegehog-mediated regulation of anterior-posterior polarity in the limb. In: Development. Band 124, 1997, S. 4393–4407.
- ↑ X. Zeng, J. A. Goetz, L. A. Suber, W. J. Scott Jr, C. M. Schreiner, D. J. Robbins: A freely diffusible form of Sonic Hedgehog mediates long range signaling. In: Nature. 411, 2001, S. 716–720.
- ↑ A. Gritli-Linde, P. Lewis, A. P. McMahon, A. Linde: The whereabouts of a morphogen: direct evidence for short- and graded long-range activity of hedgehog signaling peptides. 2001.
- ↑ A. T. Dudley, M. A. Ros, C. J. Tabin: A re-examination of proximo-distal patterning during vertebrate limb development. In: Nature. 418, 2002, S. 539–544.
- ↑ J. F. Knabe, M. J. Schilstra, C. Nehaniv: Evolution and Morphogenesis of Differenciated Multicellular Organisms: Autonomously Generated Diffusion Gradients for Positional Information. In: Artificial Life. 2008, S. 321–328, XI.
- ↑ M. Joachimczak, B. Wróbel: Evolution of the morphology and patterning of artificial embryos: scaling the tricolour problem to the third dimension. In: LNCS. vol. 5777, 2009, S. 33–41.
- ↑ M. Towers, R. Mahood, Y. Yin, C. Tickle: Integration of growth and specification in chick wing digit-patterning. In: Nature. 789, 2009, S. 882–886.