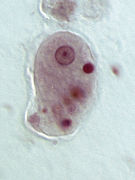
Entamoeba histolytica
| Entamoeba histolytica | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
Entamoeba histolytica (Magna-Form, | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Entamoeba histolytica | ||||||||||||
| Schaudinn, 1903 |
Entamoeba histolytica ist ein einzelliger Parasit, den man den Entamoebidae zurechnet. Er ist der Verursacher der Amöbenruhr, befällt vor allem den Menschen und unter experimentellen Bedingungen auch andere Säugetiere.
Merkmale
Entamoeba histolytica ist ein einzelliger eukaryoter Organismus ohne Mitochondrien (stattdessen mit Mitosomen), lebt anaerob, ernährt sich heterotroph und ist zur Phagozytose anderer Zellen, beispielsweise von Bakterien, fähig. Wegen seiner wandelbaren Körperform, verbunden mit einer Fortbewegung über Pseudopodien (Scheinfüßchen), wird er – wie auch verschiedene andere Arten – als Amöbe bezeichnet. Dieser amöboide Protist gehört zur Gattung Entamoeba. E. histolytica durchläuft in ihrem Lebenszyklus zwei Stadien: das einer unbeweglichen Zyste und das eines Trophozoiten, der hauptsächlich den menschlichen Darmtrakt besiedelt. Die Minuta-Form des Einzellers wird 10 bis 15 Mikrometer groß, die Magna-Form 25 bis 40 Mikrometer. Die gebildeten Zysten sind tetraploid, sie enthalten im reifen Zustand vier Zellkerne und erreichen eine Größe von rund 20 Mikrometern.[1]

Lebenszyklus
Diese Organismen gelangen zumeist als Zysten mit verunreinigter flüssiger oder fester Nahrung über den oberen Verdauungstrakt in den Dünndarm des Wirtsorganismus. Hier entschlüpft der Zystenhülle ein vierkerniges Zellstadium, aus dem durch mehrfache Teilung dann acht kleine einkernige Trophozoiten von E. histolytica hervorgehen, die den Dickdarm besiedeln. Diese bilden in den meisten Fällen eine Kommensale mit dem Wirt.[2] Die Trophozoiten können sich durch binäre Zellteilung vermehren. Sie können auch Zysten bilden, die den Darm mit den Faeces verlassen. Bei massivem Befall kann die Ausscheidungsmenge durchaus 100 Millionen[3] Zysten pro Tag betragen.
Meiose
Bei sich sexuell fortpflanzenden Eukaryoten findet die homologe Rekombination (HR) normalerweise während der Meiose statt. Die meiose-spezifische Rekombinase Dmc1 ist für eine effiziente meiotische HR erforderlich. Dmc1 wird nachweislich in E. histolytica exprimiert.[4] Die gereinigte Dmc1 aus E. histolytica bildet vor der Synapsis[5] Filamente und katalysiert die ATP-abhängige homologe DNA-Paarung und DNA-Strangaustausch (Crossing-over) über mindestens mehrere tausend Basenpaare. Die DNA-Paarungs- und Strangaustauschreaktionen werden durch den eukaryotischen Meiose-spezifischen Rekombinations-Accessory-Faktor Hop2-Mnd1[6] (ein Heterodimer) verstärkt.[4] Diese Prozesse sind von zentraler Bedeutung für die meiotische Rekombination, was darauf hindeutet, dass E. histolytica tatsächlich eine Meiose durchläuft.[4]
Schadwirkung
1875 beschrieb der russische Arzt Fedor Lösch in St. Petersburg erstmals das massive Vorkommen von Amöben bei einer Ruhrerkrankung und nannte sie Amöba coli.[7][8] Den Namen Entamoeba histolytica erhielt der Erreger 1903 von dem deutschen Zoologen Fritz Schaudinn, der dieses Protozoon näher erforschte – und sich dabei eine Infektion zuzog.
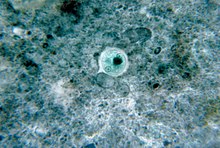
Infektionen mit Entamoeba histolytica werden als Amöbiasis bezeichnet.[3] Sie verlaufen in 80–90 % der Fälle ohne Krankheitszeichen.[1][3] Doch tragen symptomlose Infizierte über mit dem Stuhl ausgeschiedene Zysten – die mehrere Wochen infektiös bleiben können – zur Weiterverbreitung bei. Der hauptsächliche Wirt ist, neben einigen anderen Primatenarten, der Mensch. Zysten werden nur von den im Darm lebenden Formen gebildet.
Bei 10–20 % der Infizierten entwickeln sich Zeichen einer Erkrankung. Bei den besiedelnden Trophozoiten lassen sich zwei Formen unterscheiden, die kleine Minuta- und die größere Magna-Form. Minuta-Formen gleichen anderen, nicht pathogenen Entamoeba-Arten und leben im Dickdarmlumen des Wirts auf intakter Schleimhaut; diese Art der Kolonisierung ruft zumeist keine Symptome hervor.
Durchfälle mit Leibschmerzen sind deutliche Anzeichen für eine Irritation des Darmepithels durch die pathogene Form. Die Magna-Form ist nämlich fähig, aktiv in das Dickdarmgewebe einzudringen und es mittels besonderer Enzyme aufzulösen. Sie kann auch Erythrozyten phagozytieren. Eine solche invasive Amöbiasis kann – intestinal – im Darmtrakt zu Entzündungen (Colitis) und Gewebedefekten (Ulcerationen) führen. Gelangen Trophozoiten in den Blutstrom, können sie – extraintestinal – sich in der Leber sowie anderen Organen ansiedeln und dort Abszesse hervorrufen. Leberabzesse sind die weitaus häufigste Form einer extraintestinalen Amöbiasis. Drei Viertel dieser Fälle geht keine akute Amöbenruhr voraus.[3]
Das von Entamoeba histolytica hervorgerufene Krankheitsbild mit Diarrhoe bezeichnet man auch als Ruhr, genauer Amöbenruhr. Mit Eindringen in das Körpergewebe des Wirts wird von invasiver Amöbiasis gesprochen, die sowohl intestinal als auch extraintestinal manifest werden kann. Diese Invasion von E. histolytica wird durch Abgabe Gewebe auflösender („histo-lytischer“) Sekrete erleichtert; im Zusammenhang mit den körpereigenen Abwehrreaktionen des Wirts entstehen eitrige Geschwüre; sie können aufbrechen, doch ist – anders als bei bakteriellen – eine Punktion nur in Ausnahmefällen angeraten.[9]
Neben Unterleibsschmerzen und geleeartigem Durchfall können daher weitere Symptome auftreten. Schwerwiegende Komplikationen sind Bauchfellentzündungen und Abszesse; sie heilen unter adäquater medikamentöser Therapie meist vollständig aus.[3] Unbehandelt kann eine Amöbenruhr allein schon infolge der Flüssigkeitsverluste durch Austrocknung (Exsikkose) zum Tod führen. Nicht selten bricht die Krankheit erst Jahre oder Jahrzehnte nach der Infektion aus.
Verbreitung
Entamoeba histolytica ist weltweit verbreitet und besonders in Gebieten mit schlechten hygienischen Zuständen, im Abwasser oder in verschmutztem Trinkwasser anzutreffen. Ausbrüche werden im Anschluss an Katastrophen verzeichnet, wenn nur ungenügend reines Trinkwasser zur Verfügung steht. Auch Fehler im Abwassersystem können Amöbenruhr hervorrufen, so wurden beispielsweise bei der Weltausstellung 1933 in Chicago über 1.000 Fälle mit 58 Toten beobachtet, verursacht durch ein Übertreten von Abwässern in die Trinkwasserversorgung.
Weiter verbreitet ist Entamoeba dispar, eine Art, die früher zu Entamoeba histolytica gestellt wurde. Sie bildet keine Magna-Formen aus und ist optisch von der Minuta-Form von Entamoeba histolytica nicht zu unterscheiden. Sie ruft meist nur Durchfälle hervor, die von selbst abklingen.[10]
Meldepflicht
Der Nachweis von Entamoeba histolytica ist nach dem deutschen Bundesgesetz Infektionsschutzgesetz nicht meldepflichtig. Nach dem Recht der deutschen Bundesländer besteht jedoch gegebenenfalls eine Meldepflicht oder wird die Einführung einer solchen diskutiert. Auskünfte erteilen dazu die obersten Gesundheitsbehörden der jeweiligen Bundesländer. Insbesondere besteht in Mecklenburg-Vorpommern[11] eine Pflicht zur namentlichen Meldung bezüglich direktem oder indirektem Nachweis. Nach dem Recht Sachsens[12] ist der direkte oder indirekte Nachweis namentlich meldepflichtig, soweit der Nachweis auf eine akute Infektion hinweist. Nach dem Recht Thüringens[13] ist der Nachweis namentlich zu melden.
Bildergalerie
- Illustration (1910): E. histolytica Lebensstadien
- Trophozoit, E. histolytica
- Trophozoit, E. histolytica
- Fertige Zyste, E. histolytica
- Vierkernige Zyste, Schemazeichnung
- Zweikernige Zyste, E. histolytica
- E. histolytica, Zellteilung (vgl. E. invadens)
Einzelnachweise
- ↑ a b L. Ben Ayed, S. Sabbahi: Entamoeba histolytica. In: Global Water Pathogen Project (UNESCO). Teil 3 Protisten, Oktober 2017, doi:10.14321/waterpathogens.34.
- ↑ J. Blessmann, I. K. Ali, P. A. Nu, B. T. Dinh, T. Q. Viet, A. L. Van, C. G. Clark, E. Tannich: Longitudinal study of intestinal Entamoeba histolytica infections in asymptomatic adult carriers. In: J Clin Microbiol. Band 41, Nr. 10, Oktober 2003, S. 4745–4750. PMID 14532214
- ↑ a b c d e G. Burchard, E. Tannich: Epidemiologie, Diagnostik und Therapie der Amöbiasis. In: Deutsches Ärzteblatt. Jahrgang 101, Nr. 45, 2004, S. 3036–3040 (A), online.
- ↑ a b c Andrew A. Kelso, Amanda F. Say, Deepti Sharma, LeAnna L. Ledford, Audrey Turchick, Christopher A. Saski, Ada V. King, Christopher C. Attaway, Lesly A. Temesvari, Michael G. Sehorn: Entamoeba histolytica Dmc1 Catalyzes Homologous DNA Pairing and Strand Exchange That Is Stimulated by Calcium and Hop2-Mnd1. In: PLOS ONE. 10. Jahrgang, Nr. 9, 30. September 2015, S. e0139399, doi:10.1371/journal.pone.0139399, PMID 26422142, PMC 4589404 (freier Volltext), bibcode:2015PLoSO..1039399K (plos.org).
- ↑ synapsis, Collins Dictionary. Hier die erste angegebene Bedeutung (Zytologie).
- ↑ Dmitry V. Bugreev, Fei Huang, Olga M. Mazina, Roberto J. Pezza, Oleg N. Voloshin, R. Daniel Camerini-Otero, Alexander V. Mazin: HOP2-MND1 modulates RAD51 binding to nucleotides and DNA. In: Nature Communications, Band 5, Nr. 4198, 19. Juni 2014; doi:10.1038/ncomms5198.
- ↑ F. Lösch: Massenhafte Entwickelung von Amöben im Dickdarm. In: Archiv f. pathol. Anat. (1875). Band 65, Nr. 2, S. 196–211, doi:10.1007/bf02028799.
- ↑ Fedor Aleksandrovich Lesh (Lösch): Massive development of amebas in the large intestine. (Englische Übersetzung) In: Am. J. Trop. Med. Hyg. Band 24, Nr. 3, Mai 1975, S. 383–392, PMID 1098489.
- ↑ Leitlinien S1 Amöbiasis ( des vom 11. Juli 2019 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 279 kB), S. 15.
- ↑ C. G. Clark, L. S. Diamond: The Laredo strain and other 'Entamoeba histolytica-like' amoebae are Entamoeba moshkovskii. In: Mol Biochem Parasitol. Band 46, Nr. 1, Mai 1991, S. 11–18.PMID 1677159
- ↑ Gesetz zur Ausführung des Infektionsschutzgesetzes. (Infektionsschutzausführungsgesetz – IfSAG M-V). In: landesrecht-mv.de. Land Mecklenburg-Vorpommern, abgerufen am 23. Oktober 2024 (Fundstelle: GVOBl. M-V 2006, S. 524, Stand: letzte berücksichtigte Änderung: zuletzt geändert durch Artikel 1 des Gesetzes vom 26. Juni 2021 (GVOBl. M-V S. 1036, ber S. 1071)).
- ↑ § 2 Nr. 6 Sächsische Infektionsschutz-Meldeverordnung. Vollzitat: Sächsische Infektionsschutz-Meldeverordnung vom 19. Juli 2024 (SächsGVBl. S. 745). In: revosax.sachsen.de. Abgerufen am 22. Oktober 2024 (Fassung gültig ab: 17. August 2024).
- ↑ Thüringer Verordnung über die Anpassung der Meldepflicht für Infektionskrankheiten (Thüringer Infektionskrankheitenmeldeverordnung – ThürIfKrMVO -) Vom 15. Februar 2003. Fundstelle: GVBl. 2003, 107. (Stand: letzte berücksichtigte Änderung: zuletzt geändert durch Verordnung vom 4. Februar 2015 (GVBl. S. 3)).