Dicobaltcarbid
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
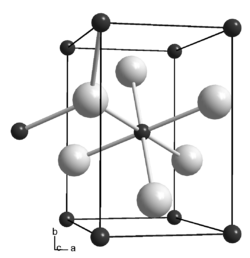
| _ Co _ C Metall-Metallbindungen sind nicht eingezeichnet | |||||||
| Allgemeines | |||||||
| Name | Dicobaltcarbid | ||||||
| Andere Namen |
Cobaltcarbid (mehrdeutig) | ||||||
| Verhältnisformel | Co2C | ||||||
| Kurzbeschreibung |
grauer Feststoff[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 129,88 g·mol−1 | ||||||
| Aggregatzustand |
fest[2] | ||||||
| Dichte |
7,76 g·cm−3[2] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Dicobaltcarbid ist eine anorganische chemische Verbindung des Cobalts aus der Gruppe der Carbide.
Gewinnung und Darstellung
Dicobaltcarbid kann durch Reaktion von Cobalt mit Kohlenmonoxid bei 220 °C gewonnen werden.[1]
Eigenschaften
Dicobaltcarbid ist ein metallischer, grauer Feststoff. Er zerfällt zwischen 260 und 310 °C und wird durch Wasserstoff zwischen 198 und 275 °C, durch Stickstoff zwischen 297 und 369 °C, sowie durch Kohlendioxid zwischen 364 und 540 °C in eine hexagonale Form überführt.[1] Er hat eine orthorhombische Kristallstruktur mit der Raumgruppe Pmnn (Raumgruppen-Nr. 58, Stellung 3) und den Gitterparametern a = 288 pm, b = 445 pm, c = 436 pm sowie zwei Formeleinheiten pro Elementarzelle.[2] In der Kristallstruktur ist jedes Kohlenstoff-Atom oktaedrisch von sechs Cobalt-Atomen umgeben, jedes Cobalt-Atom trigonal-planar von drei Kohlenstoffatomen. Außer Dicobaltcarbid existiert auch noch Tricobaltcarbid Co3C (CAS-Nummer: 12011-59-5). Es ist nur im Temperaturbereich zwischen 500 und 800 °C stabil, hat eine Dichte von 8,4 g·cm−3[2] und eine mit Trieisencarbid isotype Kristallstruktur.[1]
Verwendung
Dicobaltcarbid entsteht bei Verwendung von Cobaltkatalysatoren in der Fischer-Tropsch-Synthese und beeinflusst diese Reaktion.[4][5]
Literatur
- Yong-Hui Zhao, Hai-Yan Su, Keju Sun, Jinxun Liu, Wei-Xue Li: Structural and electronic properties of cobalt carbide Co2C and its surface stability: Density functional theory study. In: Surface Science. 606, 2012, S. 598–604, doi:10.1016/j.susc.2011.11.025.
Einzelnachweise
- ↑ a b c d Georg Brauer: Handbuch der präparativen anorganischen Chemie. 3., umgearb. Auflage. Band 3. Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1674.
- ↑ a b c d Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 380 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ B. H. Davis, Mario L. Occelli: Advances in Fischer-Tropsch Synthesis, Catalysts, and Catalysis. CRC Press, 2010, ISBN 1-4200-6257-3, S. 67 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Jianmin Xiong, Yunjie Ding, Tao Wang, L. i. Yan, Weimiao Chen, Hejun Zhu, Yuan Lu: The formation of Co2C species in activated carbon supported cobalt-based catalysts and its impact on Fischer-Tropsch reaction. In: Catalysis Letters. 102, 2005, S. 265–269, doi:10.1007/s10562-005-5867-1.

