Phane
Als Phane werden chemische Verbindungen bezeichnet, die aus einem Aromaten bestehen, der durch eine zumeist aliphatische Kette überbrückt ist.[1] Sie entsprechen damit weitgehend den ansa-Verbindungen (lat. ansa = Henkel), also den planaren, aromatischen Verbindungen, die von einem Henkel überbrückt werden, der aus einer Kette besteht.[2][3] Bei der IUPAC ist -phan auch die Nomenklaturendung (also eine Art Kurzschreibweise oder -Darstellung von chemischen Verbindungen) bei denen Ringe als Superatome aufgefasst werden.
Einteilung

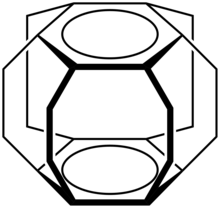
Ist der Aromat ein Benzolring so wird die Verbindung als Cyclophan (Zusammensetzung aus Cyclo, Phenyl und Alkan) bezeichnet, wobei der Begriff meist bei Molekülen verwendet wird, in denen zwei Benzolringe über mindestens zwei aliphatische Ketten (auch Henkelverbindungen genannt) an gegenüberliegenden Kohlenstoffatomen miteinander verbrückt sind. Letztere gehören damit in die Gruppe der polycyclischen aromatischen Kohlenwasserstoffe. Die wichtigsten Verbindungen sind dabei die Metacyclophane (I), Paracyclophane (II) und [n,n']Cyclophane (III). Daneben existieren auch noch Orthocyclophane. Enthalten Phane Heteroatome im aromatischen Ring nennt man sie Heterophane. Sind die Heteroatome in der Brücke lokalisiert, spricht man von Heteraphanen. Zeigt eines der Atome der Verbindung (zum Beispiel ein Wasserstoff-Atom) nach innen, so wird von in-Cyclophanen gesprochen.
Ist die maximal mögliche Verbrückung erreicht, so spricht man von einem Superphan. Als Metallacyclophane werden schließlich Cyclophankomplexverbindunden mit Übergangsmetallen bezeichnet.[1]
Für die Nomenklatur der Phane hat die IUPAC ein einfaches Verfahren entwickelt, das in Grundzügen auf einer Austauschnomenklatur besteht, bei der die einzelnen cyclischen Untereinheiten der Verbindungen als Superatome aufgefasst und den anderen Ringatomen gleichgestellt und fortlaufend nummeriert werden.[4]
Geschichte
Im Jahre 1937 beschrieb Arthur Lüttringhaus (1906–1992) zuerst die Ansa-Verbindungen.[5] Die Cyclophane wurden im Jahre 1949 von Brown und Farthing synthetisiert[6] und von Donald J. Cram und H. Steinberg in den frühen 1950er Jahren eingehend untersucht.[7] Die ersten Ferrocenophane wurden von Lüttringhaus und Kullik in den späten 1950er Jahren synthetisiert.[8]
Eigenschaften und Verwendung

Phane zeichnen sich durch ungewöhnliche chemische und physikalische Eigenschaften, wie zum Beispiel eine hohe Reaktivität, hohe Ringspannung, Chiralität und von der Norm abweichende Molekülparameter, aus. Wegen ihrer besonderen geometrischen Struktur sind Cyclophane ausgezeichnete Grundbausteine der supramolekularen Chemie. Der einfachste Vertreter eines Cyclophan wäre ein Benzolring mit einem Alkan als Brücke. Das bekannteste Cyclophan ist das [2.2]Paracyclophan, welches Anfang der 1970er Jahre von Brown und Farthing aus Polymeren extrahiert wurde.[9] Es kann über Pyrolyse von p-Xylol (Swarc-Pyrolyse), Hofmann-Eliminierung oder Wurtz-Kupplung dargestellt werden.[1] Auch andere Verfahren zur Herstellung von Cyclophanen, z. B. Flash-Vakuum-Pyrolyse zur Herstellung von [3.3]Cyclophan sind möglich. Da makrocyclische Cyclophane röhrenartige Strukturen bilden können, können sie kleinere Moleküle aufnehmen und so als Transporter dienen.[10] Dem ähnlich können auch Cryptophane, die durch kovalente Verknüpfung zweier Cyclotriveratryleneinheiten entstehen, als Container für andere Moleküle dienen. Sie gehören damit zu den Einschluss- bzw. Käfigverbindungen. In der Natur kommen einige Cyclophane in Actinomyceten (z. B. in Form von Rifampicin und Rifabutin) und Blaualge (z. B. Nostocyclophane) vor.
Literatur
- Fritz Vögtle; Cyclophanchemie – Synthesen, Strukturen, Reaktionen; Teubner Studienbücher 1990; ISBN 978-3-519-03508-4.
- Caroline Berns: Synthese und biologische Prüfung funktionalisierter Cyclophane verschiedener Ringgrößen als Oxaanaloga zytotoxischer Naturstoffe. München 2004, DNB 971997632, urn:nbn:de:bvb:19-21774 (Dissertation, Universität München).
- W. H. Powell: Phane nomenclature – I. Phane parent names (IUPAC Recommendations 1998). In: Pure and Applied Chemistry. Band 70, Nr. 8, 1998, doi:10.1351/pac199870081513 (freier Volltext).
- H. A. Favre, D. Hellwinkel, W. H. Powell, H. A. Smith Jr., S. S.-C. Tsay: Phane nomenclature. Part II. Modification of the degree of hydrogenation and substitution derivatives of phane parent hydrides (IUPAC Recommendations 2002). In: Pure and Applied Chemistry. Band 74, Nr. 5, 2002, doi:10.1351/pac200274050809 (freier Volltext).
Weblinks
- Uni-Kaiserslautern: Wirt-Gast-Systeme – Cyclophane
- The World of Cyclophanes
Siehe auch
Einzelnachweise
- ↑ a b c Muxin Han, Vanessa Maria Brake: (Seite dauerhaft nicht mehr abrufbar, festgestellt im November 2017. Suche in Webarchiven) (Uni Göttingen; PDF; 204 kB).
- ↑ Molekulare Ästhetik – Brezeln, Brücken, Bembel, Krüge, Käfige und Kronen (PDF; 2,3 MB).
- ↑ Eintrag zu Ansa compounds. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00374 – Version: 2.3.1.
- ↑ Dieter Hellwinkel: Die Systematische Nomenklatur Der Organischen Chemie: Eine Gebrauchsanweisung, S. 69ff; ISBN 978-3-540-26411-8.
- ↑ Horst Prinzbach: Erinnerungen an Arthur Lüttringhaus (1906–1992). In: European Journal of Organic Chemistry. 1998, 1998, S. 735, doi:10.1002/(SICI)1099-0690(199804)1998:4<735::AID-EJOC735>3.0.CO;2-N.
- ↑ C. J. Brown, A. C. Farthing, Nature (London), 1949, 164, S. 915.
- ↑ Donald J. Cram et H. Steinberg, J. Am. Chem. Soc., 1951, 73, S. 5691–5704.
- ↑ A. Lüttringhaus, W. Kullick: Ansa-Ferrocene. In: Angewandte Chemie. 70, 1958, S. 438, doi:10.1002/ange.19580701407.
- ↑ Henning Hopf: Mehrfach überbrückte Cyclophane. In: Nachrichten aus Chemie, Technik und Laboratorium. 28, 1980, S. 311, doi:10.1002/nadc.19800280505.
- ↑ Tetsuo Iwanaga, Ryoma Nakamoto u. a.: Cyclophanes within Cyclophanes: The Synthesis of a Pyromellitic Diimide-Based Macrocycle as a Structural Unit in a Molecular Tube and Its Inclusion Phenomena. In: Angewandte Chemie International Edition. 45, 2006, S. 3643, doi:10.1002/anie.200504499.
