Chalkone

Die Chalkone sind eine Untergruppe sekundärer Pflanzenstoffe innerhalb der Stoffgruppe der Flavonoide. Sie leiten sich strukturell durch Derivatisierung von der ihnen zugrunde liegenden Verbindung Chalkon ab.
Struktur
In den Chalkonen sind zwei Phenylgruppen über eine C3-Brücke in Form einer α,β-ungesättigten Carbonyl-Gruppierung miteinander verknüpft. Die CC-Doppelbindung der C3-Brücke besitzt normalerweise E-Konfiguration.
Der an die Carbonylgruppe gebundene Phenylring wird als A-Ring und der an das β-Kohlenstoffatom der CC-Doppelbindung gebundene Phenylring wird als B-Ring bezeichnet. Diese Bezeichnung ist analog zu den sich von den Chalkonen ableitenden Flavonoiden mit Flavan-Grundstruktur. Die Nummerierung der Phenylkohlenstoffatome ist aber leider nicht entsprechend. Die substituierbaren Positionen am A-Ring werden durch die Ziffern 2'-6' statt 5–8 und die substituierbaren Positionen am B-Ring durch die Ziffern 2–6 statt 2'–6' gekennzeichnet.[1]
Das Substitutionsmuster des A- und B-Rings der einzelnen Ckalkone ergibt sich aus der Substitution der biosynthetischen Chalkon-Vorläufermoleküle und Derivatisierungen, die sich der Bildung des Chalkongerüsts anschließen. Bei den normalen Chalkonen wird der A-Ring unter Decarboxylierung aus drei Molekülen Malonsäure aufgebaut, woraus sich die Hydroxygruppen an den Positionen 2', 4' und 6' des A-Rings ergeben. Der B-Ring wird aus Hydroxyzimtsäuren, häufig aus p-Cumarsäure gebildet, so dass die Position 4 am B-Ring meist eine Hydroxygruppe trägt. Gängig ist auch, dass am B-Ring neben der Position 4 auch die Positionen 3 hydroxyliert ist.
Ist das Substitutionsmuster der Ringe A und B vertauscht, so spricht man von Retrochalkonen, die eine Untergruppe der Chalkone bilden. Typisch für Retrochalkone ist das Fehlen von Hydroxy- bzw. Methoxygruppen an den Positionen 2' und 6' und dass dafür die Position 2 oder die Positionen 2 und 6 einen entsprechenden Substituenten tragen.
Nicht-glycosylierte Chalkone
Normale Chalkone
- Isoliquiritigenin
- Butein
- Naringeninchalkon
Die C-Alkylierung kommt bei Chalkonen relativ häufig vor. Meist handelt es sich um die Anbindung von Prenylgruppen, die auch mehrfach erfolgen kann.
- Xanthohumol
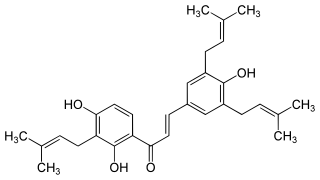
- Sophoradin
| Name | α | β | Konfig. | 2 | 3 | 4 | 5 | 6 | 2' | 3' | 4' | 5' | 6' | CAS |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Butein | H | H | E | H | OH | OH | H | H | OH | H | OH | H | H | 487-52-5 |
| Bavachalkon | H | H | E | H | H | OH | H | H | OH | H | OH | Prenyl | H | 28448-85-3 |
| Cardamomin | H | H | E | H | H | H | H | H | OH | H | OH | H | OMe | 19309-14-9 |
| Isobavachalkon | H | H | E | H | H | OH | H | H | OH | Prenyl | OH | H | H | 20784-50-3 |
| Isoliquiritigenin | H | H | E | H | H | OH | H | H | OH | H | OH | H | H | 961-29-5 |
| Isoliquiritigenin-2'-methylether | H | H | E | H | H | OH | H | H | OMe | H | OH | H | H | 51828-10-5 |
| Methylhydroxychalkon | H | H | E | H | OH | H | H | H | H | Me | H | H | H | 153976-41-1 |
| Metochalkon | H | H | E | H | H | OMe | H | H | OMe | H | OMe | H | H | 18493-30-6 |
| Naringeninchalkon | H | H | E | H | H | OH | H | H | OH | H | OH | H | OH | 25515-46-2 |
| Okanin | H | H | E | H | OH | OH | H | H | OH | OH | OH | H | H | 484-76-4 |
| Robtein | H | H | E | H | OH | OH | OH | H | OH | H | OH | H | H | 2679-65-4 |
| Sophoradin | H | H | E | H | Prenyl | OH | Prenyl | H | OH | Prenyl | OH | H | H | 23057-54-7 |
| Xanthohumol | H | H | E | H | H | OH | H | H | OH | Prenyl | OH | H | OMe | 6754-58-1 |
In den Spalten α–β und 2–6' sind die Substituenten der jeweiligen Positionen des Chalkon-Grundgerüsts der Chalkone angegeben: | ||||||||||||||
Retrochalkone
Das erste aus einer natürlichen Quelle isoliert Retrochalkon ist die Verbindung Echinatin (2-Methoxy-4,4'-Dihydroxychalkon), welche ein Isomer zu der Verbindung 4,4′-Dihydroxy-2′-methoxychalkon (Isoliquiritigenin-2'-methylether) ist. Die Verbindung wurde aus einer Zellkultur der Art Glycyrrhiza echinata aus der Gattung der Süßhölzer isoliert.[2]
| Name | α | β | Konfig. | 2 | 3 | 4 | 5 | 6 | 2' | 3' | 4' | 5' | 6' | CAS |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Echinatin | H | H | E | OMe | H | OH | H | H | H | H | OH | H | H | 34221-41-5 |
| Licochalcon A | H | H | E | OMe | H | OH | Dimethylallyl | H | H | H | OH | H | H | 58749-22-7 |
| Licochalcon B | H | H | E | OMe | OH | OH | H | H | H | H | OH | H | H | 58749-23-8 |
| Licochalcon C | H | H | E | OMe | Prenyl | OH | H | H | H | H | OH | H | H | 144506-14-9 |
| Licochalcon D | H | H | E | OMe | OH | OH | H | H | H | Prenyl | OH | H | H | 144506-15-0 |
| Licochalcon E | H | H | E | OMe | H | OH | (2S)-3-Methylbut-3-en-2-yl | H | H | H | OH | H | H | 864232-34-8 |
| Tepanon | H | H | E | OH | OMe | OMe | H | OMe | H | H | H | H | H | |
In den Spalten α–β und 2–6' sind die Substituenten der jeweiligen Positionen des Chalkon-Grundgerüsts der Chalkone angegeben: | ||||||||||||||
Glycosylierte Chalkone
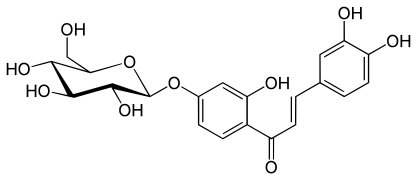
- Coreopsin
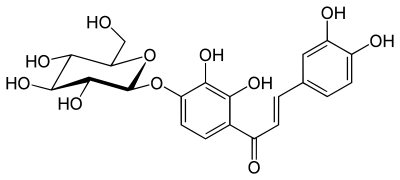
- Marein
| Name | Aglycon | α | β | Konfig. | 2 | 3 | 4 | 5 | 6 | 2' | 3' | 4' | 5' | 6' | CAS |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Coreopsin | Butein | H | H | E | H | OH | OH | H | H | OH | H | Glucosyloxy | H | H | 499-29-6 |
| Marein | Okanin | H | H | E | H | OH | OH | H | H | OH | OH | Glucosyloxy | H | H | 535-96-6 |
| Neoisoliquiritin | Isoliquiritigenin | H | H | E | H | H | OH | H | H | OH | H | Glucosyloxy | H | H | 59122-93-9 |
In den Spalten α–β und 2–6' sind die Substituenten der jeweiligen Positionen des Chalkon-Grundgerüsts der glycosylierten Chalkone angegeben: | |||||||||||||||
Biosynthese
Die Chalkone sind in der Biosynthese der Flavonoide die erste Verbindungsgruppe, die die für die Flavonoide typische C6-C3-C6-Grundstruktur besitzt. Dabei stammen bei den normalen Chalkonen die Kohlenstoffatome des A-Rings aus dem Polyketidstoffwechsel und die Kohlenstoffatome der C3-Brücke und des B-Rings von einer Zimtsäure.[3][4] Das Chalkon Naringeninchalkon wird aus p-Cumaroyl-Coenzym A, welches die Zimtsäure p-Cumarsäure enthält und drei Molekülen Malonyl-Coenzym A gebildet. Die Reaktion wird durch Chalkon-Synthasen katalysiert.[5]
Die Retrochalkone werden ausgehend von den entsprechenden Chalkonen gebildet. So entsteht das Retrochalkon Echinatin (2-Methoxy-4,4'-Dihydroxychalkon) durch O-Methylierung und mehrstufige Isomerisierung der C3-Brücke von Isoliquiritigenin. Bei den Retrochalkonen stammen somit die Kohlenstoffatome des B-Rings aus dem Polyketidstoffwechsel und die Kohlenstoffatome der C3-Brücke und des A-Rings von einer Zimtsäure.[4]
Ausgehend von den Chalkonen werden sowohl die Flavonoide mit Flavan-Grundstruktur als auch die Aurone gebildet. Die ersten Flavonoide mit Flavan-Grundstruktur, welche ausgehend von den Chalkonen unter Bildung des sechsgliedrigen C-Rings entstehen, sind die Flavanone. Die Reaktion wird durch Chalkon-Isomerasen katalysiert.[3][6]
Einzelnachweise
- ↑ Harborne J. B.: The Flavonoids - Advances in Research since 1980, 1988, Chapman and Hall, London, New York S. 329–340, ISBN 0-412-28770-6
- ↑ Furuya, T. et al.: Echinatin, a new chalcone from tissue culture of Glycyrrhiza echinata, Tetrahedron Letters, 1971, 12(27), S. 2567–2569, doi:10.1016/S0040-4039(01)96921-7.
- ↑ a b Peter Nuhn: Naturstoffchemie. 3. Auflage. S. Hirzel, Stuttgart/Leipzig 1997, ISBN 3-7776-0613-8, S. 602–605.
- ↑ a b Ayabe, S. I. et al.: Studies on plant tissue cultures. Part 36. Biosynthesis of a retrochalcone, echinatin, and other flavonoids in the cultured cells of Glycyrrhiza echinata. A new route to a chalcone with transposed A-and B-rings, Journal of the Chemical Society, Perkin Transactions 1, 1982, S. 2725–2734, doi:10.1039/P19820002725.
- ↑ Kreuzaler, F. et al.: Enzymatic synthesis of aromatic compounds in higher plants: formation of naringenin (5, 7, 4′-trihydroxyflavanone) from p-coumaroyl coenzyme A and malonyl coenzyme A, FEBS letters, 1972, 28(1), S. 69–72, doi:10.1016/0014-5793(72)80679-3
- ↑ Khan, M. K. et al.: A comprehensive review on flavanones, the major citrus polyphenols, Journal of Food Composition and Analysis, 2014, 33(1), S. 85–104, doi:10.1016/j.jfca.2013.11.004