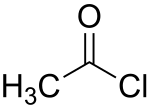
Acetylchlorid
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Acetylchlorid | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C2H3ClO | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit stechendem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 78,50 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||||||||
| Dichte |
1,10 g·cm−3 (20 °C)[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
51 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
reagiert heftig mit Wasser[1] | |||||||||||||||||||||
| Dipolmoment | ||||||||||||||||||||||
| Brechungsindex |
1,3886 (20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Acetylchlorid oder Essigsäurechlorid ist eine Chemikalie, genauer das funktionelle Chlorderivat der Essigsäure, in dem die Hydroxygruppe der Säure durch Chlor substituiert ist.
Gewinnung und Darstellung
Acetylchlorid wird durch die Umsetzung von Calciumchlorid mit Essigsäureanhydrid hergestellt. Alternativ lässt es sich durch Umsetzung von Essigsäure mit Phosphor(III)-chlorid erhalten. Die Synthese aus Essigsäure und Thionylchlorid bzw. Phosphor(V)-chlorid ist ebenfalls möglich, liefert aber schlechtere Ausbeuten.[6]
Eigenschaften
Acetylchlorid ist sehr flüchtig, es raucht an feuchter Luft infolge Bildung von HCl und besitzt eine heftige Reiz- bzw. Ätzwirkung auf die Atemwege. Wie alle Carbonsäurechloride ist Acetylchlorid sehr reaktionsfähig. Mit Wasser reagiert es rasch und exotherm unter Bildung von Essigsäure, mit Alkoholen und Phenolen unter Bildung der entsprechenden Ester und mit Ammoniak sowie primären und sekundären Aminen werden Carbonsäureamide gebildet. Dabei wird jeweils Chlorwasserstoff abgespalten.
Verwendung
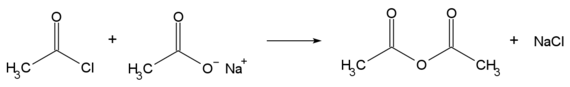
Acetylchlorid wird hauptsächlich zur Veresterung und Acetylierung in chemischen Synthesen benutzt. Aber auch bei der Synthese von Arzneimitteln (Acetylsalicylsäure) wird Acetylchlorid bei der Veresterung eingesetzt. Zusammen mit Natriumacetat kann es zur Darstellung von Essigsäureanhydrid benutzt werden:
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu Acetylchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Januar 2023. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dipole Moments, S. 9-52.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-6.
- ↑ Eintrag zu Acetyl chloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-3.
- ↑ Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 439f.