Hæmoglobin
 |
 |
Hæmoglobin (også Hb) er et protein, der findes i de røde blodlegemer hos mennesket og mange dyr. I blodet sørger hæmoglobin for at transportere ilt fra lungerne ud til kroppens væv som musklerne og hjernen. Her overgives ilten til proteinet myoglobin, og affaldsstoffet kuldioxid optages og transporteres med tilbage til lungerne, hvor det udskilles til udåndingsluften.[1]
Hæmoglobin nedbrydes i milten til det gulbrune galdefarvestof bilirubin, der udskilles med galden fra leveren. Hæmoglobin er det stof, som gør blodet rødt, idet dets jernindhold giver den røde farve.
Hæmoglobin forekommer i forskellige former. Hos voksne mennesker dominerer den form, der hedder hæmoglobin A, mens hæmoglobin F dominerer i fosterstadiet. Molekylvægten for hæmoglobin A er 64458.[2]
Struktur
Hæmoglobin består af globiner, der er kæder af polypeptider hver sammenknyttet med en såkaldt hæmgruppe. Hver hæmgruppe indeholder jernionen Fe+2 (ferrojern) og kan derfor binde et iltmolekyle (O2). Globinkæderne kan have en forskellig sammensætning af aminosyrer. Hos pattedyr består den mest almindelige type af hæmoglobin af fire (to par) sådanne globiner og kaldes derfor en tetramer (fire monomerer). Hos mennesket og mange primater er det ene par to ens α-kæder, mens det andet par er to ens β-, γ-, δ- eller ε-kæder (det vil sige alfa-, beta-, gamma-, delta- eller epsilonkæder). En α-kæde har 141 aminosyreenheder, mens en β-kæde har 146 aminosyreenheder.
Hos voksne består hæmoglobin mest almindeligt af to α-kæder og to β-kæder. Til hver kæde er der bundet en hæmgruppe med en ikke-kovalent binding. En hæmgruppe består af en porfyrin-ring med Fe(II) i midten, hvortil der er bundet en histidin. Ilt bindes til hæmoglobin ved at bindes til jernionen.
Porfyrinringen er opbygget af fire pyrrolringe bundet sammen af methen-broer. På to af pyrrolringene sidder vinylsidegrupper, mens der på de to andre sidder propionatgrupper. På alle fire ringe sidder en methylgruppe. Det præcise navn for hæmgruppen er ferro-protoporfyrin IX.
En globinkæde er en foldet polypeptidkæde, der udgør en afgrænset del af proteinet. Aminosyresammensætningen af en α-kæde og en β-kæde er 18 % identiske. Der er 141 aminosyrerester i en α-kæde og 146 i en β-kæde. I en β-kædes polypeptidkæde er der otte helixer, der inddeler kæden i otte dele (navngives: A-H). I en α-kæde er D-segmentet erstattet af et loop.
Tertiærstrukturen af α- og β-kæder ligner hinanden meget. De er symmetrisk relaterede ved en to-fold rotation. De fire kæder er bundet sammen af interaktioner; hovedsageligt mellem α1-β1 og α2-β2 (35 aminosyrerester), men der er også få interaktioner mellem α1-α2 og β1-β2 (19 aminosyrerester). De fleste interaktioner er hydrofobe, men hydrogenbindinger og ionbindinger er også med til at holde proteinet sammen. Visse interaktioner mellem α1-β2 og α2-β1 medfører konformationsændringer, som har betydning for iltbindingen.
Konformationsændring ved binding af ilt
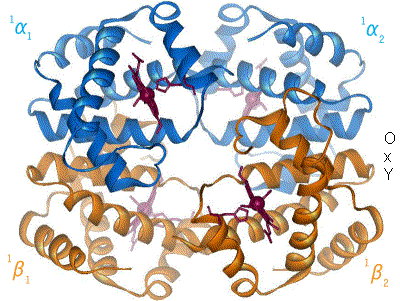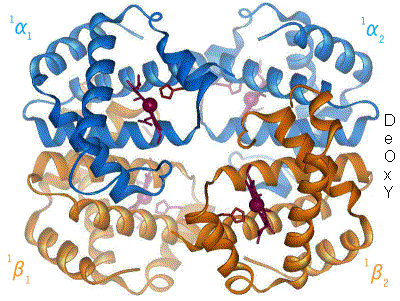
Når hæmoglobin binder ilt, ændres proteinets kvaternærstruktur. Denne strukturændring sker udelukkende over α1-β2 kontaktfladen (også kaldet interface), således at hæmoglobins dobbeltsymmetri bibeholdes. Bindingen af ilt roterer α1β1-dimeren ca. 15º i forhold til α2β2-dimeren, hvilket bevirker, at nogle atomer ved α1-β2 kontaktfladen flytter sig op til 6 Å (Ångstrøm) i forhold til hinanden.
Den kvaternære konformation af deoxyhæmoglobin (hæmoglobin uden ilt) kaldes T-state (T for ”tense”), mens den tilsvarende for oxyhæmoglobin kaldes R-state (R for ”relaxed”). Ligeledes hedder de forskellige tertiære konformationer af de enkelte subunits T- og R-states for hhv. deoxy- og oxyHb. R-formen har højere iltaffinitet end T-formen.
T-formen er stabiliseret af et netværk af saltbroer i C-terminalen, som brydes i dannelsen af R-formen. R-state stabiliseres ved bindingen af ilt.
Ved konformationsændringerne i overgangen fra T- til R-state brydes T-formens saltbroer vha. den energi, der frigives ved jerns binding til ilt. Man kender ikke den præcise rækkefølge i hvilken de forskellige trin i overgangen sker.
I T-state befinder Fe(II) sig 0,6 Å ude af hæm-planen på samme side som den proximale histidin, fordi bindingerne mellem jern og porfyrin er for lange til, at Fe(II) kan ligge i porfyrin-planen, og fordi porfyrin danner en slags kuppel, som forhindrer jern i at ligge dér.
Ved iltbindingen forandres hæmgruppens elektronkonfiguration, hvilket eliminerer kuppeldannelsen og får Fe(II)-porfyrin-bindingerne til at trække sig 0,1 Å sammen, således, at jern bevæger sig ind i hæm-planen. Under denne bevægelse ”trækker” jern den proximale histidin og dennes bundne F-helix (de otte helixer i globinkæden navngives A til H) med sig, hvilket styrker Fe-O2-bindingerne, fordi den steriske hindring mellem ilt og hæmgruppen mindskes.
Overgangen fra R- til T-state sker sandsynligvis i muskelvævet, hvor iltkoncentrationen er lav, og T-state derfor er mest stabil.
Kontaktfladerne mellem α1-β2 og α2-β1 har kun to stabile positioner, som styrkes af to ækvivalente sæt hydrogenbindinger. I begge disse konformationer passer sub-units som puslespilsbrikker.
Derimod ville mellemliggende positioner skabe stor sterisk spænding, så strukturen ville være meget ustabil. En enkelt subunit eller dimer kan derfor ikke ændre konformation uafhængigt af de andre, hvilket giver anledning til kooperativiteten af hæmoglobins iltbinding.
Kooperativitet
I protein-sammenhæng betyder kooperativitet, at bindingen af ligand eller substrat til én subunit af proteinet, ændrer proteinets overordnede konformation på en sådan måde, at bindingen af ligander til de øvrige subunits sker lettere end bindingen af den første.
En deoxyhæmoglobin-subunit, som binder ilt, er tvunget til at forblive på T-formen, fordi den overordnede konformation af hele tetrameren er T-state. Denne T-form har imidlertid reduceret iltaffinitet, sandsynligvis fordi dens Fe-O2-binding strækkes længere end dens almindelige længde pga. den steriske frastødning mellem hæmgruppen og ilten, og i β-delene pga. nødvendigheden af at flytte valin E11 væk fra iltbindingsstedet.
Efterhånden som mere ilt bindes til tetrameren, opbygges denne steriske spænding i de subunits, som har bundet ilt, indtil den er stærk nok til at få hele molekylet til at gå over til R-state. Den steriske spænding stammer fra energien i Fe-O2-bindingen. De subunits, som endnu ikke har bundet ilt, kommer altså også på r-formen, som har større iltaffinitet end t-formen. Derfor bindes ilt lettere til de resterende subunits end til den første. Faktisk bindes det fjerde iltmolekyle til hæmoglobin 100 gange lettere end det første.
Hvis man fjerner de C-terminale aminosyrerester, som danner t-formens stabiliserende saltbroer, antager deoxyHb en form, som ligner den normale form for oxyHb. Hermed mindskes den kooperative effekt, fordi proteinet allerede er (næsten) i R-state.
Det samme er tilfældet, hvis man fjerner den proximale histidin. Dog viser undersøgelser, at hæmoglobin uden den proximale histidin stadig udviser en smule kooperativitet, hvilket viser, at hæmgrupperne også ”kommunikerer” med hinanden uden om denne aminosyrerest. Man kender endnu ikke de nøjagtige mekanismer for denne øvrige kommunikation, men den kan involvere bevægelser af proteingrupper i kontakt med hæmgruppen, af den distale histamin på de fire subunits samt af valin E11 på β-delene.
Globindelen har altså stor betydning for iltbindingsaffiniteten. Derudover gør den også iltbindingen reversibel, hvilket er nødvendigt (ellers ville hæmoglobin ikke ”aflevere” ilten til vævet). Uden globindelen ville Fe(II) bundet til hæmgruppen oxideres irreversibelt til Fe(III) ved tilstedeværelse af ilt. Dette sker gennem formationen af et kompleks mellem to hæmgrupper.
Fe(III) kan ikke binde ilt, fordi dens sjette ligand-bindingsposition optages af et vandmolekyle. Globin forhindrer oxidationen ved at ”lukke porfyrin-Fe(II)-komplekset inde”, så det ikke kan reagere med noget. Globins aminosyrer skaber en sterisk hindring, så to hæmgrupper ikke kan mødes, og dermed at oxidationen til Fe(III) ikke kan finde sted.
Iltbinding
Når ilt bindes til hæmoglobin, sænkes pH i blodbanen lidt, og der frigives protoner. Hvis der fjernes protoner fra hæmoglobin, stimuleres proteinet til at binde ilt. Dette kaldes Bohr-effekten. Hvis pO2 (iltens partialtryk) er lav i kapillærerne, vil hæmoglobin optage H+. Selvom R-state har høj iltaffinitet, vil den bundne ilt afgives, fordi iltkoncentrationen i vævet er lav.
Reaktionen katalyseres af kulsyreanhydrase i erythrocytten. Det optagne H+ vil provokere hæmoglobin til at frigive den bundne ilt, så pH genoprettes. Optagelsen af H+ vil også stimulere dannelsen af bicarbonat, og derved fremme transporten af CO2 bundet til hæmoglobin. Hvis pO2 er høj, vil ilt bindes til hæmoglobin, så de bundne protoner frigives sammen med CO2. CO2 kan transporteres enten direkte ved at bindes til N-terminalen som carbamat eller indirekte ved at hæve koncentrationen af bicarbonat ved Bohr-effekten. Protonerne som frigives ved carbamat- dannelsen bliver delvist optaget gennem Bohr-effekten, og derved frigives en større mængde ilt end hæmoglobin ellers ville frigive. Deoxyhæmoglobin binder mere CO2 som carbamat end oxyhæmoglobin gør, og CO2 har, ligesom H+, derfor betydning for hæmoglobins iltaffinitet.
Hæmoglobin kan også binde Cl-, og koncentrationen af disse ioner har også betydning for iltaffiniteten. Det meste Cl- bindes, ligesom CO2, til hæmoglobins deoxy-form i N-terminalen. Cl- bindes når HCO3- forlader erythrocytten, da der skal være ens ladning på begge sider af membranen. Chloridionen bindes mellem N-terminalens aminogruppe valin 1 α2 og arginin 141 α1. Cl- bindes altså til hæmoglobin for at erstatte bicarbonat og stabilisere proteinet. I T-state er det midterste hulrum i proteinet større end i R-state, så der er flere Cl--ioner i hulrummet i T-state end i R-state. Cl- stabiliserer T-state ved at de positive ladninger reduceres gennem ”electrostatic shielding”. Derfor har Cl- betydning for iltaffiniteten.
Når α-subunits reagerer med cyanat, sker der en carbamoylation af N-terminalens aminogruppe. Hvis de blandes med almindelige β-subunits, mangler det påvirkede hæmoglobin 20-30 % af den normale Bohr-effekt. Dette skyldes at Cl- ikke er til stede i carbamoylateret deoxyhæmoglobin. Normalt har N-terminalen en pKa omkring 8, men på deoxyformen er N-terminalen påvirket af Cl-, som hæver dens pKa ved at binde protoner. N-teminalen er normalt kun delvist ladet, men pKa-skiftet får N-teminal-aminogrupperne til at binde mange flere protoner i T-state end i R-state. N-terminalen i α-subunits bidrager altså til Bohr-effekten.
Det samme gør β-subunits. Fjernes C-terminalens histidin 146 β, reduceres Bohr-effekten med 40 %. Dette skyldes, at der normalt dannes en saltbro mellem histidin 146 β’s imidazol-ring og aspartat 94 β i samme subunit i T-state. Saltbroen stabiliserer proteinet i T-state og øger pKa i imidazol-ringen til 8,0 hvilket gør det lettere at protonere molekylet.
Denne saltbro findes ikke i R-state, så pKa falder til den normale værdi på ca. 6,5, og da pH er omkring 7,4 i blodet, vil histidin 146 være uprotoneret i oxyhæmoglobin. Man har altså redegjort for 60-70% af Bohr-effekten. Overflade-histidiner deltager også i Bohr-effekten, hvor små ændringer i pKa-værdien vil influere på hvor mange protoner der bindes af histidin. pKa for disse histidiner påvirkes af skiftet fra T-state til R-state. En høj koncentration af protoner, vil fremme frigivelsen af ilt.
D-2,3-bifosfoglycerat (BPG) dannes i det røde blodlegeme og kan bindes stærkt til deoxyhæmoglobin. Derigennem falder hæmoglobins iltaffinitet, fordi BPG holder hæmoglobin i deoxy-formen. Hvis BPG ikke er til stede i kapillærerne, frigives meget lidt ilt, eftersom hæmoglobins iltaffinitet øges, når BPG ikke er til stede. Bindingen af BPG til deoxyhæmoglobin, svækkes af høje saltkoncentrationer, hvilket indikerer, at bindingen er ionisk. BPG har fem anioniske grupper, som bindes til en ring af otte kationiske sidegrupper på de to β-subunits i deoxyhæmoglobins midterste hulrum. De anioniske grupper på BPG er ikke længere væk fra de kationiske grupper på begge β-subunits, end at der kan dannes hydrogenbindinger og saltbroer mellem dem.
Ved konformationsændringen fra T- til R-state vil de to β H-helixer indsnævres, så BPG afgives, fordi hulrummet bliver for småt til at BPG kan være der. Desuden gøres afstanden mellem β-subunits’enes N-terminaler større, så afstanden er for stor til, at der kan dannes hydrogenbindinger mellem N-terminalerne og BPG’s fosfatgrupper. T-state stabiliseres af BPG ved at det krydsbinder de to β-subunits, så hæmoglobins iltaffinitet sænkes, da BPG sætter sig på iltens plads. Modsat både BPG og IHP (inositol hexafosfat) kan NO, som binder stærkere til hæmoglobin end ilt gør, tvinge hæmoglobin ind i R-state, og derved fjerne ilt fra kapillærerne.
BPG medvirker til højdeadaptation. Højdeadaptation er en stigning i mængden af hæmoglobin per erythrocyt og en stigning i antallet af erythrocytter. Det tager flere uger at opnå denne tilstand fuldstændigt. Dog kan en enkelt dag i højderne bevirke, at man har en mærkbar højdeadaptation. Adaptationen opnås ved at BPG-koncentrationen stiger. Dette bevirker, at der sker et fald i iltaffinitet, og derfor sker der en stigning i den mængde af ilt, som hæmoglobin afgiver i kapillærerne. Kommer man ned til et lavere niveau, så vil mængden af BPG hurtigt falde og iltaffiniteten stige.
Ved højdeadaptation sker der også en tilbageholdelse af CO2, som giver et fald i pH og derved sænker hæmoglobins iltaffinitet. Dette er medvirkende til en øget afgivelse af ilt til vævet, men er uafhængigt af tilstedeværelsen af BPG.
Hvis opstigningen sker for hurtigt, kan kroppen ikke vænne sig til ændringerne i omgivelserne, og man får højdesyge, som i værste fald kan være dødelig.
Ovenstående afsnit beskriver allosteriske interaktioner mellem hæmoglobin og forskellige ligander. Allosteriske interaktioner er når en bestemt ligands binding til et protein afhænger af en anden ligand bundet et andet sted på proteinet.
Der findes forskellige modeller, der beskriver den kooperative binding af ligander. En model er symmetri-modellen, hvor bindingsaffiniteten kun afhænger af proteinets kvaternære tilstand.
Iltafgivelse
Som nævnt bevirker den lave iltkoncentration i vævene, at hæmoglobin vil afgive sin bundne ilt, selvom proteinet er i sin højaffinitetskonformation (R-state).
Undersøgelser har vist, at anæmipatienter, hvis blod kun indeholder halvt så meget hæmoglobin som normalt, kan leve (næsten) normalt. Tværtimod vil en rask person, som pludseligt får halvdelen af sine iltbindingssteder blokeret af kulilte (CO) dø, fx som når en person begår selvmord ved at lukke sig inde i en bil og lukke udstødning ind uden af lufte ud. Forklaringen er, at hæmoglobin har større affinitet for CO end for ilt, og når CO bindes, fastlåses hæmoglobin i R-state, så ilten ikke kan afgives til vævene. Derved kvæles man, populært sagt, i vævet i stedet for i lungerne. Anæmi-patienterne får transporteret mindre ilt, men da det afgives til vævene (som det skal), kan de leve forholdsvis normalt.
Kilder
- ^ Hemoglobin. Hemoglobin uses a change in shape to increase the efficiency of oxygen transport. Molecule of the month
- ^ Van Beekvelt MC, Colier WN, Wevers RA, Van Engelen BG (2001). "Performance of near-infrared spectroscopy in measuring local O2 consumption and blood flow in skeletal muscle". J Appl Physiol. 90 (2): 511-519. PMID 11160049. (Webside ikke længere tilgængelig)
- Donald and Judy Voet Hemoglobin Middlebury College
- Wikibooks:Hemoglobin
| Søsterprojekter med yderligere information: |
