Węglowodory aromatyczne
Węglowodory aromatyczne, areny (w skrócie: WA) – cykliczne węglowodory spełniające warunki aromatyczności. Zazwyczaj występują w nich sprzężone wiązania wielokrotne, czyli zamknięty układ naprzemiennie położonych wiązań podwójnych i pojedynczych między atomami węgla. We wszystkich atomach pierścienia aromatycznego zachodzi hybrydyzacja sp2, dzięki czemu cząsteczki są płaskie (o ile dodatkowe czynniki stereochemiczne nie wymuszają odchyłek, jak np. dla fullerenu C60).
Układ ten powoduje, że wiązania, "rozmywają" się tak, że nie można dokładnie ustalić, które z nich są podwójne, a które pojedyncze[a]. Jedna z metod formalnego opisu tego zjawiska opiera się na założeniu występowania rezonansu chemicznego. Mechanika kwantowa pozwala wyznaczyć funkcje falowe elektronów. Elektrony tworzące wiązania π zajmują kolejne orbitale cząsteczkowe, zgodnie z zasadami stosowanymi do orbitali atomowych. Obsadzanie kolejnych orbitali π przez pary elektronowe rozpoczyna się od tych, które mają najmniejszą energię. Obliczona łączna gęstość elektronowa na trzech orbitalach wiążących wskazuje, że w stanie podstawowym "rozchodzą" się po równo po wszystkich atomach w pierścieniu. Energia całej cząsteczki jest wówczas mniejsza od energii obliczonej dla struktury Kekulégo (3 wiązania C-C i 3 wiązania C=C). Tę różnicę nazywa się „energią stabilizacji aromatycznej”, „energią stabilizacji przez sprzężenie” albo „energią rezonansu”.
Nie wszystkie węglowodory cykliczne posiadające sprzężone wiązania wielokrotne są aromatyczne. Prostym, choć nie zawsze skutecznym testem na aromatyczność, jest reguła Hückla, głosząca że związek jest aromatyczny, jeśli liczba elektronów tworzących wiązania π w pierścieniu jest równa 4n+2, gdzie n jest dowolną liczbą naturalną. Reguła ta jest spełniona zawsze dla układów monocyklicznych, natomiast istnieje wiele policyklicznych związków aromatycznych, które nie spełniają tej reguły (np. piren)[1].
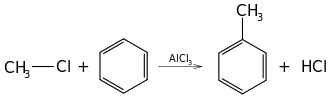
Struktura wiązań w arenach powoduje, że są one bardzo trwałe, a ich reaktywność znacząco różni się od innych węglowodorów nienasyconych. Charakterystyczną reakcją dla węglowodorów aromatycznych jest substytucja elektrofilowa katalizowana kwasami Lewisa, zwana reakcją Friedla-Craftsa (reakcja przedstawia alkilowanie benzenu):
Cząsteczki węglowodorów aromatycznych, takich jak benzen czy benzopiren, są płaskie. Mają więc możliwość wślizgiwania się między nukleotydy DNA, co nadaje im właściwości rakotwórcze.
Wzory i nazewnictwo
Wzór benzenu – najprostszego arenu zapisuje się na dwojaki sposób. Po pierwsze, stosując wzory Kekulégo:

Zapis tego typu jest często wygodny, jednak sugeruje on błędnie że benzen posiada strukturę cykloheksa-1,3,5-trienu. Poprawniejszą, lecz mniej praktyczną formą zapisu struktury benzenu jest wskazanie dwóch możliwych wzorów Kekulégo jako skrajnych struktur rezonansowych:

Delokalizację wiązań w węglowodorach aromatycznych można przedstawić za pomocą okręgu:

Następny aren – naftalen – zapisać można analogicznie[2][3]:
 |
 |
 |
W przypadku węglowodorów aromatycznych niepodstawionych skondensowanych stosuje się najczęściej nomenklaturę zwyczajową (benzen, naftalen, antracen, fenantren). W przypadku arenów o liczbie skondensowanych pierścieni większej od 4 nazwę ustala się dodając do greckiego rdzenia liczby pierścieni sufiks -acen (pentacen, heksacen, heptacen itd.).
W przypadku arenów jednopodstawionych, takich jak toluen:

przy ustalaniu nazwy systematycznej do nazwy arenu dodaje się jako przedrostek przekształconą nazwę podstawionego pierwiastka lub grupy (np. chloro-, etylo-, itd.). W przypadku toluenu nazwa systematyczna to metylobenzen[b].
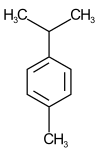
W przypadku węglowodorów aromatycznych wielopodstawionych w nazwie wymienia się w porządku alfabetycznym lokanty wszystkich grup i atomów pierwiastków, tak aby suma ich liczb była najmniejsza, a numer lokantu podstawnika pierwszego według alfabetu był jak najniższy. Dla przykładu nazwa systematyczna p-cymenu to 1-metylo-4-(propan-2-ylo)benzen, a półsystematyczna to 1-izopropylo-4-metylobenzen.
W nazewnictwie stosuje się także oznaczenia orto (o-), meta (m-), para (p-). Określają one wzajemne położenie dwóch podstawników względem siebie:
- orto – położenie obok siebie, przy dwóch kolejnych atomach węgla, a zatem w pozycji 1,2
- meta – położenie w pozycji 1,3 – a zatem między dwoma podstawnikami występuje jeden niepodstawiony nimi atom węgla.
- para – położenie naprzeciwko. W przypadku pochodnych benzenu odpowiada to pozycji 1,4.
Dwa związki aromatyczne, które różnią się tylko położeniem podstawników są izomerami konstytucyjnymi typu orto, meta, para.
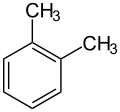
Przykłady izomerów ksylenu:
- o-ksylen
(1,2-dimetylobenzen) - m-ksylen
(1,3- dimetylobenzen) - p-ksylen
(1,4-dimetylobenzen)
Uwagi
Przypisy
- ↑ Roberts, John D., Streitwieser, Andrew, Regan, Clare M.. Small-Ring Compounds. X. Molecular Orbital Calculations of Properties of Some Small-Ring Hydrocarbons and Free Radicals. „Journal of the American Chemical Society”. 74 (18), s. 4579-4582, 1952. DOI: 10.1021/ja01138a038.
- ↑ J.D. Roberts, M.C. Caserio: Chemia organiczna. Warszawa: PWN, 1969, s. 824–825.
- ↑ Robert T. Morrison, Robert N. Boyd: Chemia organiczna. Warszawa: PWN, 1985, s. 674. ISBN 83-01-04166-8.