Ochrona katodowa

Ochrona katodowa – jedna z elektrochemicznych metod ochrony metali przed korozją elektrochemiczną, która polega na tym, że do chronionej konstrukcji dołącza się zewnętrzną anodę. Powierzchnia chronionego metalu staje się katodą – elektrodą, na której zachodzą reakcje redukcji depolaryzatora, a nie zachodzi utlenianie metalu, czyli jego korozja[2][3][4].
Przebieg reakcji katodowych można wywołać, opcjonalnie:
- stosując zewnętrzne źródło napięcia (ochrona katodowa elektrolityczna)
- zapewniając kontakt chronionej konstrukcji z protektorem – metalem o niższym potencjale w środowisku korozji (ochrona katodowa galwaniczna, ochrona protektorowa)
Podstawy fizykochemiczne
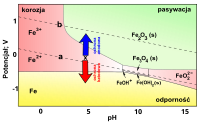
i zasada ochrony elektrochemicznej
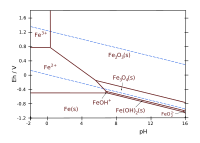
Środowisko umowne: brak innych anionów poza OH–, stężenie jonów 0,001 mol/kg wody, temperatura 25 °C[5]




Fizykochemiczne podstawy metod elektrochemicznej ochrony metali przed korozją formułuje:
- termodynamika reakcji, zachodzących w układach metale–środowisko
- kinetyka procesów elektrochemicznych, zachodzących w zamkniętym obwodzie elektrycznym
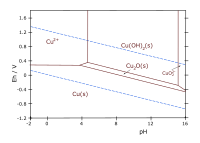
Graficzną ilustracją równowag termodynamicznych są np. wykresy Pourbaix, sporządzane w układzie współrzędnych potencjał–pH. Na tych wykresach jest określane położenie obszarów termodynamicznej trwałości[7][8]:
- metalu (obszar odporności na korozję)
- stałych produktów utlenienia (obszar potencjalnej pasywacji)
- jonów w roztworze wodnym (korozja)
Metal, którego stan określa punkt leżący w obszarze korozji, można ochraniać zmieniając jego potencjał elektryczny i kwasowość środowiska.
Różnica między potencjałem elektrody w stanie równowagi i potencjałem w zamkniętym ogniwie galwanicznym jest nazywana nadnapięciem lub nadpotencjałem. W pracującym ogniwie (układ oddalony od stanu równowagi) elektrody ulegają polaryzacji – potencjał katody zmniejsza się, a potencjał anody wzrasta, tym bardziej im większa jest gęstość prądu, związana z szybkością odpowiednich reakcji elektrodowych (nadnapięcie aktywacyjne) oraz z szybkością dyfuzji substratów i produktów tych reakcji (polaryzacja stężeniowa). Ustala się stan równowagi dynamicznej. Zależności potencjałów elektrod od gęstości prądu są przedstawiane na wykresach Evansa[7][8].
Natężenie prądu, płynącego w nie zasilanym z zewnątrz obwodzie ochronnym (ochrona galwaniczna), jest proporcjonalne do szybkości roztwarzania się protektora. Efektywność uzyskiwania prądu ochronnego zależy od rodzaju użytego materiału (sprawność protektora). Jeżeli obwód jest zasilany z zewnątrz, np. z prostownika (ochrona elektrolityczna), informacje o potencjałach równowagowych i mechanizmach polaryzacji pozwalają ustalać, jakie wartości gęstości prądu ochronnego gwarantują przesunięcie potencjału chronionej konstrukcji poza obszar korozji. W czasie obliczeń wykorzystuje się wyniki badań rezystancji (R) środowiska, w którym znajduje się konstrukcja i anody ochronne (np. grunt, woda morska, woda słodka)[1][3][4][9].
Ochrona katodowa elektrolityczna

Ochrona rurociągów podziemnych lub podwodnych polega na zastosowaniu zewnętrznego źródła napięcia (prostownik) i anod ochronnych, rozmieszczonych w pobliżu (zamknięcie obwodu elektrycznego przez elektrolit)[1][10]
Materiały i urządzenia
W układach ochrony katodowej elektrolitycznej, są używane trwałe anody ochronne („uziomy”), połączone przewodami elektrycznymi z dodatnim biegunem prostownika. Chroniona konstrukcja jest łączona z biegunem ujemnym. Obwód elektryczny zamyka elektrolit (np. roztwory glebowe). Do ochrony metalowych instalacji w gruncie są stosowane prostowniki o napięciu wyjściowym 50 V, a w wodzie morskiej – 24 V[10].
Anody ochronne są wykonywane z takich materiałów, jak[1]:
- stopy żelaza z krzemem (zobacz: żelazokrzem, dodatek stopowy)
- grafit
- platynowany lub pokrywany tlenkami metali tytan lub tantal
- kable miedziane w izolacji z przewodzących polimerów
- stal (np. odcinki rur)
Elektrody są umieszczane w zasypce z koksiku węglowego lub ponaftowego, co zwiększa ich trwałość i zmniejsza własną rezystancję.
Poza elektrycznym obwodem prądowym (polaryzującym) stosuje się obwód kontrolny („potencjałowy”). W jego skład wchodzi elektroda odniesienia (np. Cu/CuSO4 nas.) i miliwoltomierz, włączony w system operacyjnego monitorowania wartości potencjałów na powierzchni chronionej konstrukcji. Poza pomiarami napięcia wykonuje się pomiary korozymetryczne. Polegają one na określaniu przyrostu rezystantywności próbki metalu, która jest umieszczona w środowisku korozji (np. ziemi)[10].
Zastosowania
Ochrona katodowa elektrolityczna jest stosowana powszechnie, np. do ochrony:
- rurociągów w wodzie morskiej lub gruncie
- zbiorników zakopywanych w gruncie lub zasypywanych (np. zbiorników paliw, odizolowanych od instalacji naziemnych)
- zbrojenia żelbetu[11]
Podstawowa ochrona rurociągów polega na stosowaniu powłok ochronnych, metalicznych, nieorganicznych lub organicznych, jedno– lub wielowarstwowych. Stosuje się powłoki o dużej rezystywności (≥1012 Ωm) i dużej wytrzymałości na przebicie prądem o wysokim napięciu (≥10 kV/mm). Nakładanie i konserwacja szczelnych i trwałych warstw to działania trudne i kosztowne. Stosowanie powłok o niższej jakości, wspomaganych elektrochemicznie – prądem polaryzacji katodowej – jest często bardziej uzasadnione ekonomicznie[1].
Ochrona katodowa galwaniczna




W przypadku galwanicznej ochrony katodowej, są używane wymienne kształtki, wykonane z materiału o niskim potencjale, montowane bezpośrednio na chronionej konstrukcji. W otoczeniu styku na powierzchni chronionej zachodzą reakcje katodowe, np. redukcja tlenu. Chroniony metal nie koroduje dzięki korozji protektora.
Materiały i urządzenia
Anody galwaniczne muszą się charakteryzować wystarczająco niskim potencjałem i brakiem tendencji do polaryzacji (małe zmiany potencjału w czasie pracy, np. wskutek osadzania się tlenków). Stosuje się np. anody magnezowe, cynkowe, aluminiowe. Do czystych metali są wprowadzane dodatki stopowe, zmniejszające skłonność do pasywacji i szybkość korozji własnej oraz zwiększające równomierność roztwarzania. Do magnezu dodawany jest np. mangan, co obniża potencjał elektrody[1]. Protektory[4]:
- magnezowe (powszechnie stosowane w gruncie[1]) zawierają dodatki 5-7% Al, 2-4% Zn, min. 0,15% Mn; mają niski potencjał, lecz ich sprawność jest niewielka (ok. 55%)[1]
- cynkowe (najczęściej stosowane w wodzie morskiej), to czysty 99,99% lub stop zawierający<0,1-0,15% Hg, 0,12-0,15% Al, 0,05-0,1% Cd; są tańsze od magnezowych, należą do grupy protektorów niskopotencjałowych o wysokiej skuteczności (90%)
- aluminiowe, są stosowane tylko w postaci stopów z Zn (do 6%), Sn (0,1-1%) oraz In, Hg, Sn; są protektorami niskopotencjałowymi o sprawności 80%
Do ochrony instalacji ze stopów miedzi stosuje się protektory ze stali węglowej[4].
Potencjały korozyjne anod magnezowych wynoszą ok. 1,5 do -1,7 V względem elektrody odniesienia Cu/nasyc. CuSO4. W obwodzie ochronnym osiągane jest napięcie 0,6–0,8 V. Anody są umieszczane w gruncie w workach, zawierających aktywator, czyli mieszaninę bentonitu (20% obj.), gipsu (75%) i siarczanu sodu (5%). Bentonit z siarczanem sodu są wprowadzane w celu utrzymania właściwej wilgotności i rezystancji otoczenia anody, gips poprawia równomierność roztwarzania. Ochrona galwaniczna wymaga odizolowania chronionej konstrukcji od wszystkich instalacji uziemionych. Jest to niemal niewykonalne w sytuacji baz paliw, w których wszystkie urządzenia są zwykle połączone systemem instalacji odgromowej i nie izolowanymi rurociągami[1].
Zastosowania
Ocena możliwości zastosowania ochrony galwanicznej jest trudna - wymaga rozpatrzenia wielu informacji na temat konstrukcji instalacji oraz cech środowiska pracy (np. rezystancja i jej zmienność; wilgotność i pH gruntu, zasolenie wody, obecność prądów błądzących i instalacji odgromowych)[1][4][10].
W odniesieniu do instalacji eksploatowanych w gruncie metoda jest stosowana, gdy mają one niewielkie wymiary (np. zbiorniki paliw w gruncie lub w kopcach ziemnych), są dobrze izolowane i znajdują się w środowisku o małej rezystancji. Znaczenie wymienionych ograniczeń maleje w miarę wzrostu jakości stosowanych powłok ochronnych (powłoki dobrze izolujące i trwałe umożliwiają stosowanie mniejszych wartości prądu ochronnego. Nawet w gruncie o wysokiej rezystantywności 100-200 Ωm niezbędną gęstość prądu ochronnego można osiągnąć przy użyciu niewielu anod galwanicznych[1].
Anody galwaniczne nie nadają się, ze względu na duże zapotrzebowanie prądu, do ochrony dużych instalacji, które[1]:
- są niewystarczająco izolowane od otoczenia
- kontaktują z gruntem o różnych właściwościach
- są połączone instalacją odgromową naziemnych części konstrukcji
na przykład do ochrony orurowania otworów wiertniczych lub dużych zbiorników paliwowych (>500m3) o osi pionowej, które zwykle nie są izolowane, a są połączone z siecią odgromową i siecią nie izolowanych rurociągów[1].
Rurociągi i zbiorniki o osi poziomej i niewielkiej pojemności (do 50m3 dla paliw płynnych i do kilku m³ dla gazu płynnego) mogą być ochraniane galwanicznie, jeżeli[1]:
- nie są połączone z siecią uziemiającą (bezpośrednio ani pośrednio)
- są pokryte powłokami o wystarczającej rezystancji (rząd 104 Ωm2)
Zakres zastosowań jest rozszerzony na nowo projektowane zbiorniki podziemne i zakopcowane o większych pojemnościach (do kilkuset m³), ponieważ w ich projektach przewiduje się stosowanie powłok o zwiększonej trwałości i rezystantywności oraz gwarantowanych zabezpieczeń przed kontaktem z sąsiednimi instalacjami uziemionymi[1].
Zobacz też
Przypisy
- ↑ a b c d e f g h i j k l m n o Maciej Markiewicz, Paweł Stochaj. Ochrona katodowa zbiorników za pomocą anod galwanicznych. „Nafta-Gaz”. LXVI (6), s. 49-499, 2010.06.10. (pol.).
- ↑ Maciej Markiewicz, Paweł Stochaj. Ochrona katodowa zbiorników za pomocą anod galwanicznych. „Nafta-Gaz”. LXVI (6), s. 49-499, 2010.06.10. (pol.).
- ↑ a b c Krystyna Moskwa, Bogusław Mazurkiewicz: Korozja i ochrona przed korozją. [w:] skrypt AGH [on-line]. www.chemia.odlew.agh.edu.pl. [dostęp 2011-04-20].
- ↑ a b c d e Barbara Surowska: Wybrane zagadnienia z korozji i ochrony przed korozją. Lublin: Politechnika Lubelska, 2002, s. 1-143.
- ↑ Corrosion Thermodynamics: Potential-pH-diagram: iron. www.corrosion-doctors.org. [dostęp 2011-04-29].
- ↑ Corrosion Thermodynamics; Potential-pH-diagram: aluminum. www.corrosion-doctors.org. [dostęp 2011-04-29]. (ang.).
- ↑ a b Gustaw Kortüm: Elektrochemia. Warszawa: Państwowe Wydawnictwo Naukowe, 1970.
- ↑ a b Marcel Pourbaix: Wykłady z korozji elektrochemicznej. Warszawa: Państwowe Wydawnictwo Naukowe, 1978.
- ↑ A. Stankiewicz, J. Nowatkowski. Korozja stalowych konstrukcji budowli hydrotechnicznych w portach polskiego wybrzeża morskiego. „Inżynieria Morska i Geotechnika”, s. 311 315, 2006. IMOGEOR, Spółka z o.o.; BazTech.
- ↑ a b c d Mieczysław Bartoszewski, Stefan F. Filipowicz. Wybrane zagadnienia ochrony katodowej rurociągów przed korozją. „Prace Instytutu Elektrotechniki”, s. 97-112, 2007. Politechnika Warszawska.
- ↑ Justyna Kuziak, Ochrona zbrojenia przed korozją w elementach żelbetowych, Prace Katedry Inżynierii Materiałów Budowlanych, Politechnika Warszawska, według www.il.pw.edu.pl, data dostępu: 2011-04-21
Linki zewnętrzne
- Bob Cottis. The electronic journal for all aspects of corrosion. „The Journal of Corrosion Science and Engineering”. Linki do artykułów dot. różnych aspektów korozji. ISSN 1466-8858. [dostęp 2011-05-12]. (ang.).
- G. K. Glass, A. M. Hassanein. Surprisingly Effective Cathodic Protection. „The Journal of Corrosion Science and Engineering”. 4 (7), 3rd November 2003. ISSN 1466-8858. (ang.).
