Chlorek sulfurylu
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
SO2Cl2 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
134,97 g/mol | ||||||||||||||||||||||||||||||||||||
| Wygląd |
bezbarwna, dymiąca ciecz o ostrym zapachu[2] | ||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||
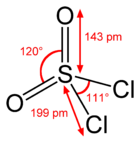
Chlorek sulfurylu, SO
2Cl
2 – nieorganiczny związek chemiczny z grupy chlorków kwasowych.
Otrzymywanie
Otrzymywany jest w bezpośredniej reakcji pomiędzy dwutlenkiem siarki i chlorem, z węglem aktywnym jako katalizatorem. Bez udziału katalizatora reakcja ta zachodzi niezwykle powoli[4]:
- SO
2 + Cl
2 ⇌ SO
2Cl
2
Właściwości
W warunkach pokojowych jest bezbarwną cieczą o ostrym zapachu[2]. Produkt techniczny, zawierający niewielkie ilości SO
2 i Cl
2, może mieć barwę jasnożółtą. Chlorek sulfurylu jest niestabilny, rozkłada się z wydzieleniem dwutlenku siarki i chloru, jednak w temperaturze poniżej 200 °C stopień rozkładu jest niewielki[4].
Nie rozpuszcza się w wodzie, natomiast reaguje z nią, tworząc kwas siarkowy i chlorowodór:
- SO
2Cl
2 + 2H
2O → H
2SO
4 + 2HCl↑
Reakcja ta jest silnie egzotermiczna, w temperaturze pokojowej przebiega wolno, jednak w wyższych temperaturach lub w obecności związków katalizujących ją (np. jodu) przebiega wybuchowo. Z wodą o temperaturze bliskiej 0 °C może tworzyć hydraty SO
2Cl
2·15H
2O[4].
Zastosowanie
Chlorku sulfurylu używa się w syntezie organicznej. Służy przede wszystkim do sulfonowania i chlorowania[4].
Przypisy
- ↑ a b Neil G. Connelly i inni, Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005 (Red Book), International Union of Pure and Applied Chemistry, RSC Publishing, 2005, s. 140, ISBN 978-0-85404-438-2 (ang.).
- ↑ a b Sulfuryl chloride, [w:] PubChem [online], United States National Library of Medicine, CID: 24648 [dostęp 2023-08-22] (ang.).
- ↑ a b c d e Haynes 2016 ↓, s. 4-88.
- ↑ a b c d e f Hans-Dietrich Lauss, Wilfried Steffens, Sulfur Halides, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, [cop. 2011], s. 8–9, DOI: 10.1002/14356007.a25_623 (ang.).
- ↑ a b c Sulfuryl chloride, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 1350 [dostęp 2023-09-23] (niem. • ang.).
- ↑ Haynes 2016 ↓, s. 4-132.
- ↑ Haynes 2016 ↓, s. 6-193.
- ↑ Haynes 2016 ↓, s. 15-19.
- ↑ Haynes 2016 ↓, s. 9-65.
- ↑ a b Chlorek sulfurylu [online], karta charakterystyki produktu Sigma-Aldrich, 3 października 2021, numer katalogowy: 320528 [dostęp 2023-09-23]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
Bibliografia
- CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, ISBN 978-1-4987-5429-3 (ang.).