Alkeny
Alkeny – organiczne związki chemiczne z grupy węglowodorów nienasyconych, w których występuje jedno podwójne wiązanie chemiczne między atomami węgla (C=C)[1]. Razem ze związkami, które posiadają dwa lub więcej wiązań podwójnych (polienami, takimi jak dieny, trieny itd.) oraz z analogami pierścieniowymi (cykloalkenami i cyklopolienami) tworzą grupę olefin[2]. Mają więcej izomerów i są bardziej aktywne niż alkany. Wraz ze zwiększającą się długością łańcucha węglowego maleje ich reaktywność. Można je otrzymać z ropy naftowej, a w laboratorium w reakcji eliminacji fluorowca z halogenków alkilowych lub przez dehydratację alkoholi. Ich wzór ogólny to C
nH
2n.
Nazewnictwo
Nazwy alkenów są tworzone z nazw odpowiednich alkanów. Z nazwy alkanu posiadającego ten sam szkielet węglowy usuwa się końcówkę -an i dodaje końcówkę -en, przed którą umieszcza się lokant, wskazujący przy którym atomie węgla występuje podwójne wiązanie. Na przykład:
Lokant można pominąć, gdy jest on równy 1 (wtedy, gdy wiązanie podwójne występuje na początku szkieletu węglowego).
Nazewnictwo dienów i polienów jest tworzone analogicznie z odpowiednio większą liczbą lokantów i końcówką -dien, -trien, -tetraen itd. Na przykład:
W literaturze spotyka się też nazewnictwo, które różni się od nomenklatury IUPAC tym, że lokanty występują przed nazwą. Przykładowo:
- 2-heksen; 1,3-butadien.
Izomeria
Alkeny o większej liczbie atomów węgla niż propen mogą istnieć w kilku formach izomerycznych na skutek rozgałęzienia łańcucha węglowego, zmiany umiejscowienia podwójnych wiązań chemicznych i występowaniu zjawiska izomerii geometrycznej. Eten i propen nie posiadają izomerów, a buten ma ich 4.
Otrzymywanie
Alkeny otrzymuje się poprzez eliminację cząstki nieorganicznej z halogenopochodnych alkanów (dehydrohalogenacja) lub alkoholi (dehydratacja), w krakingu, bądź reakcji uwodornienia alkinów.
- Dehydratacja alkoholi. Reakcję prowadzi się w podwyższonej temperaturze w obecności katalizatora kwasowego, np. tlenku glinu lub kwasu siarkowego[3]. W przypadku, gdy możliwe jest powstawanie różnych izomerów, produktem głównym jest ten, w którym wiązanie wielokrotne występuje między atomami węgla uboższymi w wodór[3] (reguła Zajcewa, obowiązuje także dla dehydrohalogenacji)[4].
- Deaminacja amin (eliminacja Hofmanna), w wyniku której otrzymuje się alkeny o położeniu wiązania podwójnego przeciwnie do reguły Zajcewa[5].
- Dehydrohalogenacja halogenoalkanów w środowisku zasadowym w podwyższonej temperaturze, np. wobec zasady potasowej[6].
- Reakcja wicynalnych (tj. zawierających atomy halogenu w pozycjach sąsiednich) dihalogenoalkanów z cynkiem[7].
- Otrzymywanie na skalę przemysłową z wykorzystaniem metody krakowania wyższych alkanów[8].
- W ropach naftowych występują w nieznacznych ilościach, toteż większość alkenów stosowanych w przemyśle pochodzi z przeróbki (krakingu niskociśnieniowego, tzw. olefinowego) różnych frakcji ropy, głównie benzyny ciężkiej.
Charakterystyczne reakcje
Alkeny są trwałymi związkami, które jednak są bardziej reaktywne od alkanów. Podlegają one m.in.: reakcjom polimeryzacji winylowej oraz reakcjom addycji np.: przyłączania gazowego chloru, chlorowodoru, wody.
Przykładowa reakcja addycji chloru do etenu:
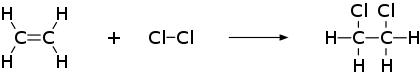
Alkeny o większej ilości wiązań podwójnych
Alkeny z dwoma podwójnymi wiązaniami to dieny. Alkeny z więcej niż dwoma wiązaniami podwójnymi (trieny, tetraeny itd.) są ogólnie nazywane polienami. Dieny można podzielić na:
- alleny zwane też dienami skumulowanymi, w których wiązania podwójne sąsiadują ze sobą,
- dieny sprzężone, w których wiązania podwójne oddzielone są jednym wiązaniem pojedynczym,
- dieny z izolowanym układem wiązań podwójnych, w których występują co najmniej 2 wiązania pojedyncze pomiędzy wiązaniami podwójnymi.
Zobacz też
Przypisy
- ↑ Alkeny, [w:] A.D. McNaught, A. Wilkinson, Compendium of Chemical Terminology (Gold Book), S.J. Chalk (akt.), International Union of Pure and Applied Chemistry, wyd. 2, Oxford: Blackwell Scientific Publications, 1997, DOI: 10.1351/goldbook.A00224, ISBN 0-9678550-9-8 (ang.).
- ↑ Olefins, [w:] A.D. McNaught, A. Wilkinson, Compendium of Chemical Terminology (Gold Book), S.J. Chalk (akt.), International Union of Pure and Applied Chemistry, wyd. 2, Oxford: Blackwell Scientific Publications, 1997, DOI: 10.1351/goldbook.O04281, ISBN 0-9678550-9-8 (ang.).
- ↑ a b Morrison i Boyd 1985 ↓, s. 211–222.
- ↑ Morrison i Boyd 1985 ↓, s. 559.
- ↑ Morrison i Boyd 1985 ↓, s. 849–851.
- ↑ Morrison i Boyd 1985 ↓, s. 199–203.
- ↑ Morrison i Boyd 1985 ↓, s. 199.
- ↑ Morrison i Boyd 1985 ↓, s. 197.
Bibliografia
- Robert T. Morrison, Robert N. Boyd, Chemia organiczna, t. 1, Warszawa: PWN, 1985, ISBN 83-01-04166-8.
