Triethylentetraminhexaessigsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
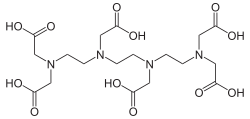
| Name | Triethylentetraminhexaessigsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C18H30N4O12 | ||||||||||||||||||
| Kurzbeschreibung |
weißer kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 494,45 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Triethylentetraminhexaessigsäure ist ein Komplexbildner aus der Gruppe der Amincarboxylate, der in der Komplexometrie zur Titration von Metallionen verwendet wird. Weiterhin wird er zur Komplexierung von radioaktiven Metallionen in der Radiotherapie mit Immunkonjugaten verwendet.[2] Analoga des TTHA sind z. B. EDTA und DTPA. Ein lipophiles Derivat ist Phenyl-TTHA.[3]
TTHA kann zur Molekülmarkierung über ein Alkylamin oder ein Maleimid an Proteine gekoppelt werden.[4][5] Durch die Kopplung wird das Zielmolekül hydrophiler.[2] In Verbindung mit manchen Lanthanoiden können lumineszente Kopplungsprodukte erzeugt werden.[6]
Literatur
- C. De Stefano, A. Gianguzza, D. Piazzese, S. Sammartano: Interactions of diethylenetriaminepentaacetic acid (dtpa) and triethylenetetraaminehexaacetic acid (ttha) with major components of natural waters. In: Analytical and bioanalytical chemistry. Band 375, Nummer 7, April 2003, S. 956–967, doi:10.1007/s00216-003-1790-8, PMID 12707767.
- M. I. Prata, M. J. Ribeiro, A. C. Santos, J. A. Peters, F. Nepveu, C. F. Geraldes, J. J. de Lima: In Vitro and In Vivo Behaviour of In Complexes of TTHA, TTHA-Bis(Butylamide) and TTHA-Bis(Glucamide): Stability, Biodistribution and Excretion Studied by Gamma Imaging. In: Metal-based drugs. Band 5, Nummer 5, 1998, S. 259–264, doi:10.1155/MBD.1998.259, PMID 18475854, PMC 2365140 (freier Volltext).
Einzelnachweise
- ↑ a b c d e Datenblatt Triethylenetetramine-N,N,N′,N′′,N′′′,N′′′-hexaacetic acid, for complexometry, ≥98.0% bei Sigma-Aldrich, abgerufen am 1. September 2016 (PDF).
- ↑ a b B. Achour, J. Costa, R. Delgado, E. Garrigues, C. F. Geraldes, N. Korber, F. Nepveu, M. I. Prata: Triethylenetetramine-N,N,N′,N′′,N′′′,N′′′-hexaacetic Acid (TTHA) and TTHA-Bis(butanamide) as Chelating Agents Relevant to Radiopharmaceutical Applications. In: Inorganic chemistry. Band 37, Nummer 11, Juni 1998, S. 2729–2740, PMID 11670409.
- ↑ S. G. Gouin, J. F. Gestin, L. Monrandeau, F. Segat-Dioury, J. C. Meslin, D. Deniaud: Synthesis and metal complexation properties of Ph-DTPA and Ph-TTHA: novel radionuclide chelating agents for use in nuclear medicine. In: Organic & biomolecular chemistry. Band 3, Nummer 3, Februar 2005, S. 454–461, doi:10.1039/b413758b, PMID 15678183.
- ↑ K. K. Bhargava, Z. Y. Zhang, C. J. Palestro, S. A. Acharya: Synthesis of aminobenzyltriethylenetetraaminohexaacetic acid: conjugation of the chelator to protein by an alkylamine linkage. In: Journal of protein chemistry. Band 18, Nummer 7, Oktober 1999, S. 761–770, PMID 10691186.
- ↑ M. S. Ali, S. M. Quadri: Maleimido derivatives of diethylenetriaminepentaacetic acid and triethylenetetraaminehexaacetic acid: their synthesis and potential for specific conjugation with biomolecules. In: Bioconjugate Chemistry. Band 7, Nummer 5, 1996 Sep-Oct, S. 576–583, doi:10.1021/bc960051e, PMID 8889020.
- ↑ L. N. Krasnoperov, S. A. Marras, M. Kozlov, L. Wirpsza, A. Mustaev: Luminescent probes for ultrasensitive detection of nucleic acids. In: Bioconjugate Chemistry. Band 21, Nummer 2, Februar 2010, S. 319–327, doi:10.1021/bc900403n, PMID 20085336, PMC 2839868 (freier Volltext).
