Tetraselmis
| Tetraselmis | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Tetraselmis cordiformis | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Tetraselmis | ||||||||||||
| F. Stein, 1878 |

Tetraselmis ist eine Gattung von Grünalgen des Phytoplanktons innerhalb der Ordnung Chlorodendrales, die sich durch ihre intensiv gefärbten grünen Chloroplasten, ihre begeißelten Zellkörper, das Vorhandensein eines Pyrenoids innerhalb des Chloroplasten und eine schuppenförmige Thecawand auszeichnet.[1][2] Arten dieser Gattung sind sowohl in marinen als auch in Süßwasser-Ökosystemen auf der ganzen Welt zu finden; ihr Verbreitungsgebiet ist aufgrund ihrer photosynthetischen Natur hauptsächlich durch die Wassertiefe begrenzt. Sie können daher nur in Wasserumgebungen leben, wo genügend Nährstoffe und Licht für die photosynthetische Nettoaktivität vorhanden sind.[1] Tetraselmis-Arten haben sich sowohl für die Forschung als auch für die Industrie als nützlich erwiesen. Sie wurden beispielsweise untersucht, um die Wachstumsraten von Plankton zu verstehen. Seit einiger Zeit wird auch eine kolonienbildende Art verwendet, um ein Einblicke in die Evolution der Vielzelligkeit zu erlangen.[1][3] Darüber hinaus werden viele Arten aufgrund ihres hohen Lipidgehalts auf ihre Verwendung als Produzenten von Biokraftstoffen untersucht.[4]
Forschungsgeschichte
Die Gattung wurde 1878 von Friedrich von Stein in seinem Werk Der Organismus der Infusionsthiere nach eigenen Forschungen in systematischer Reihenfolge bearbeitet. III. Abtheilung erstbeschrieben, Typusart ist Tetraselmis cordiformis.[5] Die Gattung Tetraselmis hat im Laufe der Jahre viele taxonomische Änderungen erfahren, vor allem aufgrund fortschrittlicherer Forschungstechniken, die den Wissenschaftlern bei der Klassifizierung geholfen haben. Viele Botaniker haben weiter zum Wissen um Tetraselmis beigetragen und viele Arten innerhalb der Gattung entdeckt. Einige bemerkenswerte Beiträger sind R. W. Butcher, T. Hori, R. E. Norris und M. Chihara.
Verbreitung und Ökologie
Tetraselmis-Arten kommen sowohl in marinen als auch in Süßwasser-Ökosystemen vor und besetzen Nischen als Primärproduzenten in benthischen und planktonischen Nahrungsnetzen.[1] Sie sind in vielen Gewässern der Welt zu finden; der wichtigste Faktor für die Ausbreitung ihres Lebensraums ist die Verfügbarkeit von Licht, das die Zellen auf die photische Zone der Wassersäule beschränkt. Die Primärproduzenten aquatischer Ökosysteme gehören meist zum einzelliges photosynthetisches Plankton, zu dem auch Tetraselmis gehört. Planktonische Photoautotrophe sind wichtige Bestandteile aquatischer Nahrungsnetze, da sie die erste trophische Ebene bilden. Die meisten Tetraselmis-Arten sind freilebend, einige Arten sind jedoch Symbionten innerhalb von Tieren. Marine Arten besiedeln einen Lebensraum oft schnell und dicht und verursachen so Planktonblüten in Küsten- und Buchtenbereichen. Tetraselmis ist eine besonders wichtige Gattung für die Untersuchung und das Verständnis der Dynamik der Wachstumsrate von Plankton.[1]
Morphologie
Äußere Erscheinungsform
Tetraselmis-Arten erscheinen grünlich, variieren aber stark in Zellgröße und -form. Die Zellen können rund, eiförmig, elliptisch, abgeflacht, zusammengedrückt sein oder eine Kombination dieser Formen. Die Seitenlängen variieren dabei im Bereich von 3,5–25 µm,[6] normalerweise etwa 10 µm lang × 14 µm breit.[7]
Tetraselmis-Zellen haben vier gleich lange Geißeln, die aus einer Vertiefung in der Nähe des Apex austreten. Bei den meisten Arten treten die Geißeln paarweise aus und ragen voneinander weg. Im Allgemeinen bewegen sich die einzelnen Zellen lange Zeit linear und ändern dann schnell die Richtung, ohne anzuhalten, wobei die Geißeln Kraft für die Bewegung durch die wässrige Umgebung erzeugen.[1] Siehe Abbildung 1 für allgemeine Merkmale der Geißeln und des Zellkörpers von Tetraselmis-Arten.[1]
Chloroplast, Pyrenoid, Augenfleck
Tetraselmis-Zellen haben einen einzigen großen Chloroplasten, normalerweise mit vier vorderen Loben (Lappen, en. lobes), der den größten Teil des Zytoplasma-Kompartiments einnimmt.[1] Einige Arten haben reduzierte oder keine Loben, und einige haben entwickelte hintere Loben. Wie bei anderen Grünalgenlinien haben die Thylakoide und Lamellen innerhalb des Chloroplasten keine festgelegte Anzahl oder Muster. Der Chloroplast enthält ein Pyrenoid, das von einer Stärkehülle umgeben ist. Daneben gibt es einen Augenfleck (Stigma).[1] Die Lage des Stigmas variiert von Art zu Art, hauptsächlich aufgrund der Zellgröße und -form. Das Stigma besteht aus zwei Schichten von Lipid-Granula, die durch ein einzelnes Thylakoid getrennt sind und parallel zur Chloroplastenmembran verlaufen. Stigmen sind eine Konzentration von Pigmentkörnchen, mit denen die Zelle Licht erkennt und sich so in der Wassersäule orientieren kann (Phototaxis). Sowohl das Pyrenoid als auch das Stigma können aufgrund ihrer zuverlässigen und inhärenten Positionierung in den Arten zur taxonomischen Klassifizierung verwendet werden.[1]
Zellkern
Der Zellkern liegt entweder zwischen den vorderen Loben des Chloroplasten parallel zum Pyrenoid, einige Arten haben vordere Kernloben (en. nuclear lobes) entwickelt. Der Kern kann auch zentral gelegen sein, parallel zum Geißelsäckchen (en. flagellar depression, s. u.) und (wieder) zum Pyrenoid. Im Kern bestimmter Arten kann auch „kondensiertes“ (en. condensed) Chromatin gesehen werden.[1]
Golgi-Apparat
Der Golgi-Apparat von Tetraselmis-Arten hat eine bestimmte Anzahl (normalerweise 2 bis 4) von Golgi-Körpern, bei manchen Arten gibt es auch 8 oder mehr haben.[ Auch dies ist ein zuverlässiges Merkmal zur taxonomischen Bestimmung der verschiedenen Tetraselmis-Spezies. Die Golgi-Körper liegen zwischen dem Chloroplasten und den Basalkörpern; „cis-Golgi“ sind dem Chloroplasten zugewandt und „trans-Golgi“ den Basalkörpern.[1]
Mitochondrien
Die Mitochondrien sind ohne Muster im Zytoplasma verteilt.[1]
Andere Bestandteile des Zytoplasmas
Das Zytoplasma kann zusätzliche Organellen und Makromoleküle wie Lipidtropfen, Vakuolen und Lysosomen enthalten.[2] Die von Tetraselmis produzierte Stärke ist chemisch die gleiche wie die von Landpflanzen.[1]
Theca, Geißelbasis, Haare
Die Theca der meisten Arten umschließt den Zellkörper eng, kann aber aufgrund von Unregelmäßigkeiten in der Zellform abgetrennt vorliegen. Die Theca sind in der Regel glatt, doch einige Arten haben ausgeprägte Falten entwickelt, die sich in der Nähe der Zellspitze senkrecht kreuzen und der Zelle den Anschein geben, in vier Längsabschnitte unterteilt zu sein. Andere Arten haben ein verdrehtes Zellhinterteil, eine Form, die sich in der erzeugten Thecawand widerspiegelt.[1]
Die einzige Öffnung (Pore oder Perforation) in der Thecawand ist dort, wo die Geißeln austreten, was als apikale Vertiefung (en. apical depression, auch flagellar depression, vgl. Geißelsäckchen) bezeichnet wird. Diese Öffnung ist ein langer Schlitz mit Thecalfortsätzen, die ihn begrenzen und sich nach oben erstreckend die Geißelbasis schützen. In Zellen, die ihre Geißeln verloren haben, wachsen diese Thecalfortsätze aufeinander zu um die Öffnung zu bedecken, aber sie verschmelzen nicht – nicht-motile (unbewegliche) Tetraselmis-Zellen haben Geißelstummel, die voll in diesem Geißelraum verbleiben.[1]
Zusätzlich haben viele Arten dicke lockige „Haare“, die an der Zellwand in der Nähe der Geißelbasis verankert sind. Die Haare sind quer gestreift und haben ein spiralförmiges Muster, das den Geißelhaaren ähnelt, aber sie sind dicker und länger als die Geißelhaare.[1]
Im Verlauf der Zellteilung beginnt die Produktion der Theca-Schuppen während der Prophase, und die Schuppen werden sofort nach Abschluss der Zytokinese und der Trennung der beiden Tochterzellen an die Zellmembran gebracht.[2] Die Fusion der Schuppen geschieht von außen und beginnt in der Nähe des hinteren Endes und erstreckt sich nach vorne zum vorderen Ende, wo sich zuletzt der Geißelspalt bildet.[1]
Geißeln
Jede Zelle hat vier gleich lange Geißeln, wobei die Geißeln kürzer sind als die Länge der Zelle. Die Geißeln treten paarweise aus der apikalen Vertiefung (bei der Geißelbasis) aus und zeigen in entgegengesetzte Richtungen, wobei sie parallel zur Längsseite der Zelle verlaufen. Bei den Arten, wo die Geißeln aus einer tiefen Senke austreten, ist die mechanische Kraft, die die Geißeln erzeugen können, begrenzt. Andere Linien mit nicht vertieften Geißelansätzen können höhere Geißelkräfte erzeugen. Die Geißeln der Tetraselmis-Arten sind dick, mit schleimigem Material (en. mucilaginous material) bedeckt und haben ein stumpfes Ende. Die Zellen sind außerdem mit Geißelhaaren bedeckt, die lose an der Außenseite angebracht sind; sie sind kreuzgestreift mit zwei Schuppenschichten auf den Geißeln.[1]
Lebensstadien

Tetraselmis-Arten haben drei Lebensstadien:[1]
- ein begeißeltes Stadium
- ein vegetatives nicht-motiles (unbewegliches) Stadium und
- ein Zystenstadium
Das vegetative nicht-motile Stadium ist das dominante Lebensstadium der meisten Arten.[1] Der einzige strukturelle Unterschied zwischen dem gegeißelten und dem vegetativen Stadium ist die Anzahl der Schuppenschichten in der Thecawand: das gegeißelte Stadium hat immer nur eine Schicht, während das vegetative Stadium zwei oder mehr hat. Die Zellen im Zystenstadium verlieren ihre Geißeln (Flagellen) und werden daher als ‚aflagellat‘ bezeichnet; dabei produzieren sie eine dicke Thecaschale zum Schutz. Unter geeigneten Bedingungen kann in jedem der beiden unbegeißelten Stadien eine vollständige Transformation durchlaufen werden und die für die vollständige Beweglichkeit nötigen Geißeln entwickelt werden.[1]
Die Tetraselmis-Arten unterziehen einer Zellteilung (in zwei Tochterzellen) während des unbeweglichen Stadiums. Die meisten Arten durchlaufen dabei immer nur einen Teilungszyklus (nicht mehrere direkt hintereinander). Während der Zellteilung teilen sich die Organellen synchron direkt vor der Kernteilung. Die Zellteilung wird durch ein Phycoplast unterstützt. Das ist eine Mikrotubuli-Struktur, die der Zelle bei der Teilung der Kerne in jede Tochterzelle hilft. Die Tochterzellen können sich dann zu gegeißelten Zellen entwickeln oder unbeweglich bleiben, abhängig von den Umgebungsbedingungen. Zusätzlich sind vegetative Zellen, ob gegeißelt oder unbeweglich, durch vier Mikrotubuli-Kontaktpunkte an der Zellwand verankert.[1]
Bedeutung
Tetraselmis-Arten sind von Bedeutung für die zellbiologische Forschung, für die Untersuchung von Plankton-Wachstumszyklen, und sie könnten in Zukunft für die Produktion von Biokraftstoffen von Nutzen sein.
Evolution der Vielzelligkeit
Die Spezies T. indica wird beispielsweise verwendet, um zu untersuchen, wie asymmetrische Zellteilung während der Mitose zu klonaler Zellheterogenität führt, d. h. phänotypisch unterschiedliche Zellen trotz gleichen Gene (genotypischer Identität, Klon).[8][3] Diese Spezies bildet eine klonale Kolonie, in der die Zellen morphologisch und ultrastrukturell unterschiedlich sind, und viele Zellen spezialisieren und entwickeln unabhängige physikalische Eigenschaften. Die asymmetrische Teilung der Tochterzellen führt zu einer ungleichen Teilung von Zytoplasma und Nukleoplasma. Man glaubt, dass dieses Phänomen es den Klonen ermöglicht, ‚Subpopulationen‘ zu bilden, die nahe beieinander bleiben, in denen die Zellen miteinander kooperieren und als eine große Population agieren. Diese asymmetrische eukaryotische Zellteilung spielt eine wichtige Rolle bei der Produktion von phänotypisch vielfältigen Zellen in multizellulären Systemen. Dies ist von entscheidender Bedeutung für multizelluläre Organismen (mit Aufgabenteilung), einschließlich des Menschen.[3] Näheres siehe auch Entwicklung von Einzellern zu Vielzellern.
Biotechnologie
Tetraselmis und andere Mikroalgenarten werden als Nahrung in der Aquakultur und für biotechnologische Zwecke verwendet. Mikroalgen wie die Tetraselmis-Arten sind eine vielversprechende Quelle für die Verwendung als Biokraftstoff aufgrund ihrer schnellen Wachstumsrate, ihres hohen Lipidgehalts, ihrer kostengünstigen Photosynthese, ihres geringeren Bedarfs an landwirtschaftlichen Flächen, ihrer nützlichen Nebenprodukte und weil sie umweltfreundlich sind. Derzeit wird an spezifischen Mikroalgenarten für die Verwendung als Biokraftstoff geforscht.[4]
Krebstherapie
T. suecica EPS habt antioxidative Aktivität und zytotoxische Effekte auf Tumorzellen; daher könnten sie größere Vorteile als mögliche natürliche „Nutraceuticals“ für die pharmazeutische Industrie bieten (Antioxidative Therapie).[9]
Arten
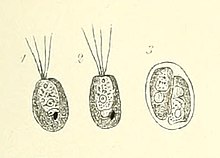

Gattung Tetraselmis Stein, 1878[10][11][12]
- T. alacris Butcher
- T. apiculata (Butcher) Butcher
- T. ascus (Proskauer) R. E. Norris, Hori & Chihara
- T. astigmatica R. E. Norris & Hori
- T. chui Butcher[13]
- T. convolutae Parke & Manton
- T. cordiformis (N. Carter) S. F. N. Stein (Typus: Holotyp-Spezies)
- T. desikacharyi Matin, Hoef-Emden & Melkonian
- T. gracilis (Kylin) Butcher
- T. hazeni Butcher
- T. impellucida (McLachlan & Parke) Norris, Hori & Chihara
- T. inconspicua Butcher
- T. levis Butcher
- T. maculata Butcher
- T. marina (Cienkowski) R. E. Norris, Hori & Chihara
- T. micropapillata (Ålvik) Butcher
- T. rubens Butcher
- T. striata Butcher
- T. subcordiformis (Wille) Butcher (syn. Carteria subcordiformis Wille)
- T. suecica (Kylin) Butcher — zur Beeinflussung des Wachstums durch Bakterien siehe Biondi et al. (2018)[14]
- „T. tetrabrachia“ inedit.[15]
- T. tetrathele (West) Bucher (syn. Platymonas tetrathele G. S. West)
- T. verrucosa Butcher
- T. wettsteinii (Schiller) Throndsen (syn. Carteria wettsteinii J. Schiller)
Fressfeinde, Opfer von Kleptoplastidie

Das marine Wimpertierchen Strombidium rassoulzadegani (Oligotrichia) ernährt sich von der Alge Tetraselmis chui (PLY 429). Es behält die Chloroplasten aus seiner Nahrung und nutzt sie, um aus ihrer Photosynthese eine Nahrungsergänzung zu erhalten, betreibt also Kleptoplastidie.[13][16]
Symbiosen
T. convolutae ist ein Symbiont der wurmähnlichen Symsagittifera roscoffensis (Gattungs-Alias Convoluta, Fam. Convolutidae, Acoela), kann aber auch frei im Ozean leben.[7][16]
Viren



Mitglieder der Gattung Tetraselmis werden parasitiert von (bzw. sind assoziiert mit) folgenden dsDNA-Viren mit Kandidatenstatus:
- Spezies Tetraselmis-Virus 1 (TetV-1, wissenschaftlich Oceanusvirus kaneohense),[19] einer im April 2023 offiziell bestätigten Spezies aus dem Phylum Nucleocytoviricota (NCLDV). Diese gehört zu einer Reihe von Riesenviren, die man zunächst als den Phycodnaviridae (Ordnung Algaevirales) zugehörig glaubte, die aber eher den Mimiviridae nahestehen und daher inzwischen in die gemeinsame Ordnung Imitervirales klassifiziert werden und dort zusammen mit Pyramimonas-orientalis-Virus 01B (PoV-01B) die Familie Allomimiviridae (frühere provisorische Bezeichnung Tetraselmisviruses ‚Tetraselmisviren‘ oder Tetraselmisvirus-Gruppe) bilden.[20][21][17]
- Spezies „Tetraselmis viridis virus N1“ (alias „Tetraselmis striata virus N1“, TsV-N1, ein Polinton-like virus/PLV mit einem 31 kBp Genom und Vriondurchmesser 60 nm)[22][18][23]
- Spezies „Tetraselmis viridis virus S1“ (alias „Tetraselmis striata virus“)[24][25][26] – Polinton-like virus: möglicher Virophage
- Spezies „Tetraselmis viridis virus S20“ (TvV-S20)[27][28][29][30] – Klasse Caudoviricetes, Morphotyp Siphoviren. TvV-S20 könnte ein echter Bakteriophage sein, der mit Bakterien in Co-Kultur Algen-assoziiert ist.[25]
- Spezies „Tetraselmis viridis virus SI1“ (TvV-SI1)[31][29][32] – Klasse Caudoviricetes, Morphotyp Siphoviren.
Hinweis: Auch wenn die (vorläufige) Namensgebung dies suggeriert, müssen diese Viren nicht notwendig Tetraselmis-Parasiten sein. Es kann sich auch um Bakteriophagen (Bakterienviren) handeln, wenn ihre Bakterienwirte symbiotisch bzw. parasitär in Tetraselmis leben, oder um Virophagen, deren Helferviren Tetraselmis (oder endosymbiotische Bakterien) infizieren (d. h. Tetraselmis-assoziierte Viren). Die endgültige Klärung des Status im Einzelfall erfordert weitere Forschung.
Einzelnachweise
- ↑ a b c d e f g h i j k l m n o p q r s t u v Richard E. Norris, Terumitsu Hori, Mitsuo Chihara: Revision of the Genus Tetraselmis (Class Prasinophyceae), in: Bot. Mag. Tokyo, Band 93, S. 317–339, Dezember 1980, doi:10.1007/BF02488737
- ↑ a b Burkhard Becker, Birger Marin, M. Melkonian: Structure, composition, and biogenesis of prasinophyte cell coverings, in: Protoplasma, Band 181, Nr. 1, S. 233–244, doi:10.1007/BF01666398
- ↑ a b c Mani Arora, Arga Chandrashekar Anil, Karl Burgess, Jane Delany, Ehsan Mesbahi: Asymmetric cell division and its role in cell fate determination in the green alga Tetraselmis indica. In: J. Biosci. Band 40, S. 921–927, 4. Dezember 2015, doi:10.1007/s12038-015-9576-7
- ↑ a b Mercedes Alonso, Fátima C. Lago, Juan M. Vieites, Montserrat Espiñeira: Molecular characterization of microalgae used in aquaculture with biotechnology potential, in: Aquacult. Inter., Band 20, S. 847–857, 14. Februar 2012, doi:10.1007/s10499-012-9506-8
- ↑ Friedrich Ritter von Stein: Der Organismus der Infusionsthiere nach eigenen Forschungen in systematischer Reihenfolge bearbeitet. III. Abtheilung. Die Naturgeschichte der Flagellaten oder Geisselinfusorien. I. Hälfte, Den noch nicht abgeschlossenen allgemeinen Theil nebst Erklärung der sämmtlichen Abbildungen enthaltend S. 1–154, pls I-XXIV. Leipzig: Verlag von Wilhelm Engelmann, 1878. WorldCat, BHL
- ↑ Mani Arora, Arga Chandrashekar Anil, Frederik Leliaer, Jane Delany, Ehsan Mesbahi: Tetraselmis indica (Chlorodendrophyceae, Chlorophyta), a new species isolated from salt pans in Goa, India, in: European Journal of Phycology. Band 48, S. 61–78, 13. März 2013, doi:10.1080/09670262.2013.768357
- ↑ a b Henrike Semmler, Xavier Bailly, Andreas Wanninger: Myogenesis in the basal bilaterian Symsagittifera roscoffensis (Acoela). In: Frontiers in Zoology. 5. Jahrgang, September 2008, S. 14, doi:10.1186/1742-9994-5-14, PMID 18803837, PMC 2562460 (freier Volltext) – (englisch).
- ↑ Daniel Stockholm et al.: The Origin of Phenotypic Heterogeneity in a Clonal Cell Population In Vitro, in: PLOS ONE, 25. April 2007, doi:10.1371/journal.pone.0000394
- ↑ Geovanna Parra-Riofrío, Jorge García-Márquez, Virginia Casas-Arrojo, Eduardo Uribe-Tapia, Roberto Teófilo Abdala-Díaz: Antioxidant and Cytotoxic Effects on Tumor Cells of Exopolysaccharides from Tetraselmis suecica (Kylin) Butcher Grown Under Autotrophic and Heterotrophic Conditions. In: MDPI Marine Drugs, Special Issue Sulfur-Containing Marine Bioactives. 18. Jahrgang, Nr. 11, 26. Oktober 2020, S. 534, doi:10.3390/md18110534, PMID 33114784, PMC 7693365 (freier Volltext) – (englisch).
- ↑ AlgaeBase: Tetraselmis F. Stein, 1878
- ↑ WoRMS: Tetraselmis F. Stein, 1878
- ↑ NCBI: Tetraselmis F.Stein (genus); graphisch: Tetraselmis, auf: Lifemap, NCBI Version.
- ↑ a b c George B. McManus, Weiwei Liu, Rachel A. Cole, Daniel Biemesderfer, Jennifer L. Mydosh: Strombidium rassoulzadegani: A Model Species for Chloroplast Retention in Oligotrich Ciliates, in: Front. Mar. Sci., 12. Juni 2018, doi:10.3389/fmars.2018.00205
- ↑ Natascia Biondi, Giulia Cheloni, Liliana Rodolfi, Carlo Viti, Luciana Giovannetti, Mario Tredici: Tetraselmis suecica F&M-M33 growth is influenced by its associated bacteria, in: Microbial Biotechnology, Band 11, Nr. 1, Januar 2018, S. 211–223, doi:10.1111/1751-7915.12865
- ↑ Tetraselmis tetrabrachia Product Code: CCAP 66/33. Culture Collection of algae & protozoa (CCAP).
- ↑ a b Wilfried Probst: Frühe Evolution und Symbiose, Europa-Universität Flensburg, Institut für Biologie und Sachunterricht und ihre Didaktik. Hier: §Pflanzentiere und Kleptoplasten
- ↑ a b
Christopher R. Schvarcz, Grieg F. Steward: A giant virus infecting green algae encodes key fermentation genes. In: Virology, Band 518, Mai 2018, S. 423–433, doi:10.1016/j.virol.2018.03.010.
Vincent Racaniello: Fermentation genes in a giant algal virus. virology blog, 12. April 2018. - ↑ a b c António Pagarete, Théophile Grébert, Olga Stepanova, Ruth-Anne Sandaa, Gunnar Bratbak: TsV-N1: A Novel DNA Algal Virus that Infects Tetraselmis striata, in: MDPI Viruses, Band 7, Nr. 7, Section Viruses of Plants, Fungi and Protozoa, 17. Juli 2015, S. 3937–3953, doi:10.3390/v7072806
- ↑ NCBI: Tetraselmis virus 1 (species)
- ↑ Frederik Schulz, Simon Roux, David Paez-Espino, Sean Jungbluth, David A. Walsh, Vincent J. Denef, Katherine D. McMahon, Konstantinos T. Konstantinidis, Emiley A. Eloe-Fadrosh, Nikos C. Kyrpides, Tanja Woyke: Giant virus diversity and host interactions through global metagenomics. In: Nature Band 578, S. 432–436, 22. Januar 2020, doi:10.1038/s41586-020-1957-x, insbes. Fig. 1
- ↑ Christoph M. Deeg, Cheryl-Emiliane T. Chow, Curtis A. Suttle: The kinetoplastid-infecting Bodo saltans virus (BsV), a window into the most abundant giant viruses in the sea… In: eLife Sciences, 7, März 2018, doi:10.7554/eLife.33014, ResearchGate
- ↑ NCBI: Tetraselmis viridis virus N1 (species)
- ↑ Christopher M. Bellas, Ruben Sommaruga: Polinton-like viruses are abundant in aquatic ecosystems. In: BMC: Microbiome, Band 9, Nr. 13, 12. Januar 2021; doi:10.1186/s40168-020-00956-0. Dazu: Polinton-like viruses and virophages are widespread in aquatic ecosystems, auf: CSH bioRxiv vom 13. Dezember 2019 (PrePrint).
- ↑ NCBI: Tetraselmis viridis virus S1 (species), NC_020869.1
- ↑ a b Darius Kazlauskas, Mart Krupovic, Česlovas Venclovas: The logic of DNA replication in double-stranded DNA viruses: insights from global analysis of viral genomes, in: Nucleic Acids Research, Band 44, Nr. 10, 2. Juni 2016, S. 4551–4564, doi:10.1093/nar/gkw322
- ↑ Christopher M. Bellas, Ruben Sommaruga: Polinton-like viruses are abundant in aquatic ecosystems, in: Microbiome, Band 9, Nr. 13, 12. Januar 2021, doi:10.1186/s40168-020-00956-0
- ↑ NCBI: Tetraselmis viridis virus S20 (species)
- ↑ O. A. Stepanova, Ye. V. Solovyova, A. V. Solovyov: Results of algae viruses search in human clinical material, in: Ukrainica Bioorganica Acta 2, 19. Oktober 2011, S. 53—56
- ↑ a b O. A. Stepanova, A. L. Boĭko, I. S. Shcherbatenko: Computational genome analysis of three marine algoviruses, in: Mikrobiol Z., Band 75, Nr. 5, September-Oktober 2013, S. 76–81, PMID 24479317
- ↑ Deyvid Emanuel Amgarten: Análise computacional da diversidade viral presente na comunidade microbiana do processo de compostagem do Zoológico de São Paulo, Dissertation an der Universidade de São Paulo, Oktober 2016 (portugiesisch)
- ↑ NCBI: Tetraselmis viridis virus SI1 (species)
- ↑ Lanlan Cai, Rui Zhang, Ying He, Xiaoyuan Feng, Nianzhi Jiao: Metagenomic Analysis of Virioplankton of the Subtropical Jiulong River Estuary, China, in: MDPI Viruses, Band 8, Nr. 2, 2. Februar 2016, Special Issue Next Generation Sequencing: New Developments and Discoveries in Virology, 35, doi:10.3390/v8020035
