Tetraisopropylorthotitanat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetraisopropylorthotitanat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C12H28O4Ti | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 284,22 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
löslich in wasserfreiem Ethanol, Diethylether, Benzol, Chloroform, hydrolysiert in Wasser[3] | |||||||||||||||
| Brechungsindex |
1,4640 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Tetraisopropylorthotitanat oder Tetraisopropyltitanat, abgekürzt TIPT oder auch englisch TTIP (titanium tetraisopropoxide), ist formal der Tetraisopropylester der hypothetischen Orthotitansäure (H4TiO4). TIPT ist als Lewis-Säure ein wichtiger Katalysator für Veresterungs- und Umesterungs-reaktionen und für Sharpless-Epoxidierungen und ist Ausgangsmaterial für ultradünne Titandioxid-Schichten und -Nanopartikel.
Herstellung
Die Gleichgewichtsreaktion von Titantetrachlorid mit trockenem Isopropanol führt unter Entwicklung von Chlorwasserstoff zu Tetraisopropyltitanat Ti(OCHMe2)4.[7] Zur Unterdrückung der Rückreaktion wird das HCl-Gas mit Ammoniak gebunden und das entstandene Ammoniumchlorid (NH4Cl) abfiltriert.
In n-Heptan als Reaktionsmedium und durch kurzes Erhitzen unter Rückfluss bilden sich größere NH4Cl-Kristalle, die leichter abfiltriert werden können. Nach Vakuumdestillation wird praktisch chloridfreies (0,020 %) TIPT in 89%iger Ausbeute erhalten.[4]
Eigenschaften
Reines Tetraisopropylorthotitanat ist oberhalb der Raumtemperatur eine klare, neutrale (pH 7), farblose bis schwach gelbe, nach Isopropanol riechende Flüssigkeit.[6] Die technisch reine Substanz enthält wenige Gewichtsprozent Isopropanol, die den Erstarrungspunkt absenken und so die Handhabung des TIPT erleichtern. Im Gegensatz zu anderen Titansäureestern liegt die Verbindung in nichtpolaren Lösungsmitteln in monomerer Form vor. Die Substanz ist feuchtigkeitsempfindlich und hydrolysiert in Wasser rasch in exothermer Reaktion zu Titandioxid und Isopropanol.
Anwendungen
Katalysator für Veresterungen
Direkte Veresterungen
Tetraisopropyltitanat eignet sich als neutrale Verbindung für direkte Veresterungen von Carbonsäuren mit Alkoholen unter Wasserabspaltung und wird großtechnisch bei der Synthese von Estern eingesetzt, die als Weichmacher für Polyvinylchlorid (PVC) Verwendung finden.[8]
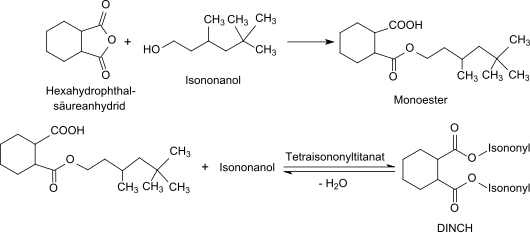
Titanisopropoxid reagiert in einer Umesterungsreaktion rasch mit freien höheren Alkoholen oder Glycolen zu den entsprechenden Orthotitanaten – im Beispiel mit dem Isononanol Trimethyl-3,5,5-hexanol zu Tetra-isononyltitanat – und freiwerdendes Isopropanol wird abdestilliert.

Die gebildete Lewis-Säure überträgt den Isononanolrest unter Esterbildung auf die Carboxygruppe des Monoesters zu 1,2-Cyclohexandicarbonsäurediisononylester (DINCH) und reagiert mit freiem Alkohol zurück zum Tetraisononyltitanat.
Im Gegensatz zu sauren und basischen Veresterungskatalysatoren werden unter Titanatkatalyse deutlich weniger gefärbte Nebenprodukte gebildet, weshalb zur Gleichgewichtsverschiebung auch größere Alkoholüberschüsse (bis 25 %) genutzt werden können. Hoher Umsatz und Produktreinheit erübrigen die bei Veresterungen meist erforderlichen Neutralisations- und Waschschritte.[9] Üblicherweise werden Tetraisopropyltitanat-Konzentrationen von lediglich 0,05 bis 0,2 %, bezogen auf das Esterprodukt, benötigt.
Umesterungen
Bei Umesterungen mit Tetraisopropyltitanat katalysiert das wie bei Veresterungen zunächst gebildete Tetraalkylorthotitanat den Austausch der Alkoxygruppe des Ausgangsesters mit dem des Alkohols
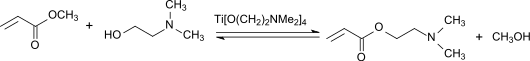
Wegen der geringen Neigung zu Nebenreaktionen beim Einsatz von Titanat-Umesterungskatalysatoren können auch leicht polymerisierbare Ester, wie z. B. Methylacrylat H2C=CH-COOCH3, mit funktionellen Alkoholen, wie z. B. Aminoalkohole wie Dimethylaminoethanol HO-(CH2)2-N(CH3)2 mit Ausbeuten bis 98 % hergestellt werden.[10] Auch Ester mit säureempfindlichen Gruppen, wie z. B. Acetale oder Ketale (Beispiel: Dimethyl-2,3-O-isopropylidentartrat) können mit TIPT als Katalysator glatt umgeestert werden.

Die Ausbeute beträgt dabei 91 bis 95 %.[5] Auf diese Weise können auch Umesterungen in Gegenwart von Alkin- und Nitrilgruppen, β-Lactamen, Trimethylsilylgruppen, sowie Boc- und anderen Carbamatschutzgruppen schonend und effizient durchgeführt werden.
Polykondensation
Auch bei der heute weitgehend durch das Verfahren der Direktveresterung von Terephthalsäure mit Ethylenglycol ersetzten Umesterung von Dimethylterephthalat mit Ethylenglycol zu Polyethylenterephthalat PET spielte Titanisopropoxid als Bestandteil von Katalysatorsystemen zusammen mit Antimontrioxid eine Rolle.[11]

Bei der Direktveresterung von Terephthalsäure mit Ethylenglycol und anschließender Polykondensation kann bei Einsatz von Tetraisopropyltitanat die Menge des üblicherweise verwendeten Antimontrioxids reduziert und sogar eliminiert und PET mit für Fasern, Folien und Getränkeflaschen geeigneten mechanischen und optischen Eigenschaften erhalten werden.[12]
Katalysator für die Ziegler-Natta-Polymerisation
Die so genannten Phillips-Katalysatoren der zweiten Generation zur Polymerisation von Ethen und Propen bestehen aus Magnesium-Titan-Verbindungen und Triethylaluminium als Cokatalysator. Die Titankomponente wird oft über Titanisopropoxid eingeführt.[13] Die Katalysatorsysteme sind deutlich (10- bis 100-mal) aktiver als die Katalysatoren der ersten Generation und können daher im Produkt verbleiben. Sie ermöglichen die Herstellung von linearem Polyethylen niedriger Dichte (linear low- density polyethylene, LLDPE) und von Polyethylen hoher Dichte (high-density polyethylene, HDPE) mit enger Molmassenverteilung.[14][15]
Katalysator für Sharpless-Epoxidierungen
In Gegenwart von Tetraisopropyltitanat und (+)- oder (−)-Weinsäurediethylester in Dichlormethan bei −70 bis −20 °C werden achirale primäre Allylalkohole enantioselektiv epoxidiert.[16][17] Ein klassisches Beispiel ist die Epoxidierung von Geraniol mit tert-Butylhydroperoxid zum Geraniol-2,3-oxid in sehr hoher chemischer Ausbeute und hohem Enantiomerenüberschuss

Die ausgeprägte Neigung der Orthotitanate zur Reaktion mit den aktiven Wasserstoffatomen von Hydroxy-, Amino-, Amido-, Carboxyl- und Thiolgruppen unter Vernetzung und Ausbildung dünner amorpher TiO2-Schichten lässt sich in vielfältiger Weise zu Modifizierungen von Glas-, Metall- und Polymeroberflächen, wie z. B. als Haftvermittler (primer) zur Erhöhung der Adhäsion, der Härte sowie der Abrieb- und Kratzfestigkeit, der thermischen und chemischen Beständigkeit, der Lichtreflexion und der Korrosionsbeständigkeit.[18]
Solche Beschichtungen erhöhen auch die Dispergierbarkeit von Pigmenten und Füllern in wasserbasierten oder nicht-wässrigen Lacken und Anstrichen und reduzieren deren Viskosität. Andererseits kann durch Vernetzung von hydroxygruppenhaltigen Polymeren in Lacken mit Titanisopropoxid die Viskosität auch erhöht, die Thixotropie von Latexfarben eingestellt und ihre Adhäsion an Oberflächen verbessert werden. Die Vernetzungseigenschaften von Tetraisopropyltitanat machen es zu einem wirksamen Additiv bei der Papierherstellung zur Erhöhung der Nassstärke, bei Ölbohrhilfsmitteln zur Viskositätssteuerung und in Druckfarben zur Verbesserung der Haftung.
Titandioxidpartikel und -filme
Durch sorgfältig gesteuerte hydrolytische Sol-Gel-Prozesse oder durch pyrolytische Prozesse bei Temperaturen über 350 °C lassen sich aus Titanisopropoxid neben dünnen polymeren TiO2-Filmen auch mikro- und nanoskalige TiO2-Partikel erzeugen.[19] Diese Partikel haben wegen ihres hohen Brechungsindex und UV-Absorption interessante Potentiale als Photokatalysatoren, in der Photovoltaik sowie für Anwendungen in Beleuchtungen und Beschilderungen.
Metalltitanate
Tetraisopropyltitanat bildet mit Carbonsäuren, wie z. B. Essigsäure nicht-stöchiometrische oligomere Titanacylate der ungefähren Zusammensetzung Ti(OOCMe)2(OCHMe2)2,[20] die mit Erdalkalimetallcarbonaten zu den entsprechenden Erdalkalimetalltitanaten reagieren, die wegen ihrer ferroelektrischen Eigenschaften für den Aufbau von mehrschichtigen keramischen Kondensatoren und Thermistoren von Interesse sind.[21]
Hersteller
Die früheren Hersteller DuPont und Johnson Matthey verkauften ihre Geschäfte und Warenzeichen für Orthotitanate im Jahr 2010 [Tyzor TPT (DuPont) und VERTEC TIPT (Johnson Matthey) für Tetraisopropyltitanat] an Dorf Ketal Chemicals (India) Pvt. Ltd.[22][23] Nach Einstellung der Produktion der Johnson Matthey in Billingham, UK im Jahr 2011 wird Tetraisopropyltitanat in großtechnischen Volumina nur noch in Indien (Dorf Ketal) und China (Borica Co., Ltd. aus Taiwan unter dem Warenzeichen TytanTM TIPT) produziert.
Literatur
- D.E. Putzig, J.R. Moncarz: Titanium Compounds, Organicin Kirk-Othmer Encyclopedia of Chemical Technology. 2005, doi:10.1002/0471238961.1518070116212026.a01.pub2.
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu Titantetraisopropanolat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c Datenblatt Titanium(IV) isopropoxide bei Sigma-Aldrich, abgerufen am 20. Februar 2015 (PDF).
- ↑ a b c d Datenblatt Titanium(IV) isopropoxide bei Alfa Aesar, abgerufen am 20. Februar 2015 (Seite nicht mehr abrufbar).
- ↑ a b Patent US3119852: Preparation of organic titanates. Angemeldet am 11. August 1960, veröffentlicht am 28. Januar 1964, Anmelder: E.I. du Pont de Nemours & Co., Erfinder: R.T. Gilsdorf.
- ↑ a b René Imwinkelried, Martin Schiess, Dieter Seebach: Diisopropyl (2S, 3S)-2,3-O-isopropylidenetartrate In: Organic Syntheses. 65, 1987, S. 230, doi:10.15227/orgsyn.065.0230; Coll. Vol. 8, 1993, S. 201 (PDF).
- ↑ a b Datenblatt Titanium(IV) isopropoxide bei Fisher Scientific, abgerufen am 25. Mai 2017 (PDF).
- ↑ Patent US2187821: Preparation of titanium alcoholates and phenolates. Angemeldet am 2. März 1937, veröffentlicht am 23. Januar 1940, Anmelder: I.G. Farbenindustrie AG, Erfinder: J. Nelles.
- ↑ Patent WO2006136471A1: Gemisch von Diisononylestern der 1,2-Cyclohexandicarbonsäure, Verfahren zu deren Herstellung und Verwendung dieser Gemische. Angemeldet am 27. April 2006, veröffentlicht am 28. Dezember 2006, Anmelder: Oxeno Olefinchemie GmbH, Erfinder: M. Grass, A. Lang.
- ↑ Johnson Matthey-Broschüre: Johnson Matthey Catalysts: VERTEC® – Direct Esterification Technology, PDF ( vom 6. März 2007 im Internet Archive)
- ↑ Patent DE10127939A1: Verfahren zur Herstellung von (Meth)acrylsäureestern. Angemeldet am 8. Juni 2001, veröffentlicht am 29. Mai 2002, Anmelder: BASF AG, Erfinder: M. Geissendörfer, A. Dams, G. Nestler.
- ↑ Patent US4356299: Catalyst system for a polyethylene terephthalate polycondensation. Angemeldet am 4. Februar 1982, veröffentlicht am 26. Oktober 1982, Anmelder: Rohm and Haas Co., Erfinder: M.S. Cholod, N.M. Shah.
- ↑ Johnson Matthey Catalysts, VERTEC Polyester Catalyst technology for PET fibre, 2003, PDF ( vom 6. März 2007 im Internet Archive)
- ↑ Patent US4452914: Titanium complexes and catalysts prepared therefrom. Angemeldet am 13. August 1982, veröffentlicht am 4. Juni 1984, Anmelder: The Dow Chemical Co., Erfinder: W.M. Coleman III, M.S. Edmonson.
- ↑ T.E. Nowlin, R.I. Mink, Y.V. Kissin: Supported Magnesium/Titanium-Based Ziegler Catalysts for Production of Polyethylene. Hrsg.: R. Hoff, R.T. Mathers. Wiley & Sons, Inc., 2010, ISBN 978-0-470-13798-7, S. 131–156.
- ↑ D.B. Malpass: Introduction to Industrial Polyethylene: Properties, Catalysts, and Processes. Scrivener Publishing LLC, 2010, ISBN 978-0-470-62598-9.
- ↑ T. Katsuki, K.B. Sharpless: The first practical method for asymmetric epoxidation. In: J. Am. Chem. Soc. Band 102, Nr. 18, 1980, S. 5974–5976, doi:10.1021/ja00538a077.
- ↑ J. Gordon Hill, K. Barry Sharpless, Christopher M. Exon, and Ronald Regenye: Enantioselective epoxidation of allylic alcohols: (2S,3S)-3-propyloxiranemethanol In: Organic Syntheses. 63, 1985, S. 66, doi:10.15227/orgsyn.063.0066; Coll. Vol. 7, 1990, S. 461 (PDF).
- ↑ DuPontTM TyzorR Organic Titanates: General Brochure, PDF ( vom 29. Juni 2015 im Internet Archive)
- ↑ Patent US7943116: High-yield synthesis of brookite TiO2 nanoparticles. Angemeldet am 24. Januar 2008, veröffentlicht am 17. Mai 2011, Anmelder: Sandia Corp., Erfinder: D.L. Huber, T.C. Monson.
- ↑ D.P. Birnie III, N.J. Bendzkob: 1H and 13C NMR observation of the reaction of acetic acid with titanium isopropoxide. In: Mater. Chem. Phys. Band 59, Nr. 1, 1999, S. 26–35, doi:10.1016/S0254-0584(99)00021-8.
- ↑ Patent US4670243: Method of precipitating metal titanate powders. Angemeldet am 30. Juni 1986, veröffentlicht am 2. Juni 1987, Anmelder: Ferro Corp., Erfinder: J.M. Wilson, D.L. Coller, S. Venkataramani.
- ↑ DORF KETAL ACQUIRES DUPONT CHEMICALS AND FLUOROPRODUCTS SPECIALITY CATALYSTS BUSINESS, PDF
- ↑ Johnson Matthey Announces Divestment of its Vertec Business ( vom 27. Februar 2015 im Internet Archive)



![{\displaystyle \mathrm {TiCl_{4}+4(CH_{3})_{2}CHOH{\xrightarrow[{-NH_{4}Cl}]{+NH_{3}}}Ti[OCH(CH_{3})_{2}]_{4}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e259838b6f019dee284d532a502a0aa30d4d6e9e)