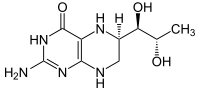
Sapropterin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Freiname | Sapropterin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C9H15N5O3 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Arzneistoffangaben | |||||||||||||
| ATC-Code | |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 241,25 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
gut in Wasser (25 g·l−1, Dihydrochlorid)[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Sapropterin ist der internationale Freiname für 5,6,7,8-Tetrahydrobiopterin (BH4, THB, Handelsname Kuvan). Dieses reduzierte Biopterin aus der chemischen Gruppe der Pterine kommt einerseits natürlich in höheren Organismen als Kofaktor für das Enzym Phenylalaninhydroxylase vor und wird andererseits als Arzneistoff verwendet, wozu es synthetisch hergestellt wird.
Tetrahydrobiopterin (Naturstoff)
Das natürliche Tetrahydrobiopterin (BH4) findet sich bei höheren Organismen vermutlich in jeder Körperzelle und ist dort ein essentieller Kofaktor für eine Reihe enzymatischer Prozesse. Tetrahydrobiopterin wird in den Zellen in drei enzymatischen Schritten aus Guanosintriphosphat hergestellt. Dabei kommen die Enzyme GTP-Cyclohydrolase I, 6-Pyruvoyltetrahydropterin-Synthase und Sepiapterin-Reduktase zum Einsatz.[3]
Als Kofaktor wirkt es bei der von Phenylalaninhydroxylase katalysierten Umwandlung von Phenylalanin zu Tyrosin, bei Tyrosinhydroxylase die Umwandlung von Tyrosin in Levodopa, bei Tryptophanhydroxylase Tryptophan in 5-Hydroxytryptophan sowie bei NO-Synthase die Synthese von Stickstoffmonoxid.
Sapropterin (Arzneistoff)
Indikation
Sapropterin ist für die Behandlung von Hyperphenylalaninämie (HPA) bei Erwachsenen und Kindern ab vier Jahren mit Phenylketonurie (PKU), die auf eine solche Behandlung ansprechen, zugelassen. Es ist ebenso für die Therapie von HPA bei Erwachsenen und Kindern mit Tetrahydrobiopterin-Mangel, die auf eine solche Behandlung ansprechen, zugelassen.[4] Etwa 30 bis 50 Prozent der Patienten mit PKU sprechen auf Sapropterin an.[5]
Wirkmechanismus
Sapropterin reduziert den Phenylalanin-Spiegel im Blut von PKU-Patienten, die auf die Therapie ansprechen. Der diesem Effekt zugrunde liegende Mechanismus ist noch nicht vollständig aufgeklärt. Saproterin wirkt als pharmakologisches Chaperon.[6] Offensichtlich spielt die Anreicherung und Stabilisierung der, bei den Betroffenen, mutierten Phenylalaninhydroxylase eine wichtige Rolle. Dadurch kann vermehrt Phenylalanin abgebaut werden.[7]
Pharmakologische Daten
Nach der oralen Einnahme von Sapropterin wird nach etwa 3 bis 4 Stunden die maximale Plasmakonzentration erreicht. Bei gesunden Erwachsenen beträgt die Plasmahalbwertszeit ungefähr vier Stunden. Bei Patienten die an PKU leiden und auf Sapropterin ansprechen, liegt sie bei 6,7 Stunden.[8]
Nebenwirkungen
Häufigste Nebenwirkungen sind Kopfschmerzen und Rhinorrhoe (Nasenausfluss) (10 %), sowie Husten, Übelkeit, pharyngolaryngeale Schmerzen, Nasenverstopfung, Durchfall, Erbrechen und Bauchschmerzen (1 bis 10 %).[8]
Pharmazeutische und chemische Informationen
Sapropterin wird in Form seines Dihydrochloridsalzes für die Arzneimittelherstellung eingesetzt und wird peroral eingenommen.
Sapropterin ist der einzige Arzneistoff, der zur Behandlung der Phenylketonurie als zugelassenes Fertigarzneimittel verfügbar ist. In den USA erfolgte die Zulassung am 13. Dezember 2007.[9] Am 2. Dezember 2008 erfolgte die europaweite Zulassung durch die Europäische Kommission. Seit April 2009 ist es auf dem deutschen Markt erhältlich.[10]
Markennamen
Sapropterin wird unter dem Markennamen Kuvan® in Europa von Merck Serono vertrieben; in den USA durch BioMarin Pharmaceutical und in Japan durch Asubio Pharmaceuticals – jeweils unter dem gleichen Markennamen. Zuvor trug es den Markennamen Phenoptin.[4]
Literatur
- EMEA: Zusammenfassung der Merkmale des Arzneimittels. (PDF; 79 kB)
- N. Blau u. a.: Optimizing the use of sapropterin (BH(4)) in the management of phenylketonuria. In: Mol Genet Metab 96, 2009, S. 158–163. PMID 19208488.
Weblinks
- Kuvan RxList.com (englisch)
- Öffentlicher Beurteilungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) zu: Sapropterin
Einzelnachweise
- ↑ a b Datenblatt Tetrahydrobiopterin, Dihydrochloride (PDF) bei Calbiochem, abgerufen am 9. Dezember 2015.
- ↑ a b Datenblatt (6R)-5,6,7,8-Tetrahydrobiopterin dihydrochloride bei Sigma-Aldrich, abgerufen am 22. April 2011 (PDF).
- ↑ B. Thöny et al. (2000): Tetrahydrobiopterin biosynthesis, regeneration and functions. In: Biochem J. 347, S. 1–16, PMID 10727395.
- ↑ a b Merck Serono erhält Zulassungsempfehlung für Kuvan(R) in Europa. ( vom 18. Juni 2009 im Internet Archive) Pressemitteilung von Merck Serono, vom 26. September 2008.
- ↑ B. Wick-Urban: Trotz Ketonurie normal essen. In: Pharmazeutische Zeitung Online 15, 2007.
- ↑ S. W. Gersting, M. Staudigl u. a.: Activation of phenylalanine hydroxylase induces positive cooperativity toward the natural cofactor. In: Journal of Biological Chemistry. Band 285, Nummer 40, Oktober 2010, S. 30686–30697, doi:10.1074/jbc.M110.124016. PMID 20667834. PMC 2945563 (freier Volltext).
- ↑ K. Michals-Matalon: Sapropterin dihydrochloride, 6-R-L-erythro-5,6,7,8-tetrahydrobiopterin, in the treatment of phenylketonuria. In: Expert Opin Investig Drugs 17, 2008, S. 245–251, PMID 18230057.
- ↑ a b M. Sanford, G. M. Keating: Sapropterin: a review of its use in the treatment of primary hyperphenylalaninaemia. In: Drugs, 69, 2009, S. 461–476, PMID 19323589.
- ↑ Sapropterin: Zulassung durch die FDA 10. Januar 2008; abgerufen am 4. Juli 2009; Nicht mehr aufrufbar.
- ↑ Sapropterin. In: Pharmazeutische ZeitungOnline; abgerufen am 4. Juli 2009.
