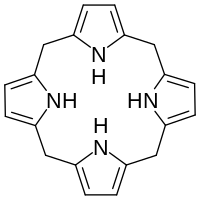
Hexahydroporphin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Hexahydroporphin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C20H20N4 | ||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 316,408 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Schmelzpunkt |
185 °C (zersetzt sich)[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Hexahydroporphin ist das einfachste zyklische Tetrapyrrol, ein wichtiges Strukturelement in der Biosynthese von Porphyrinen. Dem Namen entsprechend kann es als sechsfach hydriertes Porphin angesehen werden. Die Verbindung ist bei Raumtemperatur ein farbloser Feststoff, der in Dichlormethan, Aceton und Diethylether löslich ist und sich bei 185 °C zersetzt.[1] Hexahydroporphin kommt in der Natur nicht vor, der Makrozyklus ist aber das zentrale Strukturelement von Porphyrinogenen wie Uroporphyrinogen III, die Vorläufer in der Biosynthese vieler Porphyrine sind. In der Porphyrinbiosynthese wird der Makrozyklus durch das Enzym Protoporphyrinogen-Oxidase sechsfach dehydriert: je einmal an jedem Brückenkohlenstoffatom und an jedem zweiten Pyrrol-Stickstoffatom. Dadurch entsteht das aromatische Porphyrin. Hexahydroporphin wird deshalb auch (unsubstituiertes) Porphyrinogen genannt.
Herstellung
Derivate von Hexahydroporphin mit verschiedenen Gruppen an den Pyrrol- oder Methylenbrücken kommen in der Natur vor und werden seit langem untersucht.[3][4][5][6] Die unsubstituierte Verbindung wurde jedoch erst 2001 in guter Ausbeute synthetisiert. Sie kann durch sukzessive Kondensationen von 2,5-Bis(hydroxymethyl)pyrrol und Pyrrol mit einem Tripyrrol-Zwischenprodukt erhalten werden.[1]
Die Verbindung kann auch durch Reduktion von Porphin-Zink-Komplexen hergestellt werden.[7][8]
Einzelnachweise
- ↑ a b c d e Shozo Taniguchi, Hikaru Hasegawa, Shoko Yanagiya, Yusuke Tabeta, Yoshiharu Nakano und Masahiko Takahashi (2001): „Die erste Isolierung von unsubstituiertem Porphyrinogen und unsubstituiertem 21-Oxaporphyrinogen durch den ‚3+1‘-Ansatz aus 2,5-Bis(hydroxymethyl)pyrrol und Tripyrran-Derivaten“. Tetrahedron, Band 57, Ausgabe 11, Seiten 2103–2108. doi:10.1016/S0040-4020(01)00059-X
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ P. S. Clezy und C. J. R. Fookes (1977): „Die Chemie der Pyrrolverbindungen. XXXVIII. Die Synthese von Hexahydroporphyrin a und verwandten Verbindungen“. Australian Journal of Chemistry, Band 30, Ausgabe 8, Seiten 1799–1813. doi:10.1071/CH9771799
- ↑ A. H. Jackson (2009): „Die Totalsynthese von Pyrrolpigmenten“. In John ApSimon (Hrsg.), The Total Synthesis of Natural Products, Band 1; Wiley, 624 Seiten. ISBN 9780470129500
- ↑ Goutam K. Lahiri und Alan M. Stolzenberg (1993): „Einfache Bildung von Hexahydroporphyrinkomplexen durch Reduktion von Octaethylisobacteriochlorinnickel(II)“. Angewandte Chemie, Band 32, Heft 3, Seiten 429–432. doi:10.1002/anie.199304291
- ↑ Hidemitsu Uno, Takashi Inoue, Yumiko Fumoto, Motoo Shiro und Noboru Onomeso (2000): „Unsubstituierte Porphyrinogene und Hexaphyrinogene: Die erste Röntgencharakterisierung“ Journal of the American Chemical Society, Band 122, Ausgabe 28, Seiten 6773–6774. doi:10.1021/ja000482e
- ↑ Gilbert R. Seely und Melvin Calvin (1955): „Photochemical Studies of the Porphyrins. III. Photoreduction of a Porphyrin by Benzoin“ Journal of Chemical Physics, Band 23, Ausgabe 6, Seiten 1068–. doi:10.1063/1.1742192
- ↑ Gilbert R. Seely (1957): „Molecular Orbital Study of the Porphyrins“. Journal of Chemical Physics, Band 27, Ausgabe 1, Seiten 125–. doi:10.1063/1.1743651
