Polyacrylsäure
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
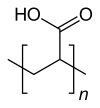
| |||||||
| Allgemeines | |||||||
| Name | Polyacrylsäure | ||||||
| Andere Namen |
| ||||||
| CAS-Nummer | |||||||
| Monomer | Acrylsäure | ||||||
| Summenformel der Wiederholeinheit | C3H4O2 | ||||||
| Molare Masse der Wiederholeinheit | 72,06 g·mol−1 | ||||||
| PubChem | 6581 | ||||||
| Eigenschaften | |||||||
| Aggregatzustand |
fest | ||||||
| Dichte |
1,4 g·cm−3[3] | ||||||
| Glastemperatur |
100–105 °C[4] | ||||||
| Löslichkeit |
| ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Toxikologische Daten | |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Polyacrylsäure ist eine synthetisch hergestellte organische Verbindung und ein hochmolekulares Polymer der Acrylsäure. Polyacrylsäure liegt in der Regel als hygroskopisches, weißes Pulver vor und ist entweder geruchlos oder weist einen schwach säuerlichen Geruch auf.
Polyacrylsäure vermag unter Wasseraufnahme im pH-neutralen bis schwach basischen Bereich Gele zu bilden und wird deshalb als Verdickungsmittel verwendet, etwa in pharmazeutischen und kosmetischen Zubereitungen, aber auch in Anstreichfarben, Schmiermitteln und anderen technisch verwendeten Produkten.
Polyacrylsäure kommt in verschiedenen Polymerisationsgraden vor.
Eigenschaften
Polyacrylsäure – als Pulver – ist weiß, hygroskopisch, entweder ohne wahrnehmbaren Geruch oder leicht säuerlich riechend. Das Polymer ist wenig quervernetzt und enthält 56 % bis 68 % Carboxygruppen. Der pKA-Wert liegt bei 6,0 ± 0,5 (Carbopol 934).[4] Die Angaben zur Schüttdichte variieren zwischen ca. 0,2 g·cm−3[4][6] und 2,08 g·cm−3[7] bei einer Teilchengröße von 2 bis 6 µm. Polyacrylsäuregranulate haben Korngrößen von etwa 180 bis 425 µm.
1%ige wässrige Polyacrylsäuresuspensionen weisen einen pH-Wert von 2,5 bis 3,2 auf. Erst nach Zugabe eines Protonenakzeptors [z. B. Trometamol (Tris), Ammoniumhydroxid (Ammoniakwasser) oder Natriumhydroxid (Natronlauge)] setzt die Gelbildung ein: die Carboxygruppen werden deprotoniert und stoßen sich ab, die zuvor geknäuelten Polymerketten strecken sich und bilden ein Linearkolloidgerüst, in welches das Wasser eingelagert wird. Die Gelbildung ist pH-abhängig. Wird ein bestimmter pH-Wert überschritten, bricht das Gelgerüst zusammen und das Gel verflüssigt sich. Auch gegenüber starken Säuren, mehrfach geladenen Kationen und kationischen Polymeren sind die Gelstrukturen empfindlich.[8] Bereits geringe Kationenkonzentrationen (etwa Ca2+, Al3+) können zur Verflüssigung bzw. Koagulation (Ausflockung) des Gels führen. Stabilisierend wirkt sich in solchen Fällen die Komplexierung der mehrwertigen Kationen mit beispielsweise Natriumedetat aus.
Je nach Polymerisationsgrad (Molmasse) unterscheidet man verschiedene Typen, deren Gele sich in ihrer Viskosität unterscheiden.
Pharmazeutisch verwendete Typen
Das US-amerikanische Arzneibuch (USP) differenziert homopolymere Polyacrylsäuren (Carbomere) in die Typen A, B und C, deren Gele sich durch unterschiedliche, pharmazeutisch relevante Viskositäten auszeichnen. Diese korrespondieren mit der sogenannten viskositätsmittleren molaren Masse Mv (Viscosity Average Molecular Weight),[9] die näherungsweise über die Viskosität ermittelt und ebenfalls zur Unterscheidung der Typen verwendet wird.
| Carbomer-Homopolymer, Typ nach USP | A | B | C |
|---|---|---|---|
| Viskosität [mPa·s] | 4.000–11.000 | 25.000–45.000 | 40.000–60.000 |
| Ungefähre relative Molmasse Mv [g·mol−1] | 1.250.000 | 3.000.000 | 4.000.000 |
| Handelstypen, benzolfrei (Beispiele) | Carbopol 981, Carbopol 971, Carbopol 71G | Carbopol 974P, Carbopol 984, Carbopol 5984 | Carbopol 980 |
| Die Viskositäten werden unter definierten Bedingungen (Konzentration 0,5 %, pH 7,3–7,8 bei 25 °C) mit einem Rotationsviskosimeter (Spindelmesskörper) als relative bzw. „scheinbare“ Viskosität ermittelt. | |||
Pharmazeutische Carbomerqualitäten, die dem Europäischen Arzneibuch entsprechen, weisen als 0,5%ige Gele Viskositäten von 300 bis 115.000 mPa·s auf.
Die früher bestehende Anwendungsbeschränkung der Polyacrylsäuren auf den äußeren Gebrauch, die auf dem Vorhandensein von Rückständen giftiger Lösemittel (Benzol) aus dem Syntheseprozess begründete, ist nicht mehr bedeutsam. Pharmazeutische Qualitäten werden heute benzolfrei gefertigt und sind sehr rein (maximaler Benzolgehalt 2 ppm). Der Anteil an monomerer Acrylsäure ist auf 0,25 % beschränkt.
Technisch und haushaltstechnisch verwendete Carbomere hingegen enthalten in der Regel Restbenzol.
Carbomere sind als Viskositätserhöher auch für wässrig-alkoholische und alkoholische Zubereitungen geeignet.[3]
Polyacrylsäure ist in der Regel gut hautverträglich und auch auf Schleimhäuten anwendbar; nur in höheren Konzentrationen wirkt sie reizend.
Synthese
Polyacrylsäure wird durch radikalische Polymerisation in Gegenwart von Peroxiden, mit Azoverbindungen oder anderen Radikalbildnern als Polymerisationsstartern synthetisiert.
Startreaktion
Zum Kettenstart bricht das Radikal 1 die C=C-Doppelbindung der Acrylsäure (2) auf und erzeugt das wachstumsfähige Radikal 3:
Wachstumsreaktion
In einer Wachstumsreaktion lagern sich an das Radikal 3 Monomere an. Das heißt, an das Radikal 3 lagert sich ein weiteres Molekül der Acrylsäure (2) an. Durch diese wiederholte Anlagerung der Acrylsäure entsteht immer wieder ein neues Radikal, so dass die Kette immer länger wird. Hierbei ist n eine natürliche Zahl, die die Anzahl der wiederholten Anlagerungen der Acrylsäure beschreibt:
Abbruchreaktion
In den folgenden Darstellungen sind m und n natürliche Zahlen, die die Anzahl an vorangegangenen wiederholten Anlagerungen der Acrylsäure in der Wachstumsreaktion beschreiben. Dabei können m und n verschieden sein. Das Wachsen der Kette kann durch eine radikalische Disproportionierung beendet werden:
Alternativ kann ein Kettenabbruch durch Rekombination zweier Radikale stattfinden, z. B. durch die Rekombination zweier Radikale mit einer hohen Molekularmasse:
Ein konkretes Beispiel sieht so aus: Acrylsäure wird mit geringen Mengen Allyl-Pentaerythritol, einem organischen Peroxid und einer Mischung aus den Lösungsmitteln Cyclohexan und Essigsäureethylester in einen Polymerisationsreaktor gegeben. Dann wird gemischt, polymerisiert, getrocknet und zerkleinert.[3]
Zur Herstellung der Carbomere nach dem Europäischen Arzneibuch wird mit Polyalkenethern von Zuckern oder Polyalkoholen in geringer Menge quervernetzt.[10] Das US-amerikanische Arzneibuch (USP) führt unter der Monographie Carbomer Homopolymer ebenfalls eine Quervernetzung mit Allylethern von mehrwertigen Alkoholen (z. B. Pentaerythrit) an.
Ebenfalls möglich ist die Herstellung durch Verseifung der entsprechenden Polyacrylnitril-Vorstufen oder durch oxidative Polymerisation von Acrolein und Wasserstoffperoxid.[3]
Verwendung
Pharmazeutische und medizinische Verwendung
| Verwendung der Carbomere[7] | |
|---|---|
| Funktion | Konzentration (%) |
| Gelbildner | 0,5–2 |
| Dispergierung | 0,5–1 |
| Emulgierung | 0,1–0,5 |
| Bindemittel | 5–10 |
- Als Gelbildner in der Herstellung von Arzneiformen zum Auftragen auf Haut und Schleimhäute. Carbomere eignen sich auch für die Herstellung von Haftgelen.[3] Dazu wird das Carbomer in hoher Konzentration in dickflüssiges Paraffin eingearbeitet, so dass eine halbfeste Zubereitung entsteht. Erst nach dem Auftragen auf feuchte Schleimhäute entsteht durch Wasseraufnahme das Gel, das eine hohe Haftfähigkeit aufweist.
- Als viskositätserhöhender Hilfsstoff in flüssigen Arzneimitteln zur Verhinderung von Sedimentation/Aufrahmung in dispersen Systemen oder Verbesserung der Dosierbarkeit.
- Als Pseudoemulgatoren stabilisieren Carbomere Öl-in-Wasser-Emulsionen. Zur Neutralisation werden langkettige aliphatische Amine wie z. B. Stearylamin eingesetzt.[11]
- Als Bindemittel in Tabletten.
- Als Bestandteil in Tränenersatzmitteln. Durch die feuchtigkeitsbindende Wirkung werden die Schleimhäute der Augen feucht gehalten.
Weitere Anwendungsbereiche
In emulsionsbasierten Schmiermitteln, in Druckertinte, in Polituren und Wachsen, in Farbe bzw. Anstrichen, in Wasser- oder ölfesten Beschichtungen sowie Kosmetikprodukten findet Polyacrylsäure weitere Anwendung.[11]
Sicherheitshinweise
Polyacrylsäure ist untoxisch und es gehen keine kennzeichnungspflichtigen Gefahren im Sinne der GHS-Richtlinien aus. Typen, die aus dem Herstellungsprozess resultierende Beimengungen bedenklicher Stoffe in kennzeichnungspflichter Menge enthalten, sind entsprechend zu kennzeichnen. Benzolhaltige Typen etwa werden als krebserregend eingestuft.[5] Benzolfreie Typen haben keine Gefahrstoffkennzeichnung.[2]
Alle Typen können ein explosives Staub-Luftgemisch bilden.
Einzelnachweise
- ↑ INN Recommended List 9, World Health Organisation (WHO), 8. Oktober 1969.
- ↑ a b Datenblatt Poly(acrylic acid), average Mv ~4,000,000 bei Sigma-Aldrich, abgerufen am 3. Dezember 2017 (PDF).
- ↑ a b c d e f g h i j k Bracher, Heisig, Langguth, Mutschler, Rücker, Scriba, Stahl-Biskup, Troschütz: Arzneibuch-Kommentar. Wissenschaftliche Erläuterungen zum Arzneibuch. Gesamtwerk mit 36. Aktualisierungsauslieferung 2010. WVG Stuttgart und Govi-Verlag – Pharmazeutischer Verlag, Eschborn, ISBN 3-8047-2115-X.
- ↑ a b c Avinash H. Hosmani, Thorat Y.S, Kasture P.V: Carbopol and its Pharmaceutical Significance: A Review
- ↑ a b c Datenblatt Poly(acrylic acid), average Mv ~3,000,000 bei Sigma-Aldrich, abgerufen am 3. Dezember 2017 (PDF).
- ↑ personalformulator.com: Thickeners - Carbomer ( vom 11. April 2013 im Internet Archive).
- ↑ a b Ray C. Rowe, Paul J. Sheskey, P. J. Weller (Hrsg.): Handbook of Pharmaceutical Excipients. 5. Auflage. 2006, S. 112.
- ↑ DrugBase: Hagers Enzyklopädie.
- ↑ Polymer Science Learning Center: Viscosity Average Molecular Weight.
- ↑ Rudolf Voigt: Pharmazeutische Technologie. 10. Auflage. Deutscher Apotheker Verlag, Stuttgart 2006, ISBN 3-7692-3511-8, S. 384.
- ↑ a b The Merck Index 11. Merck Publications, 1989, ISBN 0-911910-28-X.




