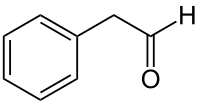
Phenylethanal
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Phenylacetaldehyd | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C8H8O | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit angenehmem Geruch[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 120,15 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
1,03 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
195 °C[2] | |||||||||||||||||||||
| Dampfdruck |
35 Pa (19 °C)[2] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,524–1,528 (bei 20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Phenylacetaldehyd oder Phenylethanal ist eine natürlich vorkommende aromatische Verbindung aus der Stoffgruppe der Aldehyde.
Vorkommen

Phenylacetaldehyd wird im Ceylon-Zimtbaum,[5] in Buchweizen (Fagopyrum esculentum),[6] Gartenbohnen,[5] Schokolade[7] sowie vielen anderen Nahrungsmitteln gefunden. Auch in einer großen Zahl von Pflanzen kommt dieser Stoff als Geruchsstoff vor, unter anderem in Äpfeln, Brombeeren, Kartoffeln, Melonen, Pfirsichen, Tamarinden und Tomaten. In besonders hoher Konzentration kommt es im brasilianischen Blumenöl aus Lecythis usitata var. paraensis (28,20 %), im Mori–Blumenöl aus Eschweilera coriacea (2,40 %) und im Chicorée-Extrakt (1,04 %) vor.[4]
Gewinnung und Darstellung
Phenylacetaldehyd kann durch säurekatalysierte Isomerisierung von Styroloxid[8] oder Oxidation von 2-Phenylethanol mit Chromsäure gewonnen werden.
Eigenschaften
Wegen seiner Reaktivität als Aldehyd polymerisiert Phenylacetaldehyd bei Stehen an der Luft und wird dabei zähflüssiger.[3] Bei der Selbstkondensation bildet sich vorwiegend 2,4,6-Tribenzyl-1,3,5-trioxan.[9]
Der Flammpunkt liegt bei 87 °C.[2]
Der Geruch wird als honig-süß, hyazinthenartig, grün und kakaoartig beschrieben,[4] auch als orangenartig, rosenartig.[10]
Phenylacetaldehyd ist neben anderen Stoffen ein Träger der antibiotischen Wirkung der Madentherapie.[11][12]
Verwendung
Industriell wird Phenylacetaldehyd in der Parfümherstellung verwendet, unter anderem auch als Tabakzusatzstoff[13], um das Aroma von Zigaretten zu verbessern. Die Aminosäure Phenylalanin kann mittels Strecker-Synthese aus Phenylacetaldehyd hergestellt werden.
Physiologie
Viele Insekten (Schmetterlinge, Hautflügler, Käfer und Netzflügler) nutzen diesen Aldehyd für die chemische Kommunikation (Pheromon).[14]
Einzelnachweise
- ↑ Eintrag zu PHENYLACETALDEHYDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. Mai 2021.
- ↑ a b c d e f g h i Eintrag zu Phenylacetaldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c Susan Budavari (Hrsg.): The Merck Index. 12. Auflage. Merck & Co., Whitehouse Station, New Jersey, USA 1996, ISBN 0-911910-12-3.
- ↑ a b c d e Datenblatt Phenylacetaldehyde bei The Good Scents Company, 25. Juli 2008.
- ↑ a b 2-PHENYLACETALDEHYDE (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 16. August 2023.
- ↑ D. Janes; D. Kantar; S. Kreft; H. Prosen: Identification of buckwheat (Fagopyrum esculentum Moench) aroma compounds with GC–MS, in: Food Chemistry, 112, 2009, S. 120–124; doi:10.1016/j.foodchem.2008.05.048.
- ↑ P. Schnermann, P. Schieberle: Evaluation of key odorants in milk chocolate and cocoa cass by aroma extract dilution analyses, in: J. Agric. Food Chem., 45, 1997, S. 867–872.
- ↑ I. Salla; O. Bergada; P. Salagre; Y. Cesteros; F. Medina; J. E. Sueiras; T. Montanari: Isomerisation of styrene oxide to phenylacetaldehyde by fluorinated mordenites using microwaves, in: Journal of Catalysis, 232, 2005, S. 239–245; doi:10.1016/j.jcat.2004.10.011.
- ↑ Patentanmeldung WO0246135A1: Verfahren zur Stabilisierung von Phenylacetaldehyd. Angemeldet am 26. November 2001, veröffentlicht am 13. Juni 2002, Anmelder: Haarmann & Reimer GmbH, Erfinder: Walter Kuhn.
- ↑ Yancheng Chaina Fragrance: Natural Hyacinthin ( vom 30. Juni 2013 im Webarchiv archive.today).
- ↑ E. R. Pavillard; E. A. Wright: An antibiotic from maggots, in: Nature, 180, 1957, S. 916–917; doi:10.1038/180916b0.
- ↑ G. R. Erdmann; S. K. Khalil: Isolation and identification of two antibacterial agents produced by a strain of Proteus mirabilis isolated from larvae of the screwworm (Cochliomyia hominivorax) (Diptera: Calliphoridae), in: J. Med. Entomol., 23, 1986, S. 208–211.
- ↑ Tabakzutaten in PMI Produkten zum Verkauf hergestellt in Deutschland. In: Homepage Philip Morris. Abgerufen am 16. Januar 2018.
- ↑ Pherobase.com: Semiochemical – 2-phenylacetaldehyde.


