Pentachlorphenol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
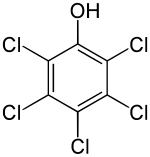
| Name | Pentachlorphenol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6HCl5O | ||||||||||||||||||
| Kurzbeschreibung |
weiße, geruchlose, nadelförmige Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 266,35 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,98 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
Zersetzung[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
4,71 (25 °C)[3] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
| ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Pentachlorphenol (kurz PCP) ist ein chlorierter, aromatischer Kohlenwasserstoff und stellt ein Phenol-Derivat dar, bei dem alle aromatischen Wasserstoffatome durch Chlor ersetzt sind. Im Jahr 2015 wurde es in den Anhang A des Stockholmer Übereinkommens aufgenommen,[7] so dass es – mit wenigen Ausnahmen – global verboten ist.
Darstellung
Pentachlorphenol kann durch Chlorierung von Phenol oder durch Hydrolyse von Hexachlorbenzol hergestellt werden. Die Produktion von PCP wurde aufgrund der ökotoxikologischen Eigenschaften stark eingeschränkt.
Eigenschaften
Pentachlorphenol ist farblos, bei Umgebungstemperatur fest und sehr gut fettlöslich. Technisches PCP und sein Natriumsalz enthalten meist hochtoxische Verunreinigungen wie polychlorierte Dibenzodioxine und -furane (PCDD bzw. PCDF). Auch bei der Verbrennung PCP-haltiger Produkte oder unter Lichteinwirkung können Dioxine und Furane entstehen. PCP hat bakterizide und fungizide Eigenschaften und ist daher für zahlreiche Einsatzbereiche geeignet. Pentachlorphenol kommt nicht natürlich in der Umwelt vor, sondern wird/wurde ausschließlich durch den Menschen hergestellt und freigesetzt.[8]
Pentachlorphenol unterliegt einer intensiven Photomineralisation und wird ebenso biologisch zu Pentachloranisol und p-Dimethoxytetrachlorbenzol verstoffwechselt (metabolisiert). Diese Produkte sind, relativ zu Pentachlorphenol gesehen, photochemisch stabile Metaboliten und können in Böden, Sedimenten und Pflanzen nachgewiesen werden. Der Metabolismus von Pentachlorphenol in aeroben aquatischen natürlichen Mischkulturen ergibt als Hauptprodukt Pentachloranisol. Dessen Photostabilität gleicht der von Hexachlorbenzol, das durch seine physikochemische Eigenschaften eine ubiquitäre Verbreitung über die Atmosphäre verursacht. Dieses führt zu einer Akkumulation in lipophilen Teilen der Umwelt, z. B. in Wachsen der Koniferen oder in Fischfett. Die Verbrennung der Reinsubstanz Pentachloranisol ergibt Hexachlorbenzol als Hauptprodukt und somit ein tertiäres Produkt von PCP.[9]
Verwendung
PCP kam wegen seiner fungiziden Wirkung vor allem in Holzschutzmitteln zum Einsatz, beispielsweise in Westdeutschland im Holzschutzmittel Xylamon BV (in Kombination mit Lindan), in der DDR unter anderem in den Mitteln Hylotox IP und Paratectol 9025.[10] In manchen Ländern wird PCP jedoch auch heute noch in der Textil- und Lederindustrie sowie als Imprägniermittel und zum Bläueschutz für Holz verwendet.[11] Nachzuweisen ist es u. a. in Textilien aus Naturfasern und Druckfarben.
Biologische Wirkung
PCP entkoppelt die Atmungskette in den Mitochondrien der Zellen, was zu Blutdruckanstieg, Hyperglykämie, beschleunigter Atmung und zu Herzversagen führt. Die Aufnahme erfolgt sowohl durch den Magen-Darm-Trakt als auch über die Haut. Die biologische Halbwertszeit von PCP liegt bei etwa 1 bis 3 Wochen.[11] Zu beachten ist, dass PCP herstellungsbedingt zumeist mit Dioxinen verunreinigt ist,[12] deren Toxizität die des PCP je nach Grad der Verunreinigung übertrifft.
Heute stellen mit PCP behandelte Hölzer in vielen Gebäuden im Bestand einen ernstzunehmenden Gebäudeschadstoff dar, der nicht selten aufwändig entfernt werden muss, wie z. B. im Verlauf der Sanierung des wertvollen Gestühls und der hölzernen Emporen in der Dreieinigkeitskirche in Regensburg. Dort musste in mehrtägigen Vakuum-Extraktionsverfahren mit in Alkohol getränkten Schwämmen der Giftstoff nach und nach aus dem Holz extrahiert werden.[13]
Sicherheitshinweise
Mit PCP behandeltes Holz weist besonders hohe Gehalte der Verbindung in den obersten Schichten auf, wobei dort Werte in einer Größenordnung von mehreren 1.000 mg/kg gemessen werden. Wegen der langen Verweildauer im Holz werden noch viele Jahre nach der Anwendung höhere Werte als in unbehandelten Hölzern gefunden. Aber auch bei unbehandelten Hölzern können die Werte erhöht sein, wenn das Rohholz behandelt wurde oder Sekundärkontaminationen auftreten. PCP verdampft allmählich aus behandelten Holz und lagert sich an andere Oberflächen an, z. B. an Hausstaub, Tapeten, Putz, Möbel, Textilien oder Bücher. Auch an Kleidungsstoffen wie Wolle, Leinen und Baumwolle reichert sich PCP an. Zu beachten ist weiterhin, dass PCP in öligen Lösungen Gummihandschuhe durchdringen kann.[8] Die mit 14 mg/l (bei 25 °C) niedrige Wasserlöslichkeit und die geringe biologische Abbaubarkeit führen zu einem ubiquitären Vorkommen.
Um die Belastung durch das Holzschutzmittel PCP in Innenräumen zu ermitteln, sind zunächst Zeitpunkt, Art und Menge der Verwendung festzustellen. Wenn der Quotient aus der behandelten Holzoberfläche und dem Raumvolumen über 0,2 m²/m³ liegt, muss eine Staubanalyse von Frischstaub (etwa eine Woche alt) oder länger abgelagertem Altstaub erfolgen. Bei Konzentrationen von mehr als 1 mg PCP/kg Frischstaub oder mehr als 5 mg PCP/kg Altstaub entnimmt man Materialproben aus 0 bis 2 mm Tiefe des Holzes. Ergibt sich hierbei ein Wert von über 50 mg PCP/kg Holz, so ist das Jahresmittel der Raumluftbelastung festzustellen. Eine Sanierung ist nach der PCP-Richtlinie erforderlich, wenn die Konzentration im Jahresmittel mehr als 1 μg PCP/m3 Luft beträgt.[14]
Seit 1985 galt eine Selbstverpflichtung des Industrieverbandes Bau, Chemie und Holzschutzmittel, PCP in seinen Erzeugnissen nicht mehr zu verwenden. Seit 1986 ist die Produktion von Pentachlorphenol in der Bundesrepublik Deutschland ausgesetzt. 1989 erließ die Bundesregierung die Pentachlorphenol-Verbotsverordnung auf der Basis des Chemikaliengesetzes. Seitdem ist die Herstellung, das Inverkehrbringen und die Verwendung von PCP, Na-PCP und PCP-haltigen Erzeugnissen, die mehr als 5 mg/kg PCP enthalten, verboten. Darüber hinaus wird aber auch der Gesamteintrag gefährlicher polychlorierter Dibenzodioxine und Dibenzofurane (PCDD und PCDF), die als Verunreinigungen auch in technischem PCP enthalten sind, erheblich gesenkt.[15] 1996 gingen die Inhalte der PCP-Verordnung in der seitdem gültigen Chemikalienverbots-Verordnung (Abschnitt 15) auf. Seit Inkrafttreten der PIC-Konvention[16] 2004 dürfte auch PCP nur noch dann in Entwicklungsländer exportiert werden, wenn diese über das Gefährdungspotential informiert wurden und ausdrücklich zugestimmt haben.[17]
Nachweis
Pentachlorphenol lässt sich durch Farbreaktionen nachweisen, genauere Bestimmungen können durch UV-Spektroskopie oder Dünnschichtchromatografie erfolgen. Eine gaschromatografische Analyse erfolgt meistens als Methyl-, Ethylether oder in acetylierter Form. Die Bestimmung von PCP in Holz nach Acetylierung mittels GC-ECD (Elektroneneinfangdetektor) ist in Anhang IV (zu § 6) zur Altholzverordnung beschrieben, die Bestimmung in Leder in DIN EN ISO 17070. Anstelle des Elektroneneinfangdetektors (ECD) kann auch ein massenselektiver Detektor (Massenspektrometer, MS) verwendet werden.
UV-spektroskopisch erfolgt der Nachweis über batho- und hypsochrome Verschiebung der Absorption, welche auftritt, wenn PCP mit einem Cyclodextrin-Porphyrin-Komplex („gedeckeltes Cyclodextrin“) interagiert. Die Bildung von Wasserstoffbrücken zwischen der Hydroxygruppe des Phenols und dem Stickstoff des Pyrrols führt dabei zu einer Änderung der Porphyrin-Absorption.[18]
Weblinks
- Stoffmonographie Pentachlorphenol – Referenz- und Human-Biomonitoring-Werte, Bundesgesundheitsbl – Gesundheitsforsch – Gesundheitsschutz, 1997, 40, Nr. 6, doi:10.1007/BF03042913.
- Heidelore Fiedler, Matthias Hilpert, Michael Hub, Otto Hutzinger: Handbuch Altlasten und Grundwasserschadensfälle – Stoffbericht Pentachlorphenol (PCP) (PDF; 2,4 MB), Landesanstalt für Umweltschutz. B.den-Württemberg, Karlsruhe 1996.
- Biologische Abbauwege von Pentachlorphenol
- Pentachlorphenol (PCP) Detailinfos und Richtwerte (UmweltWissen – Bayerisches Landesamt für Umwelt; PDF; 309 kB)
Einzelnachweise
- ↑ a b Eintrag zu Pentachlorphenol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- ↑ a b c d e f g Eintrag zu Pentachlorphenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- ↑ Allan J. Cessna, Raj Grover: Spectrophotometric determination of dissociation constants of selected acidic herbicides. In: Journal of Agricultural and Food Chemistry. 26. Jahrgang, Nr. 1, 1978, S. 289–292, doi:10.1021/jf60215a024 (englisch).
- ↑ Eintrag zu Pentachlorphenol in der Human Metabolome Database (HMDB), abgerufen am 6. Januar 2024.
- ↑ Eintrag zu Pentachlorophenol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 87-86-5), abgerufen am 4. März 2020.
- ↑ Countries move forward on important issues for sustainable management of chemicals and waste: “[…] four new listings (three under the Stockholm and one under the Rotterdam Conventions – polychlorinated napthalenes, hexachlorobutadiene, and pentachlorophenol and its salts and esters; and methamidophos respectively)”, 2015.
- ↑ a b Bayerisches Landesamt für Umwelt: Pentachlorphenol (PCP)
- ↑ K.W. Schramm, A. Reischl, Monika Hirsch, D. Lenoir, O. Hutzinger: Pentachlorphenol – Sekundäre und tertiäre Umwandlungsprodukte In: Umweltwissenschaften und Schadstoff-Forschung. 1, 1989, S. 6, doi:10.1007/BF02983900.
- ↑ TGL 4424, online auf holzfragen.de: Die Verträglichkeit der Wirkstoffe von verschiedenen Holzschutzmitteln – DDR Holzschutzmittel, abgerufen am 6. April 2012
- ↑ a b allum.de: Pentachlorphenol, abgerufen am 30. März 2013.
- ↑ Bayerisches Landesamt für Gesundheit und Lebensmittelsicherheit: Pentachlorphenol (PCP)
- ↑ Mittelbayerische Zeitung vom 21. August 2014: Dreieinigkeitskirche bald offen, abgerufen am 11. Dezember 2016.
- ↑ Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA): Innenraumarbeitsplätze – Vorgehensempfehlung für die Ermittlungen zum Arbeitsumfeld. Abgerufen am 11. März 2020.
- ↑ U. Schlottmann: PCP-Verbotsverordnung in Kraft getreten. In: Umweltwissenschaften und Schadstoff-Forschung. 2, 1990, S. 41, doi:10.1007/BF03039332.
- ↑ Rotterdam Convention: Chemicals listed in Annex III of the Convention and currently subject to the PIC Procedure
- ↑ Der Tagesspiegel: Giftexport in Entwicklungsländer wird eingeschränkt
- ↑ Shishan Zhao, John H. T. Luong: A cyclodextrin-porphyrin assembly as chemosensor for pentachlorophenol. In: Journal of the Chemical Society, Chemical Communications. Nr. 6, 1995, S. 663–664, doi:10.1039/C39950000663.



