Nicotinsäure
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|

| |||||||||
| Allgemeines | |||||||||
| Trivialname | Vitamin B3 | ||||||||
| Andere Namen | |||||||||
| Summenformel | C6H5NO2 | ||||||||
| CAS-Nummer | 59-67-6 | ||||||||
| PubChem | 938 | ||||||||
| ATC-Code | |||||||||
| DrugBank | DB00627 | ||||||||
| Kurzbeschreibung | farblose Kristalle[2] | ||||||||
| Vorkommen | Geflügel, Leber, Kaffee, Bierhefe | ||||||||
| Physiologie | |||||||||
| Funktion | Bestandteil der Coenzyme NADH und NADPH | ||||||||
| Täglicher Bedarf | 15–20 mg | ||||||||
| Folgen bei Mangel | leicht: Reizbarkeit, Appetitlosigkeit, Konzentrations- und Schlafstörungen schwer: Pellagra | ||||||||
| Überdosis | über 1,5–3 g pro Tag | ||||||||
| Eigenschaften | |||||||||
| Molare Masse | 123,11 g·mol−1 | ||||||||
| Aggregatzustand | fest | ||||||||
| Dichte | 1,47 g·cm−3[3] | ||||||||
| Schmelzpunkt | |||||||||
| pKs-Wert | |||||||||
| Löslichkeit | wenig in Wasser (18 g·l−1 bei 20 °C)[3] | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Toxikologische Daten | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Nicotinsäure (auch Niacin und Pyridin-3-carbonsäure genannt) ist ein semi-essentielles Vitamin aus dem B-Komplex. Die Bezeichnung Vitamin B3, seltener Vitamin PP oder PP-Faktor (Pellagra-Preventing-Faktor) für Nicotinsäure, gilt heute als veraltet und überholt. Die Nicotinsäure wurde 1867 bei der Oxidation von Nicotin entdeckt;[6] ihre physiologische Wirksamkeit wurde 1934 erkannt.[7]
Die Nicotinsäure ist eine organische Verbindung, die zu den Heterocyclen (genauer: Heteroaromaten) zählt. Sie besteht aus einem Pyridinring, der mit einer Carboxygruppe (–COOH) substituiert ist. Sie gehört mit den anderen beiden Isomeren Picolinsäure und Isonicotinsäure zur Stoffgruppe der Pyridincarbonsäuren mit der Summenformel C6H5NO2.
Die Amidform, Nicotinamid, ist ein Vitamer Niacins.[8]
Geschichte
Die Nicotinsäure wurde erstmals 1867 von C. Huber synthetisiert. Dabei verwendete er Nicotin und ließ dieses oxidieren. Der österreichische Chemiker Hugo Weidel bestimmte im Jahr 1872 die Summenformel der Huberschen Pyridincarbonsäure.[9][10] Die physiologische Bedeutung wurde erst Jahre später (1914) untersucht. Russell Henry Chittenden und Frank Pell Underhill (1877–1932) erkannten 1917 die Beteiligung der Nicotinsäure am Vitaminsystem. Die genaue Verbindung zwischen der Krankheit Pellagra und einem Nicotinsäuremangel konnte Paul Jones Fouts (* 1905) erst 1937 nachweisen. Daraufhin wurde Nicotinsäure als Nahrungsergänzungsmittel eingesetzt. Später wurde versucht, die Derivate durch Herstellen verschiedener Nicotinsäureester weiterzuentwickeln. Hierbei erwies sich der Butylester als am wirksamsten. Anfänglich erfolgte die Verwendung beider Substanzen topisch zur Therapie rheumatischer Schmerzen. Wegen der blutgefäßerweiternden Wirkung verwendete man Nicotinsäure (Handelsname Niconacid)[11] und Nicotinylalkohol (Ronicol) zur oralen Therapie arterieller peripherer Durchblutungsstörungen.[12]
Vorkommen und Eigenschaften
Nicotinsäure findet sich in allen lebenden Zellen und wird in der Leber gespeichert. Sie bildet einen wichtigen Baustein verschiedener Coenzyme (NAD, NADP) und ist in dieser Form von zentraler Bedeutung für den Stoffwechsel von Proteinen, Fetten und Kohlenhydraten. Gegenüber Hitze, Licht und dem Luftsauerstoff ist Nicotinsäure weniger empfindlich als andere Vitamine der B-Gruppe.
Nicotinsäure ist ein kristalliner Feststoff. Sie tritt in zwei polymorphen Formen auf. Bei Raumtemperatur liegt die Kristallform II vor. Beim Aufheizen auf 178,8 °C wird eine schwach endotherme Festphasenumwandlung mit ΔfusH = 0,81 kJ/mol zur Kristallform I beobachtet. Diese schmilzt dann bei 236,6 °C mit einer Schmelzenthalpie von ΔfusH = 27,57 kJ/mol.[13]
Von der Nicotinsäure leitet sich namentlich die Dinicotinsäure ab (Pyridin-3,5-dicarbonsäure), die am Pyridin achsensymmetrisch zwei Carboxygruppen trägt.
Synthese (Herstellung)
Nicotinsäure bildet sich durch Oxidation von Nicotin mittels Salpetersäure.[14] Alternativ kann sie aus Chinolin durch Oxidation mittels Kaliumpermanganat (KMnO4) dargestellt werden, wobei als Zwischenprodukt Chinolinsäure entsteht:[14]

Schließlich erhält man Nicotinsäure auch durch Oxidation von 3-Picolin mit Kaliumpermanganat:[15]

Von Bedeutung ist heute lediglich der Lonza-Prozess, die Oxidation von 5-Ethyl-2-methylpyridin (MEP) mittels Salpetersäure.[16] Jährlich werden so etwa 15.000 t Niacin hergestellt.[17]
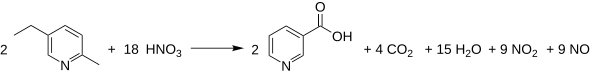
Prozesstechnisch wird die Salpetersäure mit den entstandenen Stickoxiden mit Wasser regeneriert und dem Prozess wieder zugeführt.
Biosynthese
Über die Biosynthese der Nicotinsäure in Pilzen und Pflanzen ist wenig bekannt, insbesondere über die beteiligten Enzyme. Am wahrscheinlich häufigsten ist der oxidative Abbau von Tryptophan über Kynurenin zur Nicotinsäure anzutreffen.[18]

Dieser Weg spielt jedoch im Menschen keine Rolle, da der eigentliche Zweck des Niacins, die Biosynthese von NAD, auch mit dem Tryptophan-Abbauprodukt Chinolinsäure funktioniert.[19][20]
Funktionen
Nicotinsäure ist am Eiweiß-, Fett- und Kohlenhydratstoffwechsel beteiligt. In Form der Coenzyme NAD/NADP und ihrer reduzierten Formen NADH + H+ / NADPH + H+ ist die Nicotinsäure als Wasserstoffüberträger, also Reduktionsmittel, z. B. am Citratzyklus und der Atmungskette beteiligt. Sie hat eine antioxidative Wirkung und nimmt an vielen enzymatischen Vorgängen teil. Nicotinsäure ist von Bedeutung für die Regeneration von Haut, Muskeln, Nerven und DNS.
Vorkommen und Bedarf
Natürliche Lieferanten von Nicotinsäure sind Nahrungsmittel wie Geflügel, Wild, Fisch, Pilze, Milchprodukte und Eier. Auch Leber, Kaffee, Cashew-Kerne, Vollkornprodukte, verschiedene Gemüse und Obst enthalten Nicotinsäure, wobei sie aus tierischen Produkten grundsätzlich besser vom Organismus verwertet wird. Veganer können ihren Bedarf beispielsweise aus Erdnüssen, Weizenkleie, Datteln, Champignons, Bierhefe, getrockneten Aprikosen und Hülsenfrüchten decken.
Der tägliche Nicotinsäure-Bedarf des Körpers hängt vom Energiebedarf ab. Im Durchschnitt benötigt der erwachsene Körper etwa 6,6 Milligramm Niacin, um eine Energiemenge von 1000 Kilokalorien für seine Zellen, Gewebe und Organe zu erzeugen. Damit beträgt der Bedarf für Frauen 13 bis 15 mg Nicotinsäure pro Tag, für Männer 15 bis 20 mg pro Tag. Für Kinder werden 5 bis 6 mg und für stillende Frauen etwa 20 mg empfohlen.[21]
Nicotinsäure gilt als semi-essentiell, da es zwar aus einem Nebenweg des Tryptophan-Abbaus hergestellt werden kann, jedoch nicht bedarfsdeckend.[22]
Bei Milchkühen wird Niacin als Futtermittelzusatz verwendet. Hier sorgt es für eine ausgeglichenere Energiebilanz.[23]
Mangelerscheinungen (Hypovitaminose)
Mangelsymptome treten selten auf, da der Körper NAD nicht nur aus Niacin, sondern auch aus der Aminosäure Tryptophan bilden kann. Durch eine eiweißarme Ernährung oder durch Absorptionsstörungen kann es zunächst zu unspezifischen Störungen wie Appetitlosigkeit, Konzentrations- und Schlafstörungen sowie zu einer gewissen Reizbarkeit kommen. Symptome bei Nicotinsäuremangel sind weiterhin:
- Hautveränderungen (Dermatitis)
- Durchfall
- Depressionen
- Entzündung der Mund- und Magen-Darm-Schleimhäute
- Krankheit: Pellagra (kann unter anderem zu Demenz führen)
Das Auftreten der Pellagra-Krankheit steht im Zusammenhang mit der Einführung des Maises außerhalb Mittelamerikas, der wenig Tryptophan enthält. In seinem Ursprungsland Mexiko wird der Mais bis heute nach der Ernte üblicherweise in alkalisches Kalkwasser gelegt und nass vermahlen, wodurch die Nicotinsäure im Mais erst freigesetzt wird. Von den spanischen Eroberern wurde der Mais nach Südeuropa, Nordamerika und Afrika gebracht, ohne dass dort diese Zubereitungstechnik übernommen wurde. Wegen der höheren Erträge stellten sich viele Bauern schon bald von Weizen und Gerste auf Mais um. Die Folge war, dass bei ganzen Bevölkerungsschichten, bei denen Mais die Hauptnahrungsquelle war, Nicotinsäure- und Tryptophan-Mangelerscheinungen auftraten. Erst Anfang des 20. Jahrhunderts wurde der Zusammenhang von Pellagra und Maisernährung aufgeklärt.
Folgen einer Überdosierung (Hypervitaminose)
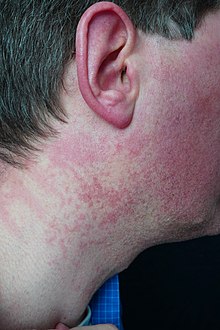
Von einer Überdosierung spricht man bei der Nicotinsäure bei 1,5–3 g Dosierung pro Tag. Bei einer Zufuhr von über 500 mg pro Tag, in Einzelfällen auch weniger, kommt es zum hautgefäßerweiternden Effekt Flush und bei einer Menge von über 2500 mg pro Tag können Blutdruckabfall, Schwindelgefühle und ein erhöhter Harnsäuregehalt im Blut auftreten. Bei Einnahme hoher Dosen von mehreren Gramm kann es zu Durchfall, Übelkeit, Erbrechen und einer Leberschädigung kommen, die sich als Gelbsucht zeigt.[24]
Pharmakologie
Nicotinsäure senkt LDL-Cholesterin, Lp(a) und Triglyceride und erhöht das HDL-Cholesterin. Allerdings konnte trotz der veränderten Blutfettwerte kein medizinischer Nutzen nachgewiesen werden.[25] Eine Cochrane-Metaanalyse konnte zeigen, dass Nicotinsäure in einer medianen Dosis von 2 g pro Tag (bei erwachsenen Menschen) weder Todesfälle noch Herzkreislauferkrankungen nennenswert reduziert, aber zu einem um 30 % erhöhten Diabetesrisiko führt.[25]
Die Nicotinsäure bewirkt eine periphere Vasodilatation. Als häufigste Nebenwirkung tritt eine Flush-Symptomatik ein. Man kann ihr jedoch mit Acetylsalicylsäure oder Laropiprant entgegenwirken, da diese beiden Wirkstoffe die gefäßdilatierende Wirkung der hierbei eine Rolle spielenden Prostaglandine unterbinden. Das Präparat der Firma Krewel in Eitorf, das in den 1920er Jahren erfolgreich war und zur Schmerzlinderung diente, enthielt eine Kombination von Nicotinsäureester und Salicylaten.[26]
Häufige Nebenwirkungen der auch zur Behandlung entzündlicher Erkrankungen von Galle, Leber und Darm eingesetzten Nicotinsäure (etwa im Pyridin-3-carbonsäure-oxymethylamid enthaltenden Präparat Bilamid-Cilag der Cilag GmbH[27]) sind auch Magen-Darm-Beschwerden. Die längere Einnahme von hochdosierten Nicotinsäurepräparaten kann die Glucosetoleranz verschlechtern und die Harnsäurewerte im Blut erhöhen. Auswirkungen auf die Blutfettwerte hat auch der von der Nicotinsäure abgeleitete Nicotinylalkohol.
Die National Institutes of Health (NIH) der USA stoppten Ende Mai 2011 eine groß angelegte Studie mit über 3400 Patienten, die parallel zu dem Lipidsenker Simvastatin Nicotinsäure-Retardtabletten (Niaspan) erhielten. Niaspan konnte die Rate an Herzanfällen nicht senken. Dagegen stieg die Anzahl an Schlaganfällen bei den Patienten, die zusätzlich Niaspan erhielten, leicht an.[28][29] Im Juli 2011 wurde der Vertrieb von Niaspan eingestellt, das Nachfolgeprodukt Tredaptive, eine Kombination von Nicotinsäure mit Laropiprant, konnte sich wegen eines ungünstigen Nutzen-Risiko-Verhältnisses nicht im Markt behaupten.[30]
Das durch Verzehr der Giftpilze Bambustrichterling und Parfümierter Trichterling verursachte Acromelalga-Syndrom kann durch Gabe von Nicotinsäure abgeschwächt werden.[31]
Siehe auch
Weblinks
- Höchstmengenvorschläge für Niacin in Lebensmitteln inklusive Nahrungsergänzungsmitteln, Bundesinstitut für Risikobewertung (2021)
Einzelnachweise
- ↑ Eintrag zu NIACIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 17. Februar 2020.
- ↑ Eintrag zu Nicotinsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Juni 2014.
- ↑ a b c d e Eintrag zu Nicotinsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Februar 2024. (JavaScript erforderlich)
- ↑ a b Zvi Rappoport (Hrsg.): CRC Handbook of Tables for Organic Compound Identification. 3rd Edition, CRC Press/Taylor and Francis, Boca Raton, FL, 1967, ISBN 0-8493-0303-6, Acid Dissociation Constants of Organic Acids in Aqueous Solution, S. 432.
- ↑ Oyo Yakuri. Pharmacometrics, 7(149), 1973.
- ↑ L. F. Fieser, M. Fieser: Organische Chemie. Verlag Chemie, Weinheim 1965, S. 1675–1676.
- ↑ J. G. Wooley, W. H. Sebrell: Niacin (Nicotinic Acid), an Essential Growth Factor for Rabbits […]. Division of Physiology, National Institute of Health, U.S. Public Health Service, Bethesda, Maryland, 1944.
- ↑ F. Aguilar et al.: Inositol hexanicotinate (inositol hexaniacinate) as a source of niacin (vitamin B3) added for nutritional purposes in food supplements. (PDF) Europäische Behörde für Lebensmittelsicherheit, 13. Februar 2009, abgerufen am 23. Januar 2023 (englisch).
- ↑ Weidel, H.: Zur Kenntnis des Nicotins in Ann. Chem. Pharm. 165 (1873) 328–349, doi:10.1002/jlac.18731650212.
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten organischer Substanzen, Version 2020, S. 120 pdf.
- ↑ Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. XCII (Anzeige der Dr. A. Wander GmbH Osthofen).
- ↑ Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer: Arzneimittelgeschichte. 2., überarb. und erw. Auflage. Wiss. Verl.-Ges, Stuttgart 2005, ISBN 978-3-8047-2113-5, S. 165.
- ↑ S. X. Wang, Z. C. Tan, Y. Y. Di, F. Xu, M. H. Wang, L. X. Sun, T. Zhang: Calorimetric study and thermal analysis of crystalline nicotinic acid. In: J. Therm. Anal. Calorim. 2004, 76, S. 335–342, doi:10.1023/B:JTAN.0000027833.24442.a0.
- ↑ a b Andrew Streitwieser, Clayton H. Heathcock, Edward M. Kosower: Organische Chemie. 2. Auflage. Wiley-VCH, Weinheim 1994, ISBN 3-527-29005-2, S. 1227.
- ↑ Harold Hart, Leslie E. Craine, David J. Hart, Christopher M. Hadad: Organische Chemie. ins Deutsche übersetzt von Nicole Kindler. 3. Auflage. Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8, S. 494.
- ↑ Detlef Gerritzen: Ökonomie und Ökologie im Einklang – nachhaltige chemische Produktion am Beispiel des Lonza-Produktionsverbundes in Visp. (PDF; 695 kB) 7. Freiburger Symposium 2005, Nachhaltige chemische Produktion.
- ↑ CHEManager: Lonza: neue Anlage für Vitamin B3. In: CHEManager. 29. Juli 2013, abgerufen am 22. Januar 2021.
- ↑ J. B. Tarr, J. Arditti: Niacin Biosynthesis in Seedlings of Zea mays. In: Plant Physiol. 1982, 69 (3), S. 553–556, PMID 16662247, PMC 426252 (freier Volltext).
- ↑ R. Jacob, M. Swenseid: Niacin. In: E. E. Ziegler, L. J. Filer (Hrsg.): Present Knowledge in Nutrition. 7. Auflage. ILSI Press, Washington DC 1996, S. 185–190.
- ↑ C. S. Fu, M. E. Swendseid, R. A. Jacob, R. W. McKee: Biochemical markers for assessment of niacin status in young men: levels of erythrocyte niacin coenzymes and plasma tryptophan. In: J. Nutr. 1989, 119 (12), S. 1949–1955, PMID 2621487, PDF.
- ↑ Hans Konrad Biesalski u. a.: Ernährungsmedizin. 4. Auflage. Thieme Verlag, 2010, ISBN 978-3-13-100294-5, S. 177.
- ↑ Gertrud Rehner, Hannelore Daniel: Biochemie der Ernährung. 3. Auflage. Springer 2010, S. 235, doi:10.1007/978-3-8274-2217-0.
- ↑ Futterzusätze bei Milchkühen ( vom 23. April 2015 im Internet Archive; PDF; 1,0 MB).
- ↑ Die Einnahme von Nicotinsäure in überhöhter Dosierung kann die Gesundheit schädigen. Stellungnahme Nr. 018/2012 des BfR vom 6. Februar 2012, abgerufen am 12. November 2016.
- ↑ a b Stefan Schandelmaier, Matthias Briel, Ramon Saccilotto, Kelechi K. Olu, Armon Arpagaus: Niacin for primary and secondary prevention of cardiovascular events. In: The Cochrane Database of Systematic Reviews. Band 6, 14. Juni 2017, S. CD009744, doi:10.1002/14651858.CD009744.pub2, PMID 28616955.
- ↑ laut Herstellerangabe und Beipackzettel
- ↑ Bilamid-Cilag. In: Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. LXXXI.
- ↑ L. Jones Hollis: Abbott down after NIH halts Niaspan study. In: fiercepharma.com vom 26. Mai 2011.
- ↑ NIH stops clinical trial on combination cholesterol treatment. In: fiercepharma.com vom 26. Mai 2011.
- ↑ MSD nimmt Tredaptive® vom Markt. In: Deutsche Apotheker Zeitung vom 13. Januar 2013.
- ↑ Nobuhito Nakajima, Masayuki Ueda, Naoyuki Higashi, Yasuo Katayama: Therapeutic potential of nicotinic acid in erythromelalgia associated with Clitocybe acromelalga intoxication. In: Clinical Toxicology. Band 51, Nr. 8, September 2013, S. 815–815, doi:10.3109/15563650.2013.823202.
