Hämerythrin
| Hämerythrin (Dendrostomum dyscritum) | ||
|---|---|---|
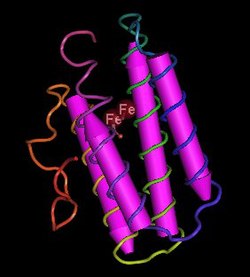
| ||
| Modell des Hämerythrin-Monomer vom Erdnusswurm (Dendrostomum dyscritum) nach PDB 1HMO | ||
| Masse/Länge Primärstruktur | 113 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homooctamer | |
| Kofaktor | Eisen | |
| Bezeichner | ||
| Externe IDs | ||
| Vorkommen | ||
| Übergeordnetes Taxon | Wirbellose[1] | |
Hämerythrine sind respiratorische Blutproteine, die bei einer Reihe mariner wirbelloser Tiere (z. B. Ringelwürmer, Spritzwürmer, Armfüßer) als Sauerstofftransporter fungieren. Sie nehmen also die gleichen Aufgaben wahr wie Hämoglobin und Myoglobin in höheren Tieren. An Land lebende Tierstämme, die über Hämerythrin verfügen, sind nicht bekannt.
Die Hämerythrine gehören, trotz ihres Namens, nicht zu den Häm-Enzymen. Das aktive Zentrum des reduzierten Zustandes stellen zwei über einen Hydroxidoliganden sowie zwei Carboxylate verbrückte Eisen(II)-Ionen dar. Die Koordinationssphären der Eisenzentren werden durch zwei bzw. drei Histidin-Liganden vervollständigt. Im Zuge der Anbindung des Disauerstoffmoleküls oxidiert dieses beide Eisenzentren einfach und wird dabei selbst zum Peroxidion reduziert. Gleichzeitig übernimmt es ein Proton von der Hydroxidobrücke. Das gebildete Hydroperoxidion wird dann an das fünffach koordinierte Eisenzentrum sowie mit einer Wasserstoffbrückenbindung an die verbrückende Oxidofunktion gebunden.[2] Die Farbe des oxidierten Moleküls ist violett, desoxidiert ist es farblos; die molekulare Masse beträgt 108 kDa.[3]
Siehe auch
- Eisen-Stoffwechsel
- Hämocyanin, ein ähnliches kupferhaltiges Protein mit entsprechender Funktion.
Quellen
Einzelnachweise
- ↑ InterPro-Eintrag
- ↑ R. Sauermost (Hrsg.): Lexikon der Biologie auf CD-Rom. Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-0356-1.
- ↑ R. Wehner, W. Gehring: Zoologie. 24. Auflage. Georg Thieme Verlag, Stuttgart, New York 2007, ISBN 978-3-13-367424-9, S. 339 (Tabelle 4.4).
