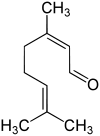
Citral
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| links Geranial (Citral A), rechts Neral (Citral B) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Citral | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C10H16O | |||||||||||||||
| Kurzbeschreibung |
hellgelbe Flüssigkeit mit zitronenähnlichem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 152,24 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||
| Dichte |
0,89 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
225 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser (420 mg·l−1 bei 20 °C)[2] | |||||||||||||||
| Brechungsindex |
1,4898 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Citral ist das Gemisch aus den cis-trans-Isomeren Geranial (Citral A) und Neral (Citral B).
Vorkommen
Natürlich kommt Citral in der Regel als Gemisch der beiden Isomeren vor.[7] Geranial ist als Duftstoff u. a. in Tomaten zu geringen Anteilen als Abbauprodukt von Lycopen zu finden. Citral ist Hauptbestandteil vom Zitronengrasöl (bis zu 85 %)[7] und dem Öl von Litsea cubeba (bis zu 75 %)[7] kommt aber auch in vielen anderen ätherischen Ölen, wie von Bay,[8][9] Basilikum,[9] Lorbeer,[9] Ingwer,[9] Majoran,[9] Malabargras,[9] Möhren,[9] Muskatellersalbei,[9] Perilla,[9] Rosenholz,[9] Zitronenstrauch,[9] und Zitronen[9] vor. Es ist Alarmpheromon der Blattschneiderameise.
Gewinnung und Darstellung
Außer der Gewinnung aus dem Öl von Litsea cubeba kann Citral auch durch verschiedene chemische Synthesen gewonnen werden. So durch Reaktion von Isobutylen mit Formaldehyd zu Isoprenol und dessen Reaktion zu Isoprenal mit Hilfe eines Silberkatalysators und dann folgende Reaktionen mit Prenol zu Citral. Weitere bekannte Synthesen gehen von Isopren oder Pinenen aus oder erfolgen durch Pyrolyse von Limonen.[10][11][12]
Eigenschaften
Citral bzw. Neral und Geranial zählen chemisch zur Gruppe der acyclischen Monoterpen-Aldehyde. Citral ist eine schwach gelbliche Flüssigkeit mit intensiv frischem Zitronenduft. Das Gemisch siedet bei 228 °C, in Wasser ist es nahezu unlöslich. Citral wirkt in reiner Form sowie im Gemisch in Konzentrationen ab 1 % reizend auf die Haut.[2]
Verwendung
Citral wird als Duft- und Aromastoff verwendet.[13] Gemäß der Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel muss es aufgrund allergenen Potenzials bei einem Gehalt über 0,01 %, bzw. 0,001 % (für auszuspülende/auf der Haut verbleibende Mittel) in der Liste der Bestandteile deklariert werden.
Reaktionen
Neral und Geranial lassen sich durch Dehydrierung aus Nerol und Geraniol herstellen. Citral reagiert mit Aceton im alkalischen Milieu (zum Beispiel Bariumhydroxid) zuerst unter Wasserabgabe zum Pseudoionon. Dieses kann dann unter Anwesenheit von Säuren und höheren Temperaturen in das Isomer Ionon überführt werden.[14][15]
Im alkalischen Milieu kann es auch in Acetaldehyd und 2-Methylhept-2-en-6-on zerfallen (Retro-Aldol-Reaktion).
Die heterogen katalysierte Hydrierung in Gegenwart von Palladiumkatalysatoren führt über die Zwischenstufe Citronellal mit etwa 86 % Ausbeute zum Dihydrocitronellal.[16]
Durch Reaktion mit Hydroxylamin zu Citraloxim und dessen Dehydrierung kann Geranylnitril gewonnen werden.[17]
Risikobewertung
Citral wurde 2014 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Citral waren die Besorgnisse bezüglich Verbraucherverwendung, Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie der vermuteten Gefahren durch sensibilisierende Eigenschaften. Die Neubewertung fand ab 2015 statt und wurde von Schweden durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[18][19]
Einzelnachweise
- ↑ Eintrag zu CITRAL in der CosIng-Datenbank der EU-Kommission, abgerufen am 17. September 2021.
- ↑ a b c d e f g h i j Eintrag zu Citral in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-118.
- ↑ Eintrag zu Citral im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ E. Boyland: Experiments on the chemotherapy of cancer: Further experiments with aldehydes and their derivatives. In: The Biochemical journal. Band 34, Nummer 8–9, September 1940, S. 1196–1201, PMID 16747303, PMC 1265400 (freier Volltext).
- ↑ P.M. Jenner, E.C. Hagan, Jean M. Taylor, E.L. Cook, O.G. Fitzhugh: Food flavourings and compounds of related structure I. Acute oral toxicity. In: Food and Cosmetics Toxicology. 2, 1964, S. 327–343, doi:10.1016/S0015-6264(64)80192-9.
- ↑ a b c Karl‐Georg Fahlbusch, Franz‐Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg: Flavors and Fragrances. In: Ullmann's Encyclopedia of Industrial Chemistry. Band 15, 2012, S. 73–198, doi:10.1002/14356007.a11_141.
- ↑ J. Abaul, P. Bourgeois, J. M. Bessiere: Chemical composition of the essential oils of chemotypes of Pimenta racemosa var.racemosa (P. Miller) J. W. Moore (Bois d'Inde) of Guadeloupe (F.W.I.). In: Flavour and Fragrance Journal. Band 10, Nr. 5, September 1995, S. 319–321, doi:10.1002/ffj.2730100506.
- ↑ a b c d e f g h i j k l CITRAL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 28. Juni 2021.
- ↑ Ralf Günter Berger: Flavours and Fragrances Chemistry, Bioprocessing and Sustainability. Springer Science & Business Media, 2007, ISBN 978-3-540-49339-6, S. 288 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Volker Hessel: Design and Engineering of Microreactor and Smart-Scaled Flow Processes. MDPI, 2018, ISBN 978-3-03842-038-5, S. 128 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Charles S. Sell: A Fragrant Introduction to Terpenoid Chemistry. Royal Society of Chemistry, 2007, ISBN 978-1-84755-001-9, S. 295 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Juliane Daphi-Weber, Heike Raddatz, Rainer Müller: Untersuchung von Riechstoffen – Kontrollierte Düfte, S. 94–95, in Band V der Reihe HighChem hautnah – Aktuelles aus der Lebensmittelchemie (Herausgegeben von der Gesellschaft Deutscher Chemiker) 2010, ISBN 978-3-936028-64-5.
- ↑ NODA, C., ALT, G. P., WERNECK, R. M. et al.: Aldol Condensation of Citral with Acetone on Basic Solid Catalysts, in: Braz. J. Chem. Eng., 15, 1998; doi:10.1590/S0104-66321998000200004.
- ↑ A. Russell, R. L. Kenyon: Pseudoionone In: Organic Syntheses. 23, 1943, S. 78, doi:10.15227/orgsyn.023.0078; Coll. Vol. 3, 1955, S. 747 (PDF).
- ↑ P. Claus, J. Arras, D. Ruppert: Einfluss ionischer Flüssigkeiten mit funktionalisierten Kationen auf die palladiumkatalysierte Flüssigphasenhydrierung von Citral, in: Chem. Ing. Techn. 81 (2009), S. 2007–2011; doi:10.1002/cite.200900085.
- ↑ Charles Sell: The Chemistry of Fragrances From Perfumer to Consumer. Royal Society of Chemistry, 2006, ISBN 978-0-85404-824-3, S. 67 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- ↑ Community Rolling Action Plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Citral, abgerufen am 26. März 2019.

