Genkanone

Eine Genkanone (englisch gene gun) ist ein Gerät, das dazu dient, DNA, RNA oder Proteine mit Hilfe von Partikeln in Zellen zu schießen (engl. particle bombardment oder auch biolistic transfection, von bio-ballistic). Neben der Protoplastentransformation und der Agrobakterien-vermittelten Transformation ist der Partikelbeschuss mit einer Genkanone eine etablierte Methode zur Erzeugung transgener Organismen oder für die transiente Transfektion zur Erzeugung einer Immunantwort.
Geschichte
Das Konzept der Genkanone wurde von Edward Wolf und Nelson Allen der Cornell Nanofabrication Facility sowie von den Pflanzenphysiologen John Sanford und Theodore Klein der Cornell University 1987 erfunden.[1] Die Rechte zur kommerziellen Verwertung der Produkte wurden 1990 an die Firma DuPont verkauft.
Neben der Anmerkung der Entwickler, die Methode universell für das Einbringen von Substanzen in lebende Zellen[2] zu verwenden, lag ursprünglich das Hauptaugenmerk auf der Entwicklung einer Methode, um Pflanzen zu transformieren, welche mit anderen Transformationsmethoden nicht zugänglich waren. Beispielsweise war es zum Zeitpunkt der Entwicklung der Methode nicht möglich, Monokotyle mit Agrobacterium tumefaciens zu transformieren.[2] Mit der Methode des Particle Bombardements lassen sich fast alle Pflanzen transformieren, auch das Einbringen von Plasmiden in Plastide ist möglich. Obwohl Pflanzen selbst keine Plasmide aufweisen, können sie die Plasmid-DNA auf den Partikeln in ihr eigenes Genom integrieren. Eine Transfektion ist dabei entweder transient, also nur vorübergehend, oder stabil mit einer Vererbung in die nächsten Generationen durch eine Integration der DNA ins Genom. Mittlerweile sind jedoch für alle monokotylen Getreide, darunter auch Mais[3][4] und Gerste[5], Protokolle für die Transformation mit Agrobakterien veröffentlicht worden.
Die Genkanone wurde 1990 das erste Mal an Tieren angewendet[6] und ab 1993 auch zu Immunisierungszwecken verwendet.[7] Dafür wird eine mobile Variante in Form einer Hochdruckpistole verwendet, die an eine Stickstoffdruckflasche angeschlossen ist. Die Stromversorgung erfolgt über eine 9-Volt-Batterie.
Partikelbeschaffenheit
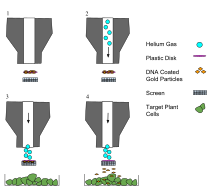
Die Partikel bestehen in den meisten Fällen aus Gold oder Wolfram und werden mit Plasmid-DNA beschichtet. Das Schießen erfolgt mit Gasdruck. Die Entwickler der Methode setzten zunächst Wolframpartikel mit einem Durchmesser von 4 µm ein.[2][2] In neuerer Zeit werden meistens kleinere Partikel verwendet, beispielsweise Goldpartikel mit einer Größe von 1,0 µm oder 0,6 µm.[8] Es konnte belegt werden, dass kleinere Partikel die Effektivität, mit dem Beschuss transgene Pflanzen zu erzeugen, deutlich erhöhen.[8] Die Partikel werden mit einem Polyamin (z. B. Spermidin)[9] beschichtet, um die Adsorption der DNA an die Partikel zu verbessern. Nach der DNA-Beschichtung erfolgt meistens eine letzte Beschichtung mit einem kationischen Polymer (z. B. Polyvinylpyrrolidon), um die Transfektionseffizienz zu verbessern.
Zielgewebe
Als Zielgewebe (target) für die Erzeugung transgener Pflanzen kann beispielsweise epidermales Gewebe[2] oder Kallusmaterial[8] verwendet werden. Die Partikel durchdringen dabei tausende von Zellen simultan und ermöglichen es, DNA in Zellen in situ einzubringen.[2]
Vor- und Nachteile
Vorteil des Partikelbeschusses ist zwar in den meisten Fällen eine höhere Effektivität, allerdings ist die Anzahl der stabilen Integrationen von Fremd-DNA in das Genom, im Vergleich zur Agrobakterien-Transformation, in den meisten Fällen geringer. Zu bedenken sind auch die hohen Beschaffungs- sowie Betriebskosten für eine Genkanone. Die Protoplastentransformation und die Agrobakterien-vermittelte Transformation sind hierbei deutlich kostengünstiger.
Bei Impfzwecken zeigt sich durch die zelluläre Expression und die Präsentation der Peptide an Haupthistokompatibilitätskomplex MHC-I eine zelluläre Immunantwort. Weitere Merkmale sind eine hohe Reproduzierbarkeit bei hundertfach niedrigerer Dosierung im Vergleich zur intramuskulären Injektion von Plasmiden[10] und eine Expression in situ mit korrekter Proteinfaltung und allen posttranslationalen Modifikationen. Das Verfahren ist nadelfrei und kommt ohne Kühlkette aus.
Siehe auch
Weblinks
- Richtest du schon mal die Kanone? Pflanzenzellen werden am MPI mit Hilfe der Partikelkanone gentechnisch verändert (mit Video).
Einzelnachweise
- ↑ Sanford, J. C., T. M. Klein, et al. (1987). Delivery of substances into cells and tissues using a particle bombardment process. Journal of Particulate Science and Technology 5: 27–37.
- ↑ a b c d e f Klein, T. M., E. D. Wolf, et al. (1987). High-velocity microprojectiles for delivering nucleic-acids into living cells. Nature 327(6117): 70–73.
- ↑ Ishida, Y., Y. Hiei, et al. (2007). Agrobacterium-mediated transformation of maize. Nature Protocols 2(7): 1614–1621.
- ↑ Ishida, Y., H. Saito, et al. (1996). High efficiency transformation of maize (Zea mays L.) mediated by Agrobacterium tumefaciens. Nature Biotechnology 14(6): 745–750.
- ↑ Tingay, S., D. McElroy, et al. (1997). Agrobacterium tumefaciens-mediated barley transformation. Plant Journal 11(6): 1369–1376.
- ↑ N. Yang, J. Burkholder, B. Roberts, B. Martinell, D. McCabe: In vivo and in vitro gene transfer to mammalian cells by particle bombardment. In: PNAS 87:9568 (1990)
- ↑ J. B. Ulmer, J. J. Donnelly, S. E. Parker, G. H. Rhodes, P. L. Felgner, V. J. Dwarki, S. H. Gromkowski, R. R. Deck, C. M. DeWitt, A. Friedman: Heterologous protection against influenza by injection of DNA encoding a viral protein. In: Science 259(5102):1745-9 (1993)
- ↑ a b c B. R. Frame, H. Y. Zhang, et al. (2000). Production of transgenic maize from bombarded type II callus: Effect of gold particle size and callus morphology on transformation efficiency. In Vitro Cellular & Developmental Biology-Plant 36(1): 21–29.
- ↑ S. Wang, S. Joshi, S. Lu: Delivery of DNA to skin by particle bombardment. In: Methods in molecular biology. Band 245, 2004, S. 185–196, PMID 14707379.
- ↑ T. M. Pertmer, M. D. Eisenbraun, D. McCabe, S. K. Prayaga, D. H. Fuller, J. R. Haynes: Gene gun-based nucleic acid immunization: elicitation of humoral and cytotoxic T lymphocyte responses following epidermal delivery of nanogram quantities of DNA. In: Vaccine 13(15):1427-30 (1995).
