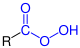
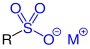
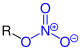
Funktionelle Gruppe
In der Organischen Chemie versteht man unter einer funktionellen Gruppe (auch charakteristische Gruppe) die Atomgruppe in einer Verbindung, die die Stoffeigenschaften und das Reaktionsverhalten der Verbindung maßgeblich bestimmt. Eine Verbindung kann auch mehrere funktionelle Gruppen mit unterschiedlichen Eigenschaften tragen.[1] In diesem Zusammenhang wird von heterobifunktionalen Molekülen gesprochen (Beispiel: Ethanolamin) bzw. bei mehreren funktionellen Gruppen heteropolyfunktional (Beispiel: Tyrosin). Analog kann bei Molekülen mit mehreren gleichen funktionellen Gruppen von homobifunktional (Beispiel: Ethylenglycol) bzw. homopolyfunktional gesprochen werden (Beispiel: Glycerin). Verbindungen, die gleiche funktionelle Gruppen, aber unterschiedliche Alkyl- oder Arylreste haben, werden auf Grund ihrer ähnlichen Eigenschaften zu Stoffklassen zusammengefasst.
Funktionelle Gruppen werden anhand der beteiligten Atome in funktionelle Gruppen mit Heteroatomen (meist O, N, S, P, Halogene) und solche ohne Heteroatome (z. B. C=C-Doppelbindungen, C≡C-Dreifachbindungen oder Aromaten) eingeteilt. Auch wenn Letztere manchmal nicht als „vollwertige“ funktionelle Gruppen, sondern nur als Strukturbausteine betrachtet werden, so zeigen sie doch ein besonderes und typisches Reaktionsverhalten, das die Bezeichnung funktionelle Gruppe und die jeweilige Zusammenfassung zu Stoffklassen rechtfertigt.
Im Fall von anorganischen oder metallorganischen Verbindungen werden auch einfache Alkyl- oder Arylgruppen als funktionelle Gruppen angesehen. Alle organischen Seitenketten und funktionellen Gruppen werden dann unter der allgemeinen Bezeichnung Organylgruppe zusammengefasst.
Für funktionelle Gruppen gibt es zur Vereinfachung der Schreibung in Strukturformeln und Texten Abkürzungen, die in der Liste der Abkürzungen in der organischen Chemie aufgelistet sind.
Eigenschaften
Nach der Definition beeinflusst eine funktionelle Gruppe die chemischen und physikalischen Eigenschaften der sie enthaltenden Ausgangsverbindung meist erheblich. Die Art der Beeinflussung wird am Beispiel des Alkans Butan und drei seiner strukturellen Abkömmlinge mit gleicher Anzahl von C-Atomen vor Augen geführt:
| Struktureller Abkömmling mit gleicher Anzahl von C-Atomen |
Verbindung | Halbstrukturformel | Eigenschaften |
|---|---|---|---|
| Ausgangsverbindung | Butan | H3C–CH2–CH2–CH3 | gasförmig |
| Carboxyverbindung | Butansäure, auch Buttersäure | H3C–CH2–CH2–COOH | flüssig, übelriechend, reagiert sauer |
| Aminoverbindung | Butan-2-amin, auch 2-Butylamin | H3C–CH(NH2)–CH2–CH3 | flüssig, übelriechend, reagiert basisch |
| Carboxy- und Aminoverbindung | 4-Aminobutansäure, auch 4-Aminobuttersäure oder γ-Aminobuttersäure (GABA) |
H2N–CH2–CH2–CH2–COOH | fest, liegt in wässriger Lösung als Zwitterion H3N+–CH2–CH2–CH2–COO− vor |
Verschiedene funktionelle Gruppen und deren Nomenklatur
Grundsätzlich ist die substitutive Nomenklatur, die im Folgenden beschrieben wird, zur Benennung von Substanzen heranzuziehen. Nach dieser Nomenklatur ist die funktionelle Gruppe entweder als Vorsilbe (Präfix) oder als Endung (Suffix) im Namen der Gesamtverbindung enthalten.
Siehe auch: Nomenklatur
Funktionelle Gruppen (nach abnehmender Priorität geordnet)
Für die Bezeichnung dieser Gruppen in einer Verbindung werden entweder Präfixe oder Suffixe verwendet. Die ranghöchste Gruppe wird dabei als Endung verwendet und alle anderen, alphabetisch geordnet, als Vorsilben. Die verschiedenen Verbindungsklassen sind in der folgenden Tabelle nach abnehmender Priorität geordnet.[2]
Zum Teil gibt es unterschiedliche Bezeichnungen, je nachdem ob das angegebene Kohlenstoffatom einen Teil des Stammsystems (siehe Stichwort Nomenklatur) darstellt (Darstellung: R-CXYZ) oder nicht (Darstellung: R-CXYZ). Wie in der Chemie üblich, steht der Buchstabe R für einen organischen Rest. Der Platzhalter X steht hier für Halogenide.
| Halbstrukturformel | Strukturformel | Stoffklasse | Vorsilbe (Präfix) | Endung (Suffix) | Beispiele |
|---|---|---|---|---|---|
| R• bzw. R: | Radikale | Ylo- | -yl -yliden |
z. B. Cl• oder Triplett-Carben | |
| Kationen | -ium -onium -ylium |
z. B. Kationische Tenside, Methyltriphenylphosphonium | |||
| R–COOH R–COOH |
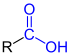 |
Carbonsäuren | Carboxy- - |
-carbonsäure -säure |
z. B. Ameisensäure, Essigsäure, Buttersäure, Aminosäuren |
| R–COOOH R–COOOH |
Peroxycarbonsäuren | Hydroperoxycarbonyl- - |
-peroxycarbonsäure -Peroxy....säure |
z. B. Peroxyessigsäure | |
| R–CS–OH R–CS–OH R–CO–SH R–CO–SH R–CS–SH R–CS–SH |
 |
Thiocarbonsäuren | Hydroxy(thiocarbonyl)- Thiocarboxy- - Sulfanylcarbonyl- Thiocarboxy- - (Dithiocarboxy)- - |
-carbothio-O-säure -thio-O-säure -carbothio-S-säure -thio-S-säure -carbodithiosäure -dithiosäure |
|
| R–SO2–OH |  |
Sulfonsäuren | Sulfo- | -sulfonsäure | z. B. Benzolsulfonsäure |
| R–SO–OH |  |
Sulfinsäuren | Sulfino- | -sulfinsäure | |
| R1–CO–S–R2 |  |
Thiolester | R1oyl-thio- | S-R2yl-R1-thioate | |
| R–S–OH | Sulfensäuren | Sulfeno- | -sulfensäure | ||
| R1–SO–R2 | 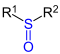 |
Sulfoxide | sulfinyl- | -sulfoxid | z. B. Dimethylsulfoxid |
| R–COO−M+ R–COO−M+ |
 |
Carbonsäuresalze | Metallcarboxylato- - |
Metall-...-carboxylat Metall-...-oat |
z. B. Acetat |
| R–SO2–O−M+ | Sulfonsäuresalze | Metallsulfonato- | Metall-...-sulfonat | ||
| R–SO–O−M+ |  |
Sulfinsäuresalze | Metallsulfinato- | Metall-...-sulfinat | |
| R–S–O−M+ | Sulfensäuresalze | Metallsulfenato- | Metall-...-sulfenat | ||
| R1–CO–O–CO–R2 |  |
Carbonsäureanhydride | - | ...-säure...-säureanhydrid bei gleichen Säuren: ...-säureanhydrid |
z. B. Essigsäureanhydrid |
| R1–CO–O–R2 | Carbonsäureester | (R yl-)oxycarbonyl |
(R yl-)...-carboxylat (R yl-)...-oat - |
z. B. Ethylacetat | |
| R1–SO2–O–R2 | Sulfonsäureester | (R yl-)oxysulfonyl- | (R yl-)...-sulfonat | ||
| R–O–NO2 | Salpetersäureester | -nitrat | z. B. Nitroglycerin, Nitrocellulose | ||
| R–CO–X R–CO–X |
 |
Carbonsäurehalogenide | Halogencarbonyl- - |
-carbonylhalogenid -oylhalogenid |
z. B. Benzoylchlorid |
| R–SO2–X | Sulfonsäurehalogenide | Halogensulfonyl- | -sulfonylhalogenid | ||
| R–CO–NH2 R–CO–NH2 |
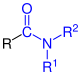 |
Carbonsäureamide | Carbamoyl- - |
-carboxamid -amid |
|
| R–SO2–NH2 |  |
Sulfonsäureamide | Sulfamoyl- | -sulfonamid | |
| R1–CO–NR2–CO–R3 | 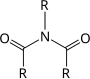 |
Imide | |||
| R–CO–NH–NH2 R–CO–NH–NH2 |
 |
Carbonsäurehydrazide | Hydrazinocarbonyl- | -carbohydrazid -ohydrazid |
|
| R–C≡N R–C≡N |
Nitrile | Cyan- - |
-carbonitril -nitril |
z. B. Acetonitril | |
| R–CO–H R–CO–H |
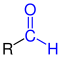 |
Aldehyde | Formyl- Oxo- |
-carbaldehyd -al |
z. B. Formaldehyd, Acetaldehyd |
| R–CS–H R–CS–H |
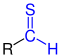 |
Thioaldehyde | Thioformyl- Thioxo- |
-carbothialdehyd -thial |
|
| R1–CO–R2 |  |
Ketone | Oxo- | -on | z. B. Aceton |
| R1–CS–R2 | 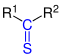 |
Thioketone | Thioxo- | -thion -thioketon |
|
| R1R2–C=N–OH |  |
Oxime | Hydroxyimino- | -aloxim -(carb)aldehydoxim -onoxim |
|
| R1R2–C=N–NH2 |  |
Hydrazone | Hydrazono- | -alhydrazon -(carb)aldehydhydrazon -onhydrazon |
|
| R–OH | Alkohole und Phenole | Hydroxy- | -ol | Alkohole z. B. Methanol, Ethanol, Isopropanol, Phenol | |
| R–SH | Thiole | Sulfanyl- alt: Mercapto- |
-thiol -mercaptan |
Thioalkohole, Thiophenole z. B. Methylmercaptan | |
| R–NH2 | 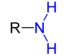 |
Amine | Amino- | -amin | z. B. Anilin, Aminosäuren |
| R1R2–C=N–R3 | 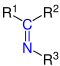 |
Imine | Imino- | -imin | |
| R–NH–NH2 | Hydrazine | Hydrazino- | -hydrazin | ||
| R1–O–R2 | Ether | (R2yl)-oxy- | (R1yl)-(R2yl)-ether | z. B. Diethylether, Dioxan | |
| R1–S–R2 | Thioether | (R2yl)-thio- | (R1yl)-(R2yl)-sulfid |
Funktionelle Gruppen ohne Priorität
Grundsätzlich nur als Vorsilben (Präfixe) werden folgende funktionelle Gruppen verwendet:
| Halbstrukturformel | Strukturformel | Stoffklasse | Vorsilbe | Beispiele |
|---|---|---|---|---|
| R–X | Halogenkohlenwasserstoffe | Halogen- | Fluorchlorkohlenwasserstoffe z. B. Frigen, Chloroform | |
| R–NO2 |  |
Nitroverbindungen | Nitro- | Nitrite z. B. Trinitrotoluol (TNT) |
| R–NO | Nitrosoverbindungen | Nitrosyl- | ||
| R1–NN–R2 |  |
Azoverbindungen | Azo- | Azofarbstoffe z. B. Gelborange S |
| R1R2–CNN | 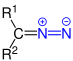 |
Diazoverbindungen | Diazo- | z. B. Diazomethan |
| R–NN+ Z− | Diazoniumsalze | Diazonium- | ||
| R–NC | Isocyanide | Isocyan- | ||
| R–OCN | Cyanate | Cyanato- | ||
| R–NCO | Isocyanate | Isocyanato- | ||
| R–SCN | Thiocyanate | Thiocyanato- | ||
| R–NCS | Isothiocyanate | Isothiocyanato- | ||
| R–OOH | Hydroperoxide | Hydroperoxy- | ||
| R1–OO–R2 | Peroxide | (R-)dioxy- |
Sonderfall Mehrfachbindungen
Ebenfalls zu den funktionellen Gruppen gerechnet werden die Mehrfachbindungen zwischen zwei Kohlenstoffatomen:
| Halbstrukturformel | Name | Vorsilbe | Endung | Beispiele |
|---|---|---|---|---|
| R–C=C–R | Doppelbindung | „-enyl“ | „-en“ | z. B. Ethen |
| R–C≡C–R | Dreifachbindung | „-inyl“ | „-in“ | z. B. Ethin |
Aus Sicht der Nomenklatur werden Mehrfachbindungen aber im Allgemeinen als Teil des Stammsystems aufgefasst.
Alternative Nomenklatursysteme
Neben diesem Nomenklatursystem gibt es noch weitere, weniger gebräuchliche oder veraltete Nomenklatursysteme. Eines davon ist z. B. die radikofunktionelle Nomenklatur, nach der z. B. Chlormethan als Methylchlorid oder Ethanol als Ethylalkohol bezeichnet werden.
Einzelnachweise
- ↑ Eintrag zu functional group. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.F02555.
- ↑ Rainer Beckert et al.: Organikum. 22. Auflage. Wiley-VCH, Weinheim 2004, ISBN 3-527-31148-3, S. 137.
Literatur
- Günter Baars, Roland Franik, Walter Jansen, Hans Pickel, Georg Schwedt, Herbert Sommerfeld: Handbuch der experimentellen Chemie: Sekundarbereich II. Band 10: Funktionelle Gruppen, Fette, Farbstoffe. (Herausgeber: Walter Jansen, Rudolf G Weissenhorn, Wolfgang Glöckner), Aulis, Hallbergmoos 2008, ISBN 978-3-7614-2388-2.
- Dieter Hellwinkel: Die systematische Nomenklatur der organischen Chemie: Eine Gebrauchsanweisung. 4. Auflage. Springer, Berlin 1998, ISBN 3-540-63221-2.