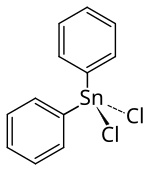
Diphenylzinndichlorid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Diphenylzinndichlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C12H10Cl2Sn | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 343,82 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
333–337 °C[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten |
| ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Diphenylzinndichlorid ist eine chemische Verbindung aus der Gruppe der zinnorganischen Verbindungen.
Geschichte
Über die erste Darstellung von Diphenylzinndichlorid wurde bereits 1878 von B. Aronheim berichtet. Dazu wurde Zinntetrachlorid mit Diphenylquecksilber über 12 Stunden in der Siedehitze in Ligroin umgesetzt:[2]
Gewinnung und Darstellung
Diphenylzinndichlorid kann technisch durch schrittweise Abspaltung von Phenylgruppen aus Tetraphenylzinn mit Chlor hergestellt werden:[4]
Auch durch Komproportionierung von Tetraphenylzinn mit Zinntetrachlorid (Kocheshkov-Umlagerung) lässt sich Diphenylzinndichlorid herstellen:[4][5]
Eigenschaften
Physikalische Eigenschaften
Diphenylzinndichlorid löst sich leicht in Ether, Alkohol und Ligroin, im Wasser dagegen nur wenig unter teilweiser Zersetzung.[2] Im 13C-Kernresonansspektrum (NMR) zeigt Diphenylzinndichlorid folgende Signale:[6]
| Sn–C1– | –C2 | –C3 | –C4 | |
|---|---|---|---|---|
| ppm | 137,1 | 135,2 | 129,8 | 131,7 |
| J(13C–119Sn) | 785 | 64,7 | 86,3 | 17,5 |
Im 119Sn–NMR liefert es ein Signal bei −26,4 ppm. Im Kristall liegt der Zinn-Kohlenstoff-Abstand bei 2,112(5) und der Zinn-Chlor-Abstand bei 2,345(2) Å.[6] Es hat in Benzol ein Dipolmoment von 4,21 Debye.[7]
Chemische Eigenschaften
An feuchter Luft oder in Wasser hydrolysiert Diphenylzinndichlorid zu Diphenylzinnhydroxychlorid, aus welchem sich in Gegenwart von Salzsäure wieder Diphenylzinndichlorid zurückbildet:
Während in Gegenwart von Ammoniak oder Natronlauge Diphenylzinnoxid entsteht, werden durch Einwirkung von konzentrierten Säuren, wie Salzsäure Benzol oder entsprechende Substitutionsprodukte abgespalten:[2]
Verwendung
Durch Umsetzung von Diphenylzinndichlorid mit Diethylaluminiumhydrid in Diethylether kann Diphenylzinndihydrid gewonnen werden:[8]

Sicherheitshinweise
Diphenylzinndichlorid hat einen Flammpunkt von 113 °C.[1]
Weblinks
Einzelnachweise
- ↑ a b c d e f g h Datenblatt Diphenyltin dichloride bei Sigma-Aldrich, abgerufen am 22. September 2018 (PDF).
- ↑ a b c d e B. Aronheim: Synthese der Zinnphenylverbindungen. In: Justus Liebig’s Annalen der Chemie. Band 194, Nr. 2-3, 1878, S. 145–175, doi:10.1002/jlac.18781940202.
- ↑ Phenylzinnverbindungen [MAK Value Documentation in German language, 2010]. In: The MAK Collection for Occupational Health and Safety. 31. Januar 2012, doi:10.1002/3527600418.mb240668verd0048.
- ↑ a b G. J. M. van der Kerk, J. G. A. Luijten, J. G. Noltes: Neue Ergebnisse der Organozinn-Forschung. In: Angewandte Chemie. Band 70, Nr. 10, 21. Mai 1958, S. 298–306, doi:10.1002/ange.19580701004.
- ↑ Alwyn George Davies: Organotin chemistry. Band 1. Wiley-VCH Verlag GmbH & Co. KGaA, 2004, ISBN 3-527-31023-1 (Seite 167 in der Google-Buchsuche).
- ↑ a b Cathrin Zeppek, Johann Pichler, Ana Torvisco, Michaela Flock, Frank Uhlig: Aryltin chlorides and hydrides: Preparation, detailed NMR studies and DFT calculations. In: Journal of Organometallic Chemistry. Band 740, September 2013, S. 41–49, doi:10.1016/j.jorganchem.2013.03.012.
- ↑ Jörg Lorberth, Heinrich Nöth: Dipolmomente einiger Organozinnchloride. In: Chemische Berichte. Band 98, Nr. 3, März 1965, S. 969, doi:10.1002/cber.19650980342.
- ↑ Wilhelm P. Neumann, Horst Niermann: Organozinnverbindungen, II. Darstellung von Organozinn-mono-, -di- und -tri-hydriden. In: Justus Liebigs Annalen der Chemie. Band 653, Nr. 1, 24. Mai 1962, S. 164, doi:10.1002/jlac.19626530119.








