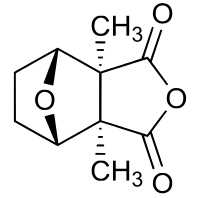
Cantharidin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Cantharidin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C10H12O4 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, orthorhombische Plättchen[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 196,20 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Dichte |
1,38 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Cantharidin, auch Kantharidin, ist ein Naturstoff und zählt zur Gruppe der Terpenoide. Es handelt sich dabei um ein giftiges Monoterpen mit für den Menschen tödlicher Wirkung.
Vorkommen
Cantharidin kommt in verschiedenen Käferarten, in Mitteleuropa dem Ölkäfer (Meloe proscarabaeus) vor. Benannt wurde es nach der Familie Cantharidae (Weichkäfer) bzw. dem früheren Gattungsnamen der Spanischen Fliege (Cantharis/Lytta vesicatoria), als deren Bestandteil es erstmals beschrieben wurde.[7]
Geschichte
Cantharidin wurde erstmals 1810 von Pierre-Jean Robiquet isoliert.[8] Nach Kriegsberichten soll die Giftwirkung des Cantharidins schon den Truppen Napoleons beim Ägyptenfeldzug zum Verhängnis geworden sein, die in den Sümpfen des ägyptischen Nildeltas Frösche gefangen und verspeist hatten. Diese ernährten sich vor allem von den besagten Käfern und lagerten das Cantharidin ein, ohne selbst Schaden daran zu nehmen.[9] Die ersten Beschreibungen des Gebrauchs in der Medizin stammen aus dem Altertum, zum Beispiel von Hippokrates und Plinius dem Älteren.[10][11]
Gewinnung und Darstellung
Die erste gelungene Synthese von Cantharidin wurde 1942 von Karl Ziegler veröffentlicht. Diese startete mit dem aus 1,3-Cyclohexadien und Dimethylmaleinsäureanhydrid gebildeten Additionsprodukt, gefolgt von einer durch Oxidation geöffneten Ethenbrücke zu einem Tetracarbonsäurederivat, welches dann durch Hunsdiecker-Reaktion und folgender Pyrolyse eine Hydrobromcantharsäure und in minimaler Menge Cantharidin ergaben.[11]
Nach mehreren verbesserten Synthesen veröffentlichte William G. Dauben 1980 ein einfaches Verfahren mit hoher Ausbeute. Dabei wird Furan unter hohem Druck mit einem Dimethylmaleinsäureanhydrid-Derivat umgesetzt, dessen Methylgruppen in einem Dihydrothiophenring stecken. Von dem entstehenden diastereomeren Exo-Endo-Gemisch, lässt sich das Exoderivat unter Hydrieren der Doppelbindung hydrogenolytisch zu Cantharidin aufspalten. Ein modifiziertes Verfahren von Paul A. Grieco liefert das Dimethylmaleinsäureanhydrid-Derivat aus Furan unter Zusatz von Lithiumperchlorat in Diethylether.[11]
Eigenschaften
Chemische Eigenschaften
Beim Cantharidin handelt es sich um ein Monoterpen, das in farblosen, orthorhombischen Plättchen kristallisiert.[1] Es hat eine Schmelztemperatur von 218 °C.[3] Es ist unlöslich in Wasser, löslich in Chloroform, Aceton und Ethanol.[1] In Essigsäure[12] und Alkalien (unter Bildung von Cantharidaten) ist es gut löslich.[13]
Die Verbindung besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Pnma (Raumgruppen-Nr. 62).[2]
Biochemische Eigenschaften
Cantharidin gilt in der traditionellen chinesischen Medizin als Anti-Krebsmedikament. Cantharidin inhibiert die Serin-/Threonin-spezifischen Protein-Phosphatasen 1 und 2A und gilt als Leitstruktur in der Entwicklung neuer Antitumormedikamente.[14]
Biologische Bedeutung

Cantharidin ist in der Hämolymphe einer Reihe von Käferarten enthalten, vor allem bei den Ölkäfern (Meloidae),[15] auch nach der Wirkung des Cantharidin auf die menschliche Haut „Blasenkäfer“ genannt, den Feuerkäfern (Pyrochroidae) und bei Vertretern der Familie der Scheinbockkäfer (Oedemeridae).[16] Die biologische Bedeutung ist dabei unterschiedlich. So setzen die Ölkäfer den Giftstoff vor allem als Wehrsekret ein, das bei einer potentiellen Bedrohung an den Beingelenken tropfenförmig ausgepresst wird (Reflexbluten).[7] Bei den Feuerkäfern stellt Cantharidin vor allem ein Lockpheromon dar, das die Männchen für die Weibchen attraktiv macht.[17][18] Auf die meisten anderen Insekten wirkt Cantharidin dagegen abschreckend, nur die Blumenkäfer (Anthicidae) werden ebenfalls angelockt, da sie auf diese Weise die Leichen von Ölkäfern finden können. Auch bei ihnen und den Feuerkäfern spielt Cantharidin eine Rolle bei der Paarung: die Weibchen überprüfen vor der Paarung den Cantharidingehalt der Vorratsbehälter unter den Flügeln der Männchen und machen davon ihre Paarungswilligkeit abhängig. Die Käfer können den Stoff allerdings nicht selbst produzieren, sondern entnehmen ihn den Ölkäfern.[17] Ebenfalls attraktiv wirkt Cantharidin auch auf einige Arten der Gnitzen (Ceratopogonida), einer Mückengruppe, die cantharidinhaltige Käferarten besaugen.[19]
Cantharidin ist ein starkes Reiz- und Nervengift, wodurch es als Wehrsekret sehr effektiv ist. Auf der Haut und vor allem auf den Schleimhäuten übt es eine starke Reizwirkung aus. Beim Menschen und bei anderen Wirbeltieren löst es die Bildung von Blasen und teilweise tiefen Nekrosen aus. Außerdem führt es zu Entzündungen und insbesondere zu einer starken Schädigung der Nieren. Wegen der ausgeprägten Toxizität ist die Einnahme von Cantharidin nicht zu empfehlen.[7][20]
Sequestrierung
Einige Tierarten haben sich darauf spezialisiert, Ölkäfer zu verzehren und deren Gift in ihrem Gewebe einzulagern, um sich oder andere Artangehörige damit vor Prädatoren zu schützen. Dazu gehört auch die Sporngans (Plectropterus gambensis), einer der wenigen Giftvögel, deren Fleisch daher für Menschen unverzehrbar ist.[21][22]
Anwendung am Menschen
Cantharidin galt als potenzsteigerndes Mittel, das beim Mann eine langanhaltende Erektion herbeiführen soll. Die Anwendung ist umstritten, vor allem, da die Erektion sehr schmerzhaft sein kann, die Dosierung sehr schwierig ist. Erreicht werden soll sie durch Einreiben der Genitalien oder Einnahme von aufgelöstem Cantharidin, wobei dafür meistens die Spanische Fliege (Lytta vesicatoria) zermahlen wird.
Anwendung fand Cantharidin vor allem bei der Hautreiztherapie sowie als Mittel zur Entfernung von Warzen, häufig in Form eines transdermalen Pflasters (Cantharidenpflaster). Aufgrund der stark reizenden Wirkung auf die Haut wird Cantharidin in der Pharmakologie experimentell beim Hautblasenversuch (Cantharidin-Test) verwendet. Dabei wird durch Cantharidin eine Hautblase hervorgerufen, in deren Flüssigkeit die Konzentration von Arzneistoffen gemessen werden kann. Aufgrund der Wirkung bei Überdosierung sollte es nur nach Absprache mit einem Arzt angewendet werden.
Die für den Menschen geringste tödliche Dosis LDLo liegt bei etwa 0,5 mg/kg Körpergewicht. Im antiken Griechenland wurde das Gift neben dem Schierlingsbecher zur Vollstreckung von Todesurteilen verwendet.
Im Juli 2023 erteilte die Food and Drug Administration (FDA) Cantharidin unter dem Präparatennamen Ycanth eine Zulassung für die lokale Behandlung von Molluscum contagiosum (Dellwarzen) bei erwachsenen und pädiatrischen Patienten ab 2 Jahren. Die Anwendung erfolgt durch medizinisches Personal je nach Bedarf alle 3 Wochen als einmaliges Auftragen auf die betroffenen Hautstellen des Patienten.[23] Die häufigsten Nebenwirkungen an der Applikationsstelle sind Blasenbildung, Schmerzen, Juckreiz, Schorfbildung, Rötungen, Verfärbungen, Ödeme und Erosion der Haut. Bei versehentlicher oraler Verabreichung können lebensbedrohliche oder tödliche Vergiftungen auftreten.[23]
Literatur
- Friedrich Eiden: Cantharidin. Hochzeitsgabe, Schutz- und Lockstoff, Blasenzieher und Enzymhemmer. In: Chemie in unserer Zeit. Band 40, 2006, S. 12–19.
Weblinks
Einzelnachweise
- ↑ a b c d e Eintrag zu Cantharidin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. November 2014.
- ↑ a b Margareta Zehnder, Ulf Thewalt: Struktur von Cantharidin, C10H12O4. In: Helvetica Chimica Acta. Band 60, Nr. 3, 1977, S. 740–742, doi:10.1002/hlca.19770600307.
- ↑ a b c d Datenblatt Cantharidin (PDF) bei Carl Roth, abgerufen am 12. Dezember 2007.
- ↑ Yalkowsky SH, Dannenfelser RM; The AQUASOL dATAbASE of Aqueous Solubility. Ver 5. Tucson, AZ: Univ AZ, College of Pharmacy (1992)
- ↑ a b Datenblatt Cantharidin bei Sigma-Aldrich, abgerufen am 15. März 2011 (PDF).
- ↑ Toxicon. Vol. 23, S. 36, 1985.
- ↑ a b c John L. Capinera: Encyclopedia of Entomology. Springer Science & Business Media, 2008, ISBN 978-1-4020-6242-1, S. 3136 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Reinhard W. Hoffmann: Classical Methods in Structure Elucidation of Natural Products. Wiley, 2018, ISBN 978-3-906390-73-4, S. 28 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Spektrum der Wissenschaft: Die chemischen Öko-Kampfstoffe der Insekten, abgerufen am 19. November 2023
- ↑ Edwin Stanton Faust: Die Tierischen Gifte. Vieweg-Teubner Verlag, 1906, ISBN 978-3-663-19878-9, S. 207 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Fritz Eiden: Cantharidin: Hochzeitsgabe, Schutz‐ und Lockstoff, Blasenzieher und Enzymhemmer. In: Chemie in unserer Zeit. Band 40, Nr. 1, 2006, S. 12–19, doi:10.1002/ciuz.200600354.
- ↑ John Biddle: Materia Medica, for the Use of Students. BoD – Books on Demand, 2023, ISBN 978-3-368-84102-7, S. 364 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Alfred Henry Allen: Commercial Organic Analysis. Philadelphia Book Company, 1886, S. 450 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Yulin Ren, A. Douglas Kinghorn: Antitumor potential of the protein phosphatase inhibitor, cantharidin, and selected derivatives. In: Bioorg. Med. Chem. Band 32, 2021, doi:10.1016/j.bmc.2021.116012, PMID 33454654 (englisch).
- ↑ Carolina Bravo, Paloma Mas-Peinado, Luis Miguel Bautista, Guillermo Blanco, Juan Carlos Alonso, Mario García-París: Cantharidin is conserved across phylogeographic lineages and present in both morphs of Iberian Berberomeloe blister beetles (Coleoptera, Meloidae). In: Zoological Journal of the Linnean Society. Band 180, Nr. 4, 2017, S. 790–804, doi:10.1093/zoolinnean/zlw016.
- ↑ Kosei Hashimoto, Fumio Hayashi: Cantharidin world in nature: a concealed arthropod assemblage with interactions via the terpenoid cantharidin. In: Entomological Science. Band 17, Nr. 4, 2014, S. 388–395, doi:10.1111/ens.12074.
- ↑ a b P. J. Gullan, P. S. Cranston: The Insects. Wiley, 2009, ISBN 1-4051-4457-2, S. 364 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ David Grimaldi, Michael S. Engel: Evolution of the insects. Cambridge University Press, 2005, ISBN 978-0-521-82149-0, S. 390 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ M. Frenzel, K. Dettner, D. Wirth, J. Waibel, W. Boland: Cantharidin analogues and their attractancy for ceretopogonid flies (Diptera: Ceratopogonidae). In: Experientia. Band 48, Nr. 1, 1992, S. 106–111, doi:10.1007/BF01923620.
- ↑ P. Cotovio, C. Silva, M. Guedes Marques, F. Ferrer, F. Costa, A. Carreira, M. Campos: Acute kidney injury by cantharidin poisoning following a silly bet on an ugly beetle. In: Clinical Kidney Journal. Band 6, Nr. 2, 2013, S. 201–203, doi:10.1093/ckj/sft001, PMID 26019851.
- ↑ Stefan Bartram, Wilhelm Boland: Chemistry and ecology of toxic birds. In: ChemBioChem. Band 2, Nr. 11, November 2001, S. 809–811, doi:10.1002/1439-7633(20011105)2:11<809::AID-CBIC809>3.0.CO;2-C (englisch).
- ↑ Karem Ghoneim: Cantharidin toxicosis to animal and human in the world: A review. In: Standard Res. J. Toxicol. Environ. Health Sci. Band 1, 2013, S. 1–22 (englisch, semanticscholar.org [PDF]).
- ↑ a b FDA approves first treatment for molluscum contagiosum. In: fda.gov. 24. Juli 2023, abgerufen am 30. August 2023 (englisch).


