8-Hydroxychinolin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 8-Hydroxychinolin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C9H7NO | ||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 145,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,034 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
267 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
8-Hydroxychinolin, auch 8-Chinolinol, ist eine heterocyclische organische Verbindung, die sich vom Chinolin ableitet und zu den Phenolen zählt. Die Substanz ist ein Komplexbildner, der auch als Desinfektionsmittel, Antiseptikum und Antimykotikum verwendet wird.
Eigenschaften
8-Hydroxychinolin ist eine weiße, geruchlose, brennbare feste Substanz, die bei Raumtemperatur nahezu unlöslich in Wasser ist.[3] Die Verbindung besitzt sowohl basische als auch saure Eigenschaften. 8-Hydroxychinolin zersetzt sich unter Lichteinwirkung.[3]
Verwendung

8-Hydroxychinolin und seine Derivate wurden in der Vergangenheit als Mittel gegen Durchfall (Diarrhoe) eingesetzt.
Nach längerer hochdosierter Gabe von 8-Hydroxychinolinderivaten jedoch wurden in Japan im Jahr 1952 starke Nebenwirkungen beobachtet, die dann als SMON-Krankheit (subakute myelooptische Neuropathie oder Myelitis japonica) bezeichnet wurden. Symptome waren neuronale Ausfallserscheinungen, Blasen-, Mastdarm- und Sehstörungen.[7]
Äußerlich angewendet dagegen fanden und finden 8-Hydroxychinolin und seine Derivate (z. B. das Sulfatsalz[8]) weiter Gebrauch, u. a. als Mund- und Hautdesinfektionsmittel (Sulfachin, Chinosol, Cryptonol) sowie als Antimykotikum, letzteres auch im Gartenbau. Chinosol ist in Tablettenform aktuell nicht mehr erhältlich.[9]
In der analytischen Chemie kann 8-Hydroxychinolin außerdem zur quantitativen Metallbestimmung verwendet werden.
Die Substanz wurde im Zweiten Weltkrieg als Stabilisator von Wasserstoffperoxid in einem Raketentreibstoff (T-Stoff) verwendet.[10]
Sicherheitshinweise
Im Tierversuch löst 8-Hydroxychinolin bei Kaninchen eine Hautreizung, Hornhauttrübung sowie eine Rötung der Bindehäute aus. Die Angaben zur Sensibilisierung (Auslösung von Allergien) sind teils widersprüchlich, halogenierte Derivate wirken jedoch belegt sensibilisierend. 3 g 8-Hydroxychinolin bewirkten bei einem Kind Zyanose, Atemnot, Krämpfe, Störungen der Leber- und Nierenfunktion, Lungenödeme, und massive innere Blutungen, die mit dem Tod des Kindes endeten. Die Gabe von 3 bis 6 g sollen bei vier Testpersonen nach Gabe einer Lösung des Hydrochlorids ähnliche Symptome ausgelöst haben, während neuere Studien diese Ergebnisse anzweifeln. Dieselben Symptome wurden jedoch bei Mäusen (Dosis 48 mg/kg) und Hunden (Gabe von mehr als 10 mg/kg) berichtet und verifiziert.[3] Im Jahr 1952 wurde durch 8-Hydroxychinolinderivate in Japan die SMON-Krankheit ausgelöst (siehe Verwendung).
Oxinate
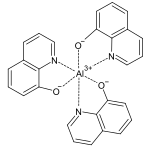
Die komplexen Metallsalze des Oxins werden als Oxinate bezeichnet. Mit vielen zwei- und mehrwertigen Metallionen bildet 8-Hydroxychinolin in Wasser unlösliche Chelatkomplexe, so dass diese zur quantitativen Metallbestimmung verwendet werden können.[11] Da die Oxinate bei verschiedenen pH-Werten unterschiedliche Löslichkeit besitzen, kann das Oxin auch zur Trennung verschiedener Kationen, etwa von Kupfer und Cadmium, eingesetzt werden.[12] Mit Aluminiumionen bildet sich das fluoreszierende Aluminium-tris(8-hydroxychinolin) (Alq3).[13]
Nachweis
In ammoniakalischer Lösung fällt mit Mg2+-Ionen eine schwerlösliche gelbgrünliche Komplexverbindung aus. Diese Reaktion ist geeignet, um Magnesiumionen von Alkalimetallionen zu trennen. Viele andere Schwermetallionen stören den Nachweis.[14]
Einzelnachweise
- ↑ Eintrag zu OXYQUINOLINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 21. März 2020.
- ↑ a b c d Eintrag zu 8-Chinolinol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. April 2014.
- ↑ a b c d e f g h i Eintrag zu 8-Hydroxychinolin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Dezember 2019. (JavaScript erforderlich)
- ↑ Registrierungsdossier zu Quinolin-8-ol (Abschnitt Vapour pressure) bei der Europäischen Chemikalienagentur (ECHA), abgerufen am 16. Juni 2017.
- ↑ Eintrag zu Quinolin-8-ol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 29. Dezember 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag zu Oxyquinoline in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 16. Juni 2017. (Seite nicht mehr abrufbar)
- ↑ Eintrag 8-Hydroxychinolin-Derivate im Lexikon der Biologie, Spektrum Akademischer Verlag, Heidelberg.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Bis(8-hydroxychinolinium)sulfat: CAS-Nr.: 134-31-6, EG-Nr.: 205-137-1, ECHA-InfoCard: 100.004.671, GESTIS: 510258, PubChem: 517000, ChemSpider: 8318, Wikidata: Q27263388.
- ↑ Chinosol 1,0 g Tabletten (PZN: 207155) - Beipackzettel / Informationen. Apotheken-Umschau ( vom 28. Mai 2019 im Internet Archive).
- ↑ Botho Stüwe: Peenemünde-West. Bechtermünz-Verlag 1998, ISBN 3-8289-0294-4, S. 220.
- ↑ V. K. Ahluwalia, S. Dhingra, A. Gulati: College Practical Chemistry , S. 123–124, 1. Auflage, Universities Press, 2005, ISBN 978-81-7371-506-8.
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Oxinate im Lexikon der Chemie.
- ↑ R. Katakura, Y. Koide: Configuration-Specific Synthesis of the Facial and Meridional Isomers of Tris(8-hydroxyquinolinate)aluminum (Alq3), in: Inorg. Chem., 2006, 45, S. 5730–5732; doi:10.1021/ic060594s.
- ↑ E. Gerdes: Qualitative Anorganische Analyse: Ein Begleiter für Theorie und Praxis, S. 130, 2. Auflage, Springer Verlag, Berlin, 2009, ISBN 3-540-67875-1.




