Caprolactam
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Caprolactam | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H11NO | ||||||||||||||||||
| Kurzbeschreibung |
weiße Schuppen[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 113,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,02 g·cm−3 (75 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
270 °C[1] | ||||||||||||||||||
| Löslichkeit |
gut in Wasser (4650 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
| ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Caprolactam, genauer ε-Caprolactam, ist ein wirtschaftlich bedeutsames Lactam, das jährlich im Megatonnen-Maßstab produziert wird. Es dient als Ausgangsstoff für die Herstellung von Polyamid 6 (Perlon).
Geschichte
Zum ersten Mal wurde Caprolactam 1899 von Siegmund Gabriel und Theodor A. Maass durch die Cyclisierung von ε-Aminocapronsäure hergestellt.[5] Ein Jahr später[6] entdeckte der spätere Nobelpreisträger Otto Wallach die bis heute wichtigste Synthese über die Beckmann-Umlagerung von Cyclohexanonoxim. Ein wirtschaftlicher Durchbruch ergab sich durch die Entdeckung der Reaktion von Caprolactam zu Polycaprolactam durch Paul Schlack (I.G. Farben) im Jahr 1938. Im Jahr 1989 lag die Produktionsmenge von Caprolactam näherungsweise bei etwa 2 Millionen Tonnen, Im Jahr 2016 bei 5,5 Millionen Tonnen.[4]
Herstellung von Caprolactam
Für Caprolactam sind zahlreiche verschiedene Herstellungsrouten bekannt. Alle kommerziellen Herstellungsprozesse laufen aktuell auf Basis von Benzol aus BTEX und benutzen die Beckmann-Umlagerung. Dabei fallen enorme Mengen an Ammoniumsulfat als Rest an; 40 bis 50 % des global hergestellten Ammoniumsulfats entsteht bei der Herstellung von Caprolactam. Die Prozesse lassen sich in zwei Gruppen unterteilen.[4]
Herstellung über Cyclohexanon
Fast alle kommerziellen Herstellungsprozesse verlaufen über Cyclohexanon als Zwischenstufe; 98 % des Caprolactams werden so hergestellt.[4] Alle davon lassen sich grob in drei Schritte einteilen:
- Aus Benzol wird Cyclohexanon hergestellt
- Das Cyclohexanon wird mittels Hydroxylamin in Cyclohexanonoxim überführt
- Das Cyclohexanonoxim reagiert in Gegenwart von Schwefelsäure in einer Beckmann-Umlagerung zu ε-Caprolactam
Für die Herstellung von Cyclohexanon aus Benzol gibt es verschiedene Reaktionswege, die praktiziert werden. Beispielsweise kann Benzol zunächst katalytisch hydriert und anschließend oxidiert werden.
Für die Herstellung des Hydroxylamins im zweiten Prozessschritt werden klassischerweise Varianten des Raschig-Prozesses benutzt. Da hier allerdings große Mengen des Abfallprodukts Ammoniumsulfat anfallen (bis zu 2,7 Tonnen pro Tonne Oxim), haben sich auch andere atomökonomischere Methoden entwickelt.
Auch beim dritten Prozessschritt entsteht Ammoniumsulfat als Abfallprozess, sodass die Gesamtmenge an Nebenprodukten bei 2 bis 4,5 Tonnen pro Tonne Caprolactam liegt. Dieser Reaktionsschritt ist stark exotherm, die Reaktionsenthalpie liegt bei −105,1 kJ·mol−1.[7] Daher muss kontinuierlich gekühlt werden.
Photooximierung
Diese Herstellung kommt ohne Cyclohexanon als Zwischenprodukt aus und lässt sich ebenfalls in drei Schritte einteilen:
- Aus Benzol wird in einer katalytischen Hydrierung Cyclohexan hergestellt
- Cyclohexan wird mittels Nitrosylchlorid und Chlorwasserstoff zu Cyclohexanonoxim (genauer: zu Cyclohexanonoxim-Hydrochlorid) umgesetzt
- Zuletzt folgt analog zu den anderen Prozessen die Beckmann-Umlagerung von Cyclohexanonoxim zu ε-Caprolactam in Schwefelsäure
Bei diesem Prozess entstehen pro Tonne Caprolactam nur 1,55 Tonnen Ammoniumsulfat. Allerdings sind teure Reaktoren z. B. aus Titan nötig, da Zwischenprodukte wie Nitrosylchlorid in diesem Prozess sehr korrosiv sind.
Recycling von Polycaprolactam
Caprolactam kann außerdem durch Recycling aus Polycaprolactam durch Depolymerisation gewonnen werden. Das geschieht meist in einem Kessel mit Heißdampf, Basen und Katalysatoren wie Phosphorsäure bei Atmosphärendruck. Es kann auch ohne Katalysator bei hohen Drücken gearbeitet werden. Das Roh-Caprolactam wird dann durch Destillation aufgereinigt.[4] In weiteren Verfahren kann Phosphorsäure zur sauren Hydrolyse, Natriumhydroxid zur basischen Hydrolyse oder heißes Wasser (high-temperature water, HTW) zur neutralen Hydrolyse genutzt werden. Ebenso können Alkoholyse und Ammonolyse sowie Depolymerisation in ionischen Flüssigkeiten genutzt werden.[8]
Herstellung aus nachwachsenden Rohstoffen
Es wurden zahlreiche Anstrengungen unternommen, um die Herstellung von Caprolactam aus nachwachsenden Rohstoffen zu bewerkstelligen. Dabei lassen sich drei verschiedene Ansätze unterscheiden:
Eine Möglichkeit liegt darin, die aktuellen Prozesse weiter zu benutzen und den Ausgangsstoff Benzol durch katalytische Pyrolyse aus Biomasse herzustellen. Die zweite Möglichkeit ist es, neue chemische Syntheserouten zum Produkt Caprolactam zu finden, die auf Ausgangsstoffen basieren, die leicht biobasiert zu erzeugen sind. Es sind mittlerweile einige solche Routen bekannt. So kann Caprolactam beispielsweise sehr selektiv und in nur drei Schritten aus biobasiertem Hydroxymethylfurfural hergestellt werden. Die letzte Möglichkeit besteht in der fermentativen Herstellung von Caprolactamvorläufern, die dann „klassisch“ chemisch weiterverarbeitet werden. Es gibt zum Beispiel Syntheserouten ausgehend von L-Lysin oder 1,3-Butadien, die beide fermentativ hergestellt werden können.[4]
Stand 2017 war noch kein biobasiertes Verfahren wirtschaftlich konkurrenzfähig.[4]
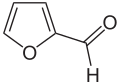
- Strukturformeln einiger Vorläufer von Caprolactam, die biobasiert hergestellt werden können
- Hydroxymethylfurfural
- Furfural
- 1,3-Butadien
- L-Lysin
Treibhausgasemissionen bei der Produktion
Die Produktion von Caprolactam kann je nach Verfahren große Mengen an Distickstoffmonoxid produzieren, ein hochwirksames Treibhausgas. Diese Emissionen können durch vergleichsweise günstige Abgasnachbehandlungstechnologien vermieden werden. Eine Studie, die vom Öko-Institut im Auftrag des Bundesministerium für Wirtschaft und Klimaschutz durchgeführt wurde, gibt an, dass in Anlagen mit einem hohen Ausstoß pro Tonne Caprolactam bis zu neun Kilogramm Distickstoffmonoxid erzeugt werden.[9]
In den meisten Staaten sind diese Emissionen nicht reguliert, daher wird eine Abgasnachbehandlung häufig nicht eingesetzt. Distickstoffmonoxid-Emissionen der Caprolactam-Herstellung sind nicht Teil des EU-Emissionshandels, andere Chemikalien mit ähnlichen Emissionen hingegen schon.[10]
Eigenschaften
Physikalische Eigenschaften
Bei Raumtemperatur bildet ε-Caprolactam weiße Kristalle, die gut in Wasser löslich und hygroskopisch sind und einen charakteristischen Geruch haben.[4] Es wird üblicherweise im geschmolzenen Zustand bei Temperaturen zwischen 75 und 90 °C unter Feuchtigkeits- und Sauerstoffausschluss gelagert.[4]
Chemische Eigenschaften
Caprolactam ist löslich in polaren und aromatischen Lösungsmitteln und wenig löslich in längerkettigen aliphatischen Kohlenwasserstoffen.[4] In Gegenwart von Wasser hydrolysiert es bei 260–270 °C zu ε-Aminocapronsäure.[4] Beim stärkeren Erhitzen von Caprolactam in Gegenwart von Sauerstoff zersetzt sich dieses unter Bildung von u. a. Ammoniak und Stickoxiden, bei Sauerstoffabstinenz ist es hitzestabil.
Von herausragender Bedeutung ist die Möglichkeit der Polymerbildung, bei der Polycaprolactam (Polyamid 6) entsteht. Diese erfolgt üblicherweise über ringöffnende Polymerisation. Weiterhin kann aus Caprolactam durch Nitrierung und anschließende Reduktion Aminocaprolactam hergestellt werden. Daneben geht Caprolactam alle typischen Reaktionen der Lactame ein.[4]
Verwendung

Caprolactam wird industriell nahezu ausschließlich zur Herstellung von Polycaprolactam (Polyamid 6), das auch unter dem Markennamen Perlon bekannt ist, genutzt.[11] Daraus werden beispielsweise einfache Textilfasern und Folien, aber auch hochwertige und widerstandsfähige Garne für technische Anwendungen hergestellt.
Kleinere Mengen Caprolacatam werden auch für die chemische Synthese genutzt. Beispielsweise kann aus Caprolactam über die Zwischenstufe des Aminocaprolactams die Aminosäure Lysin hergestellt werden.[4]
Literatur
- Johan Tinge, Marijke Groothaert, Hans op het Veld, Josef Ritz, Hugo Fuchs, Heinz Kieczka & William C. Moran: Caprolactam. In: Ullmann’s Encyclopedia of industrial chemistry. Wiley-VCH, Weinheim 2018, doi:10.1002/14356007.a05_031.pub3.
- Gerd Dahlhoff, John P. M. Niederer & Wolfgang F. Hoelderich: ϵ-Caprolactam: new by-product free synthesis routes. In: Catalysis Reviews: Science and Engineering. Band 43, Nr. 4, 2001, S. 381–441, doi:10.1081/CR-120001808.
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu epsilon-Caprolactam in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ Eintrag zu ε-caprolactam im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 105-60-2 bzw. ε-Caprolactam), abgerufen am 20. Februar 2020.
- ↑ a b c d e f g h i j k l m Ullmann's Encyclopedia of Industrial Chemistry. 1. Auflage. Wiley, 2000, ISBN 978-3-527-30385-4, doi:10.1002/14356007.a05_031.pub3.
- ↑ Siegmund Gabriel, Theodor A. Maass: Ueber ε‐Amidocapronsäure. In: Berichte der deutschen chemischen Gesellschaft. Band 32, 1899, S. 1266–1272, doi:10.1002/cber.189903201205.
- ↑ Caprolactam. 19. September 2016, abgerufen am 24. Oktober 2019.
- ↑ A. A. Kozyro, L. I. Marachuk, A. P. Krasulin, I. A. Yursha, G. Ya. Kabo: Thermodynamic properties of cyclohexanone oxime and ε-caprolactam. in J. Appl. Chem. USSR. 62, 1989, S. 547–550.
- ↑ Ann-Joelle Minor, Ruben Goldhahn, Liisa Rihko-Struckmann, Kai Sundmacher: Chemical Recycling Processes of Nylon 6 to Caprolactam: Review and Techno-Economic Assessment. In: Chemical Engineering Journal. Band 474, 2023, S. 145333, doi:10.1016/j.cej.2023.145333.
- ↑ Öko-Institut: Mitigation potentials for emissions of nitrous oxide from chemical industry in industrialised countries world-wide. 28. September 2023, abgerufen am 23. Oktober 2023.
- ↑ Hanno Böck: The avoidable Super-Greenhouse-Gas from Fertilizer, Nylon, and Vitamin B3 production. In: Industry Decarbonization Newsletter. März 2023, abgerufen am 23. Oktober 2023.
- ↑ Gerd Dahlhoff, John P. M. Niederer, Wolfgang F. Hoelderich: ϵ-Caprolactam: new by-product free synthesis routes. In: Catalysis Reviews. Band 43, Nr. 4, 2001, S. 381–441, doi:10.1081/CR-120001808.