Kuldioxid
| Kuldioxid | |||
|---|---|---|---|
 | |||
| Generelt | |||
| Andre navne | Carbondioxid Kultveilte | ||
| Fremtræden | Farveløs | ||
| SMILES | O=C=O | ||
| Kemiske egenskaber | |||
| Massefylde | 1562 kg/m3 (fast form ved 1 atm og −78.5 °C) 770 kg/m3 (flydende form ved 56 atm og 20 °C) 1,977 kg/m3 (luftformig ved 1 atm og 0 °C) | ||
| Smeltepunkt | 194,7 K | ||
| Kogepunkt | 216,6 K | ||
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | |||


Det kemiske stof kuldioxid, CO2 (også carbondioxid (Kemisk Ordbog) eller, på ældre dansk i henhold til Ørsteds dansksprogede nomenklatur, kultveilte) er et molekyle, med et kulstofatom og 2 oxygenatomer.
Ved atmosfærisk tryk kan kuldioxid kun findes i to tilstandsformer; som en gas, og ved temperaturer under -78,5 °C et fast stof, der ligner fin, tætpakket sne. På grund af den "manglende" væske-tilstand omtales dette faste kuldioxid som tøris, da det direkte omdannes til gas ved fordampning. Væskeformen findes, men den opstår kun ved tryk over 5,1 atm. Dette udnyttes ved opbevaring af kuldioxid på trykflaske.
Farer
Kuldioxid er tungere end luft og i høje koncentration kan den fortrænge luftens ilt. Den er uden lugt og kan medføre døden ved kvælning grundet iltmangel. Der opleves dog først væsentlige fysiologiske effekter, herunder forøget respiration (forpustet, stakåndethed) og narkotisk virkning [1]
En kulsyreslukker må aldrig tømmes ind i en beholder, hvor der kan være brandfarlige dampe, eksempelvis benzin, i et misforstået forsøg på at gøre atmosfæren ”sikker”. Det er livsfarligt. Der dannes gnister, som kan antænde dampene og medføre eksplosion [2]
Forbrænding
Kuldioxid dannes ved forbrænding, oxidation af organisk materiale som fossile brændstoffer og andet organisk materiale, når der er tilstrækkelig ilt (oxygen) tilstede. Hvis der er iltunderskud, kan der dannes kulmonooxid.
Respiration og fotosyntese
Ved respiration omdannes kulhydrater under optagelse af ilt til kuldioxid og vand. Respirationen foregår i alle levende organismer. Hos mennesker og dyr udåndes kuldioxid via lungerne. Et menneske udånder ca. 450 L kuldioxid svarende til 900 gram pr. dag.
Respirationsligningen: C6H12O6 + 6 O2 → 6 CO2 + 6 H2O
Planter optager kuldioxid ved fotosyntese og omdanner kuldioxid og vand til kulhydrater.
Fotosynteseligningen: 6 CO2 + 6 H2O → C6H12O6 + 6 O2
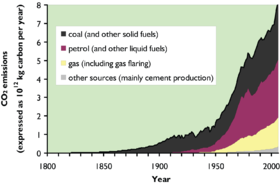
Kuldioxid er i dag til stede i Jordens atmosfære i en koncentration på ca. 0,04 % (400 ppm) i den tørrede luft.[3] [4] Koncentrationen er stigende, og er tiltaget med 40% siden industrialiseringen startede.
Luftens indhold varierer lidt med årstiden. Luftarten virker som en drivhusgas. Kuldioxid indgår i et stort kredsløb. Luftens indhold af kuldioxid er i ligevægt med hydrosfærens indhold af kuldioxid. Hydrosfærens stigende kuldioxidindhold medfører en ændring af pH kaldet forsuring. Verdenshavenes forsuring omtales som "det andet kuldioxid-problem".
Se også
- Drivhuseffekten, Havenes forsuring
- Dødens søer: Kivusøen, Nyossøen og Monounsøen
- Fotosyntese, Blad (organ), Autotrof, Heterotrof
- Geologisk CO2-lagring
- Jordens atmosfære
- Kulsyre, Tøris, Sodavand
- Respiration, Lunge, Gælle
Referencer
- ^ Kage årsag til iltmangel og indlæggelse på hospital - KemiFOKUS http://www.kemifokus.dk/wp-content/uploads/sites/7/DAK12-2015-s14-17.pdf
- ^ Kuldioxid er uegnet til kvælning af glødebrande - DTU Orbit http://orbit.dtu.dk/files/144426784/2018_01_DKemi_Kuldioxid_er_uegnet_til_kv_lning_af_gl_debrande.pdf
- ^ Earth's CO2 levels just crossed a really scary threshold - and it's permanent. ScienceAlert 2016
- ^ Carbon Dioxide. Opdatering fra NASA
Eksterne henvisninger
- Chemical of the Week: Carbon Dioxide Arkiveret 10. december 2004 hos Wayback Machine
- Grafer over udviklingen i den globale og den danske udledning af CO2
- Initiativ til reduktion af CO2 fra internettet
- Dry Ice information
- Sidste sted på Jorden krydser klimatisk milepæl. DMI 2016 Arkiveret 20. juni 2016 hos Wayback Machine
- 2005-07-06, Sciencedaily: NASA Satellite Data Capture A Big Climate Effect On Tiny Ocean Life Citat: "...El Niño and La Niña play with the populations of microscopic ocean plants called phytoplankton. That's what scientists have found using NASA satellite data and a computer model...Surprisingly, this study found that this transfer of carbon to the deep ocean increased by a factor of eight due to the large phytoplankton blooms that can occur during a La Niña..."
 |
Wikimedia Commons har medier relateret til: |


